miR-223-3p通过抑制VHL促进牙髓干细胞成骨分化的研究
来源:优秀文章 发布时间:2022-11-18 点击:
陆蓓蓓,朱友明
人牙髓干细胞(human dental pulp stem cells,hDPSCs)是人牙髓组织中具有自我更新功能的多能细胞,可诱导分化为成骨细胞、神经细胞、成软骨细胞和脂肪细胞。微小RNA(microRNA,miR) 是在真核生物中内源性表达长度为18~25个核苷酸的单链非编码RNA。有研究表明,miR-223-3p上调碱性磷酸酶(ALP)活性,扩增矿化结节数量,上调牙本质涎磷蛋白(DSPP)和牙本质基质蛋白1 (DMP-1)的蛋白水平,促进DPSCs成牙本质分化。低氧诱导因子-1α ( hypoxia inducible factor-1α,HIF-1α) 是HIF-1的活性单位,其调节数百个参与骨髓血管生成、血管反应和动脉血管生成的基因的转录活性。
HIF-1α和希佩尔林道(Von Hippel-Lindau,VHL)基因是肿瘤低氧反应的关键调控因子,在肿瘤血管生成和肿瘤侵袭中发挥重要作用。目前尚无文献报道HIF-1α、VHL与miR-223-3p表达的关系。在这项研究中检测miR-223-3p在低氧诱导DPSCs细胞中的表达,研究其对牙髓干细胞增殖能力的影响,预测miR-223-3p的结合靶点,并研究其与miR-223-3p的关系,检测VHL 及HIF-1α基因在DPSCs细胞中的表达,探究HIF-1α、VHL与miR-223-3p的表达在牙髓干细胞成骨分化过程中的作用。
1.1 主要材料
1
.1
.1
细胞来源 实验牙髓干细胞来源于临床收集年轻因正畸需要拔除的健康前磨牙或阻生齿。1
.1
.2
主要试剂 DMEM培养基(美国Gibco公司),miR-223-3p模拟物(miR-223-3p mimics )、miR-223-3p抑制剂(miR-223-3p inhibitor)、乱序RNA(scrambled RNA)(上海吉玛制药技术有限公司),胎牛血清(美国HyClone公司),RNA抽提试剂TRIzol(上海碧云天生物技术有限公司),实时荧光定量PCR (quantitative real-time PCR,qRT-PCR)试剂盒(日本TaKaRa公司),Bradford蛋白浓度测定试剂盒、RIPA裂解液(上海碧云天生物技术有限公司),反转录(reverse transcription,RT)试剂盒(日本TaKaRa公司)。1.2 方法
1
.2
.1
细胞培养 在无菌条件下,劈开牙齿,取出牙髓并切成碎片。首先滴1滴培养液在培养皿中,用消过毒的镊子把破碎的组织放入培养液。注意组织铺平不要重叠。在盖玻片的4角涂上无菌凡士林,轻轻地将盖玻片盖在组织上,使其贴壁生长;不要产生气泡。将DPSCs培养于含10%胎牛血清的DMEM培养基中,加入链霉素和青霉素,在5% CO、饱和湿度、37 ℃培养箱中培养。培养1周后,细胞爬出,待细胞长到汇合度90%~95%时进行传代。实验所用牙髓干细胞为第2~4代。倒置显微镜观察细胞生长情况,细胞传代后,每3 d 换液1次。
1
.2
.2
低氧处理DPSCs细胞 DPSCs细胞在含10%胎牛血清的DMEM培养基中培养至对数生长期后,低氧处理DPSCs细胞24 h(O浓度1%,CO浓度5%)。1
.2
.3
MTT法检测细胞增殖能力 取对数生长期的DPSCs细胞,分为miR对照组和miR-223-3p mimics组,每孔1 800个细胞均匀接种于96孔板上,每孔加200 μl培养基培养。每组设4个复孔,倒置显微镜观察细胞。原则上细胞贴壁后,按时间梯度添加miR-223-3p mimics处理DPSCs细胞,加入20 μl MTT 溶液( MTT浓度为5 g/L) ,5% CO,37 ℃继续孵育4 h 后吸走上清液,每孔加入二甲基亚砜(DMSO)150 μl,摇床低速振荡10 min,用酶联免疫检测仪测定各孔吸光度值,绘制细胞生长曲线图。1
.2
.4
qRT-PCR法测定目的基因miR-223-3p、VHL和HIF-1α以及成骨相关因子(Runx2、BMP2) 的mRNA 的表达 总RNA提取及cDNA合成:TRIzol法提取细胞总RNA,测浓度后,放在冰上待用。再进行逆转录获得cDNA,置-20 ℃保存备用。qRT-PCR法检测miR-223-3p、VHL和HIF-1α以及成骨相关因子(Runx2、BMP2) 的mRNA的相对表达水平,设计合成经GenBank检索的miR-223-3p、VHL、HIF-1α、Runx2、BMP2的引物。扩增条件为94 ℃预变性2 min,94 ℃变性30 s,56 ℃退火1 min,72 ℃延伸2 min,共35个循环。反应结束后,用琼脂糖凝胶电泳检测PCR反应产物,并在紫外灯下观察电泳带并拍照。1
.2
.5
Western blot 法检测HIF-1α 蛋白以及VHL蛋白的表达 收集细胞RIPA冰上裂解40 min(加入蛋白酶抑制剂),每隔5 min,摇匀1次。于4 ℃、12 000 r /min 离心15 min。取上清液到新管中,BCA 法测定蛋白质浓度,加入等体积2×SDS蛋白上样缓冲液,95 ℃煮15 min。使用12%的SDS-聚丙稀酰胺凝胶,用湿式电转移法把蛋白转移到PVDF 膜。TBST 冲洗5次,每次8 min,用含5%脱脂奶粉的TBST 溶液孵育一抗,4 ℃过夜。一抗稀释比例 β-actin 1 ∶500,HIF-1α 1 ∶200,VHL 1 ∶1 000。第2 天在室温下孵育二抗1 h 后TBST 洗涤5次,每次8 min。二抗用TBST稀释1 ∶5 000。配制新鲜HRP底物(A液和B液1 ∶1混合,避光),在化学发光检测仪上曝光检测。β-actin为内参。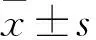
2.1 miR-223-3p在低氧诱导的DPSCs中的表达增多
低氧诱导DPSCs细胞24 h(O浓度1%,CO浓度5%),并选择常氧下培养24 h(O浓度21%,CO浓度5%)的DPSCs细胞作为Ctr组。24 h后提取细胞总RNA,收集蛋白。应用qRT-PCR 以及Western blot 方法检测低氧诱导组与Ctr组的miR-223-3p mRNA 相对表达水平以及HIF-1α 蛋白的表达。结果表明低氧诱导组DPSCs细胞中miR-223-3p mRNA相对表达水平明显高于Ctr组DPSCs细胞 (图1A) ,差异有统计学意义(P
<0.05)。用Western blot 方法检测2组DPSCs细胞HIF-1α蛋白表达水平。正常情况下,HIF-1α 蛋白在DPSCs细胞中的表达较低。低氧诱导DPSCs细胞24 h(O浓度1%,CO浓度5%),HIF-1α 蛋白表达明显增多(图1B)。
图1 miR-223-3p在低氧诱导的DPSCs中的表达
2.2 miR-223-3p靶向调控VHL
2
.2
.1
筛选miR-223-3p靶向作用的基因 通过生物信息学的方法,在targetscan 上对miR-223-3p的潜在结合位点进行预测,显示miR-223-3p潜在靶向VHL 3′-UTR 146~152位之间的碱基(图2) 。
图2 miR-223-3p潜在靶向VHL 3′-UTR 146~152位之间的碱基
2
.2
.2
荧光报告基因验证miR-223-3p靶向调控VHL 为进一步证明上述观点,该实验将野生型VHL(wt-VHL)与突变型VHL(mut-VHL)的3′UTR 区与双荧光报道载体pmirGLO连接。将重组载体与miR-223-3p mimics或scramble RNA两两组合共转染到hDPSCs细胞中,比较各组荧光信号的强弱。结果(图3)显示,mut- VHL和miR-223-3p mimics共转染细胞后,细胞的荧光信号值与mut- VHL和scramble RNA共转染组相比无明显变化,而将wt- VHL和miR-223-3p mimics共转染细胞后的荧光信号值与wt- VHL和scramble RNA共转染组比较显著降低(P
<0.05)。即与miR对照组相比,miR-223-3p显著抑制了野生型报告基因的相对活性,但没有抑制突变型报告基因的相对活性。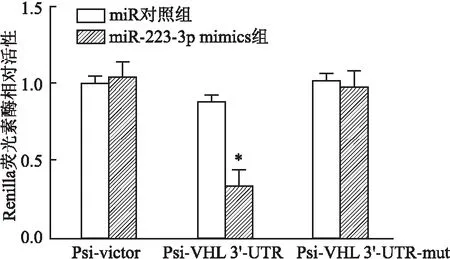
图3 luciferase 实验表明miR-223-3p靶向作用于VHL 与miR对照组比较:*P<0.05
2
.2
.3
细胞学验证miR-223-3p靶向调控VHL 将miR-223-3p mimics在脂质体介导下转染至DPSCs细胞,并选择表达scramble RNA的DPSCs细胞作为miR对照组。转染48 h后提取细胞总RNA和蛋白,用qRT-PCR检测miR-223-3p mimics组及对照组DPSCs细胞中miR-223-3p、VHL的mRNA的表达情况。结果表明,与miR对照组相比,表达miR-223-3p mimics的DPSCs细胞中miR-223-3p的mRNA 表达水平发生上调(图4A) ,VHL的mRNA 表达水平发生下调(图4B) (P
<0.05)。通过Western blot 方法检测HIF-1α、VHL蛋白表达水平。结果表明,与miR对照组相比,表达miR-223-3p mimics的DPSCs细胞中HIF-1α蛋白的表达上调,VHL蛋白的表达下调(图4C)(P
<0.05)。
图4 转染后2组miR-223-3p和VHL的mRNA 及HIF-1α、VHL蛋白表达水平变化
用miR-223-3p inhibitor反向验证miR-223-3p的作用,将miR-223-3p inhibitor在脂质体介导下转染至DPSCs细胞,并选择表达scramble RNA的DPSCs细胞作为miR对照组。转染48 h后提取细胞总RNA和蛋白,用qRT-PCR检测miR-223-3p inhibitor组及对照组DPSCs细胞中miR-223-3p、VHL的mRNA的表达情况。结果显示,与miR对照组相比,表达miR-223-3p inhibitor的DPSCs细胞中miR-223-3p的mRNA 表达水平发生下调(图5A) ,VHL的mRNA 表达水平发生上调(图5B) (P
<0.05)。通过Western blot 方法检测HIF-1α、VHL蛋白表达水平。结果表明,与miR对照组相比,表达miR-223-3p inhibitor的存在显著下调了HIF-1α蛋白的表达水平,显著上调了VHL蛋白的表达(图5C)(P
<0.05)。
图5 转染后2组miR-223-3p和VHL的mRNA 及HIF-1α、VHL蛋白表达水平变化
2.3 miR-223-3p对细胞增殖的影响
将miR-223-3p mimics在脂质体介导下转染至DPSCs细胞,并选择表达scramble RNA的DPSCs细胞作为miR对照组。转染0、12、24、48、72 h 后,通过MTT 实验检测miR对照组和miR-223-3p mimics组DPSCs细胞增殖能力。在培养DPSCs细胞72 h后,miR-223-3p mimics组较miR对照组细胞增殖能力则明显升高(图6),差异有统计学意义(P
<0.05) 。研究结果表明miR-223-3p可能促进DPSCs细胞增殖能力。
图6 miR-223-3p对细胞增殖的影响与miR对照组比较:*P<0.05
2.4 miR-223-3p促进成骨相关因子(Runx2、BMP2) 的mRNA的表达
将miR-223-3p mimics转染至DPSCs细胞,并选择表达scramble RNA的DPSCs细胞作为miR对照组。分别于转染0、1、4、7、14、21 d后检测miR-223-3p、VHL、HIF-1α和2个与成骨密切相关的基因。与miR对照组相比,随着转染时间的增加,自第4天起HIF-1α、Runx2和BMP2的mRNA表达显著增高,至第21天仍维持高水平,而VHL mRNA的表达水平自第1天起显著下降,之后一直维持着低水平(P
<0.05)。以上结果显示,miR-223-3p、HIF-1α、Runx2、BMP2的mRNA表达水平与转染时间呈正相关,VHL的mRNA表达水平与转染时间呈负相关。miR-223-3p促进成骨相关因子(HIF-1α、Runx2、BMP2) mRNA的表达。见图7。
图7 qRT-PCR分析目的基因转染DPSCs后成骨相关基因和miR-223-3p、VHL、HIF-1α的表达
HIF-1 是一种异源二聚体,由两个亚基组成,即O调节的HIF-1α 亚基和组成性表达的HIF-1β 亚基。正常氧浓度下,HIF-1α合成和降解的动态平衡使HIF-1α保持在低浓度,而在低氧条件下,HIF-1α的降解被抑制并在细胞内积累。HIF-1作为氧信号通路的核心,其生物活性可受到多种低氧诱导因子的调控,并影响其下游基因的转录。可以在整个人类基因组的数千个位点形成活跃的转录复合物,激活适应低氧的蛋白质的基因转录,包括促红细胞生成素(EPO)、VEGF 和糖酵解酶等,促进机体对低氧环境的适应。研究显示在牙周膜干细胞(periodontal ligament stem cells,PDLSCs)中敲除VEGF可降低成骨相关基因RUNX2、碱性磷酸酶(ALP)和I型胶原(COL1)的表达,低氧可增强PDLSCs成骨早期ALP、COL1和骨钙素(OCN)的表达。
VHL是一个编码pVHL抑癌蛋白的抑癌基因,pVHL参与E3 泛素连接酶复合物(VCBC) 的组成,VCBC 由pVHL、延长蛋白B、C 和Cul2 蛋白等形成。常氧情况下,VCBC可直接和HIF-1α经pVHL结合,泛素化修饰后被蛋白酶体降解。低氧环境中(或者细胞缺乏pVHL、)HIF-1α积聚在细胞核中并与HIF-1β形成HIF-1二聚体,HIF-1转录激活100~200个促进适应低氧环境的基因。有研究显示,泛素偶联酶E2S (ubiquitin-conjugating enzyme E2S,UBE2S)可通过泛素-蛋白酶体系统和VHL/HIF-1α /STAT3途径增强上皮间充质转变(epithelial-mesenchymal transition,EMT)。Frost et al首次揭示了一种有效的选择性化合物,一种名为VH298的VHL抑制剂,它为HIF靶向治疗增加了一个新的维度。研究表明VH298通过抑制羟基化HIF-1泛素化途径有效地激活HIF-1信号通路,显著增加成纤维细胞增殖、血管生成和I型胶原- a2l1 (Col1- a2l1)、血管内皮生长因子A (VEGF-A)和胰岛素样生长因子1 (IGF-1)的基因表达。
有研究表明,miR-223-3p通过靶向SHOX2抑制口腔鳞癌的增殖和转移。研究通过检测50例口腔癌患者治疗前后血清miR-223-3p的变化,显示血清中miR-223-3p的相对表达水平在研究中低于对照组,治疗后miR-223-3p表达明显高于治疗前。另有研究显示,抑制miR-223-3p可在转录水平和翻译水平显著降低VEGFA的表达,过表达miR-223-3p可显著提高VEGFR2的表达。
该实验通过低氧诱导DPSCs细胞显示miR-223-3p的mRNA 相对表达水平明显高于Ctr组,推测miR-223-3p可能与HIF-1α的表达相关。通过生物信息学的方法预测miR-223-3p的潜在结合靶点,显示miR-223-3p可能靶向VHL 3′-UTR 146~152位的之间的碱基。且经luciferase 实验表明,将miR-223-3p mimics转染至DPSCs细胞中,显示VHL的mRNA 表达水平下调,HIF-1α蛋白表达水平上调,VHL蛋白表达水平下调;
而将miR-223-3p inhibitor转染至DPSCs细胞中,显示VHL的mRNA 表达水平上调,HIF-1α蛋白的表达水平显著下调, VHL蛋白表达水平上调。该研究表明miR-223-3p靶向VHL 3′-UTR,抑制HIF-1α 的降解使HIF-1α 在细胞内过表达。将miR-223-3p mimics成功转染后检测miR-223-3p、VHL、HIF-1α和2个与成骨密切相关基因的表达情况。初步证实了体外miR-223-3p通过抑制VHL基因促进HIF-1α表达来促进牙髓干细胞成骨分化,体外实验结果给体内动物实验的研究奠定了基础。另有研究通过构建慢病毒载体转染DPSCs,结果显示其中突变组可以在常氧条件下稳定表达HIF-1α。在体外,HIF-1α通过促进VEGF的表达促进DPSCs血管向分化。