ATF4通过调控HKDC1对肝癌细胞增殖、迁移及凋亡的影响
来源:优秀文章 发布时间:2022-11-18 点击:
张 黎,崔 杰,王安琪,孙国平
肝癌是临床上最常见的恶性肿瘤之一,其发病率及病死率分别位居世界第6和第3,肝细胞癌(hepatocellular carcinoma,HCC)是肝癌中最常见的类型,占所有肝癌病例的75%~85%。目前,系统性化疗是肝癌患者的重要治疗手段,但由于治疗耐药性,晚期HCC患者在很大程度上仍无法缓解。因此,探索肝癌发生分子机制,寻找肝癌治疗新靶点,对肝癌患者的治疗有着极其重要的临床意义。
细胞内外各种因素如低氧、营养缺乏、氧化应激、Ca浓度改变等刺激,可使未折叠或错误折叠蛋白质在内质网中累积,导致内质网应激(endoplasmic reticulum stress,ERS)和随后的未折叠蛋白反应(unfolded protein response,UPR)的激活,研究表明ERS能通过调节肿瘤微环境来影响肿瘤进展和治疗。转录活化因子4 (activating transcription factor 4, ATF4)是参与UPR的蛋白激酶R样内质网激酶(proteinkinase R-like ERkinase, PERK)途径的重要组成部分,ATF4及其靶基因与肿瘤血管生成和转移有关,ATF4是治疗癌症的潜在靶点。相关研究表明己糖激酶结构域成分1(hexokinase domain component 1,HKDC1)可能是ATF4转录识别的靶点之一,HKDC1是近年发现的第五种己糖激酶,现已有研究表明HKDC1可能在乳腺癌、肺癌、结直肠癌及淋巴瘤中发挥致癌作用,但目前HKDC1在肝癌中的研究机制甚少。该研究通过观察敲低ATF4及HKDC1对HCC增殖、迁移及凋亡的影响,探讨其可能的分子机制。
1.1 材料
1
.1
.1
细胞株及培养 人HCC细胞株HepG2、Huh7(购自中国科学院上海细胞库);在含1%链霉素、1%青霉素和10%胎牛血清的DMEM高糖培养基中培养,细胞置于含5% CO的37 ℃加湿培养箱中培养,根据细胞生长状态及时换液和传代。
1
.1
.2
主要试剂 胎牛血清、DMEM高糖培养基(以色列BI公司);青-链霉素(美国Gibco公司);
胰蛋白酶、RIPA细胞裂解缓冲液、PMSF蛋白酶抑制剂(上海碧云天生物技术公司);
通用型ECL化学发光显影试剂盒(美国 ThermoFisher公司);
抗Bcl-2(BS1511)、Bax抗体(BS2538)(美国Bioword公司);
抗GAPDH抗体、山羊抗兔二抗、山羊抗鼠二抗(美国Biolegeng公司);
抗ATF4抗体(美国Proteintech公司);
抗HKDC1抗体(北京Bioss公司);
Annexin V-FITC凋亡检测试剂盒、CCK-8试剂盒(上海贝博生物科技有限公司);
脂质体Lipofectamine2000(美国Millipore公司);
ATF4小干扰RNA及其对照siRNA(上海吉玛公司);
结晶紫染色液(杭州吴鑫公司);
高纯度质粒小量快速提取试剂盒(北京Biomed公司)。
1
.1
.3
主要仪器 酶标仪(美国Bio-Tek公司)、流式细胞仪(美国Beckman Coulter公司)、化学发光成像分析仪(美国GE公司)。1.2 方法
1
.2
.1
质粒提取 取200 μl菌液(shNC、shHKDC1)于10 ml含有氨苄抗生素的液体LB培养基中,200 r/min、37 ℃振荡培养过夜,次日根据质粒提取试剂盒按步骤提取质粒后上机检测浓度。1
.2
.2
细胞转染 预先将HepG2和Huh7接种于6孔板中,待细胞生长融合率达50%~60%开始转染,将细胞分组设置为阴性组(si-NC、shNC)、转染组(si-ATF4、shHKDC1),按照Lipofectamine2000说明书进行转染,6 h后将无血清的Opti-MEM培养基更换为含10%血清的完全培养基,转染后继续培养48 h用于后续实验。序列信息如下:si-NC:5′-UUCUCCGAACGUGUCACGUTT-3′(F),5′-ACGUGA CACGUUCGGAGAATT-3′(R);siATF4:5′-CCUGAA AGAUUUGAUAGAATT-3′(F),5′-UUCUAUCAAAUC UUUCAGGTT-3′(R);shNC:5′-TTCTCCGAACGTGT CACGT-3′;shHKDC1:gcCTTGCTAATACAAGAGA GA。1
.2
.3
CCK-8法检测细胞增殖 将HepG2和Huh7以每孔100 μl的接种量(细胞密度为3×10个/ml)接种于96孔板中,每组设置6个复孔,分别在转染后24、48、72 h加入CCK-8检测试剂(10 μl/孔),继续孵育2 h后使用酶标仪检测在450 nm处的吸光度(optical density,OD)。1
.2
.4
克隆形成实验检测细胞增殖 将转染后的细胞按500个/孔接种于6孔板中,培养1~2 周,直至肉眼可见克隆形成结束培养,用PBS轻轻清洗3次后,用4%多聚甲醛固定15 min,再用0.5%结晶紫染色30 min,在显微镜下观察对照组和转染组克隆数目(细胞数>50个计为一个克隆)。1
.2
.5
流式细胞术检测细胞凋亡 细胞转染48 h后用0.25%的胰蛋白酶(不含EDTA)消化,用预冷的PBS洗涤细胞2次,离心收集细胞后用400 μl膜联蛋白V(Annexin V)结合缓冲液重悬,加入5 μl异硫氰酸荧光素(fluorescein isothiocyanate,FITC)室温下避光孵育15 min,再加入5 μl碘化丙啶(propidium,PI)室温下避光孵育5 min后上机检测,获取数据后使用CytExpert软件进行分析。1
.2
.6
划痕实验检测细胞迁移 将转染后的细胞按5×10个/孔接种于6孔板中,待细胞生长融合率达90%,用Marker笔在6孔板背面划3条直线,用200 μl枪头垂直板面匀速划痕,使划痕线垂直于3条标记线,用PBS洗去脱落细胞后加入无血清培养基继续培养,分别于培养0、24 h后在4倍光学显微镜下拍照(选取标记线与划痕相交处拍照,保证2个时间点拍照视野一致)用Image J软件分析并计算划痕愈合率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。1
.2
.7
Western blot检测相关蛋白的表达 细胞转染48 h后加入含PMSF的RIPA裂解液置于冰上裂解30 min后刮取细胞裂解物,4 ℃,14 000 r/min离心15 min后收集上清液;使用BCA试剂盒进行蛋白定量;
在蛋白上清液中加入4×Loading buffer后在100 ℃条件下加热10 min制备蛋白样品;
用SDS-PAGE凝胶电泳分离蛋白质,并将其转移至PVDF膜,用5%脱脂牛奶封闭1 h,用特异性一抗在4 ℃下孵育过夜,包括ATF4(1 ∶1 000)、HKDC1(1 ∶500)、GAPDH(1 ∶2 000)、Bax(1 ∶1 000)、Bcl-2(1 ∶1 000),再用相应的二抗(1 ∶10 000)在室温下孵育2 h,最后用ECL发光显影检测蛋白;
用Image J软件进行条带分析并计算其灰度值。
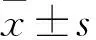
2.1 敲低ATF4对肝癌细胞增殖的影响
用CCK-8法和克隆形成实验来检测si-NC组和si-ATF4组肝癌细胞的增殖情况。CCK-8结果显示,与si-NC组相比,敲低ATF4抑制肝癌细胞增殖能力,差异有统计学意义(t
=3.408,t
=6.261,t
=7.393;t
=5.271,t
=9.135,t
=9.853;均P
<0.01)(图1A);克隆形成结果显示,与si-NC组相比,敲低ATF4抑制肝癌细胞克隆形成能力,差异有统计学意义(
t
=17.270,t
=16.280;均P
<0.01)(图1B)。
图1 敲低ATF4对HepG、Huh7细胞增殖和克隆形成的影响
2.2 敲低ATF4对肝癌细胞迁移能力的影响
划痕实验结果显示,24 h后si-ATF4划痕组愈合率较si-NC组低,差异有统计学意义(t
=17.420,t
=19.310;均P
<0.01)(图2)。结果表明抑制ATF4基因的表达可能抑制肝癌细胞的迁移潜能。
图2 敲低ATF4对HepG2、Huh7细胞迁移的影响 ×4与si-NC组比较:**P<0.01
2.3 敲低ATF4对肝癌细胞凋亡率的影响
流式细胞术检测结果显示,与si-NC组比较,抑制ATF4基因的表达后,HepG2和Huh7细胞凋亡增加,差异有统计学意义(t
=8.786,t
=6.872;均P
<0.01)(图3A);为了进一步探究敲低ATF4诱导肝癌细胞凋亡的机制,用Western blot检测肝癌细胞中Bax和Bcl-2蛋白的表达情况,结果显示,敲除ATF4可上调肝癌细胞中Bax蛋白的表达而下调Bcl-2蛋白的表达,相较于si-NC组,si-ATF4组Bcl-2/Bax的比值显著降低,差异有统计学意义(
t
=22.710,t
=37.950;均P
<0.01)(图3B)。
图3 敲低ATF4诱导HepG2、Huh7细胞凋亡
2.4 ATF4通过调控HKDC1对肝癌细胞增殖产生影响
为了探究ATF4在肝癌细胞中对HKDC1的调控作用,该研究在HepG2和Huh7细胞系中敲除ATF4后,用Western blot检测HKDC1基因的表达,结果显示沉默ATF4可以下调肝癌细胞中HKDC1蛋白的表达,差异有统计学意义(t
=12.340,t
=5.586;t
=13.850,t
=14.850;均P
<0.01)(图4A);为了进一步探究HKDC1在肝癌细胞中的作用,在HepG2和Huh7细胞系中敲除HKDC1后,进行细胞增殖和凋亡检测,结果发现敲除HKDC1后,CCK-8检测发现两种细胞系的增殖均受到抑制(
t
=4.393,t
=9.673,t
=6.747;t
=5.677,t
=9.960,t
=10.750;均P
<0.01);另外,流式细胞凋亡术结果显示,与shNC组对比,抑制HKDC1的表达后,HepG2和Huh7细胞凋亡增加,差异有统计学意义(
t
=7.836,t
=9.016;均P
<0.01)(图4B、C);划痕实验结果显示,与shNC组相比,shHKDC1组肝癌细胞迁移能力降低,差异有统计学差异(t
=14.830,t
=20.420;均P
<0.01)(图4D)。
图4 ATF4可能通过靶向HKDC1促进HepG2、Huh7细胞增殖迁移 ×4
在低氧、营养缺乏的肿瘤微环境下,肿瘤细胞仍可生存下来,这可能与导致细胞存活的压力相关信号通路的激活有关,ATF4是其中的关键介质,其通过参与氧化还原稳态、自噬和血管生成的基因转录来促进肿瘤细胞存活,维持肿瘤代谢的平衡,目前已有关于在肝癌治疗中靶向ATF4途径增强细胞药物敏感性的相关研究的报道。与正常组织相比,ATF4在肿瘤组织中表达增高,其在肿瘤进展中的作用已被证实。为了研究ATF4在肝癌细胞生长中的作用,该研究使用ATF4特异性的siRNA有效抑制ATF4在肝癌细胞株HepG2和Huh7中的表达后,观察肝癌细胞体外增殖迁移能力和凋亡的变化,结果显示细胞内Bax蛋白表达上调,Bcl-2蛋白表达降低,肝癌细胞凋亡增加且增殖迁移受到抑制。为进一步观测其长期效应,采用相同的方法研究其对肝癌细胞克隆形成的影响,发现沉默ATF4的表达后成功抑制了肝癌细胞的克隆形成。
ATF4是由各种应激和病理诱导的适应性综合应激反应(ISR)的关键调节因子,相关研究表明,内质网应激可诱导ATF4介导的HKDC1基因的转录上调,HKDC1基因是ISR的一个新的候选成分,ISR期间HKDC1的上调通过刺激葡萄糖在细胞内聚集,并将其驱动至糖酵解过程中,有助于克服应激期间能量的缺乏。该研究假设ATF4通过上调HKDC1的表达来增强肝癌细胞的增殖及迁移能力,研究显示抑制ATF4在肝癌细胞株HepG2和Huh7中的表达后,蛋白表达下调,证实了在HCC中ATF4对HKDC1蛋白表达的调节作用。有研究表明,肿瘤细胞能量代谢方式发生改变,即使在氧气充足的情况下,肿瘤细胞仍主要利用糖酵解而不是氧化磷酸化来产生能量,这种现象被称为“Warburg效应”,这种肿瘤细胞中的有氧糖酵解反应能产生大量三磷酸腺苷(ATP)和生物合成所需的代谢中间体,以满足肿瘤生长和恶性进展中大量的生物合成和能量需求,是肿瘤细胞生长、增殖及转移的重要因素之一。己糖激酶(HKs)是糖酵解第一步的关键代谢酶,其中,HKDC1是一种新的HK亚型,据相关研究表明,HKDC1在肿瘤组织中表达增多,是一种新的潜在的肺癌治疗靶点。该实验通过抑制HKDC1在肝癌细胞中的表达来观察其对肝癌细胞生物学行为的影响,结果显示敲低HKDC1的表达对HepG2和Huh7肝癌细胞株有增殖抑制和诱导凋亡的作用。该研究进一步证实ATF4可能作用于HKDC1并增强其表达,从而在肝癌细胞的增殖、转移中发挥作用。综上所述,该研究证实了ATF4和HKDC1在HCC进展中的作用,是肝癌治疗的候选靶点。
推荐访问:增殖 肝癌 迁移推荐文章