IP-PTX,联合SOX,方案转化治疗晚期胃癌腹膜转移的疗效与安全性评估
来源:优秀文章 发布时间:2023-04-25 点击:
冀志祥 赵玉兰
(1.西藏大学医学院;
2.西藏自治区人民医院肿瘤科,西藏 拉萨 850000)
胃癌(GC)当下全世界范围内发病率高,严重威胁着患者的身心健康,此疾病死亡率较高,因此越来越获得大众的关注和重视[1]。在当下社会市场中许多人日常生活和工作较为忙碌,不规范的饮食导致患有胃病的人数不断提升,这也是胃癌发生的重要诱因[2]。腹膜转移(PM)是进展期胃癌(GC)患者最常见的转移类型和复发部位[3-5],一经发现往往处于晚期,之前针对PM 的患者仅全身化疗对腹膜病变的效果有限[6-8],可能是因为所谓的腹膜-血浆屏障阻止了有效的药物从体循环输送到腹腔[9],这就增加了治疗难度,目前胃癌腹膜转移依然缺少有效根治手段。NIPS 治疗 GCPM 的研究主要在日本进行,紫杉烷(紫杉醇或多西他赛)和 5-FU(卡培他滨或S-1)的组合是最常用的方案[10,12]。然而,这样的双药与腹膜转移瘤相比,该方案对原发性肿瘤的效果要差得多,这得到PM 多年来得到有效控制但许多患者的原发性肿瘤在短时间内进展这一事实的支持[13]。2011年以来,紫杉醇或多西他赛、奥沙利铂、S-1(DOS)三联方案作为局部晚期GC 的新辅助全身化疗(NSC)和转移性GC 的转化疗法一直处于多中心研究实验当中,争议不断。在过去的临床研究中,我们对包括IP-PTX 在内的化疗后PM 消失或明显缩小的患者进行了转换胃切除术,显示出良好的效果[12,13]。在转换治疗环境中通常需要进行强化化疗,以最大程度缩小肿瘤并消除手术前的腹膜扩散。紫杉醇(PTX)或多西紫杉醇(DTX)由于其大分子量和亲脂性而通过淋巴系统缓慢吸收,当腹腔内给药时,很容易在腹膜腔内获得高浓度和长时间的药物作用[14]。故紫杉烷被认为是IP 给药的最理想药物,已被广泛探索为治疗GCPM 的新辅助腹膜内和全身化疗[15]。然而,S-1和IV-PTX 对原发肿瘤和腹膜外转移的效果不如对腹膜病变的效果,故我们引入其他联合IP-PTX 的系统方案。为了提升胃癌腹膜转移患者的治疗效果,延长患者生存时间,本文选取我院2018 年1 月—2022 年4 月收治的64 例胃癌腹膜转移患者作为研究对象,探讨IP-PTX 联合SOX 方案(奥沙利铂、S-1)对于胃癌腹膜转移的临床疗效、不良反应及预后因素,具体报告如下。
1.1 一般资料
研究对象为2018 年1 月—2022 年4 月我院收治的64 名胃癌腹膜转移患者,针对其各项临床资料进行收集整合后为本次研究的基础,均等分为观察组和对照组,所有患者自愿参与并签署了告知书。纳入标准:(1)经影像学证实不能切除或复发的胃腺癌;
(2)经分期腹腔镜或计算机断层扫描诊断为腹膜播散;
(3)年龄>20 岁;
(4)身体状况:ECOG:0-1;
(5)骨髓功能正常(白细胞计数3000~12000 个/mm3);
(6)血红蛋白>8.0g/dl 和血小板计数>10000/mm3;
(7)肝功能正常(血清总胆红素水平<2.0mg/dl 和血清转氨酶<100U/L);
(8)肾功能正常(血清肌酐水平在正常上限内);
(9)预期生存期≥6 个月;
(10)卵巢以外无远处器官(肝、肺、骨)转移;
(11)无其他活动性伴发恶性肿瘤或其他主要疾病。排除标准:治疗耐受性较差者;
患者同时合并有肠梗阻或胃流出道梗阻者;
不愿意自主参与到此次研究的患者;
患者精神存在异常,自主表达能力弱;
不愿意配合医务人员协同治疗的患者;
患有多种癌症的患者。两组患者一般资料并不具备明显的差异(P >0.05),能够展开实验研究,如表 1 所示。

表1 两组患者一般资料对比

表1 (续)
1.2 方法
腹膜转移分级和术前评估。每个患者行腹部联合盆腔增强CT 或超声内镜检查来确定肿瘤和区域淋巴结分期。根据日本胃癌分类第12 版行常规腹腔镜探查后确定PM 分型范围[12]。根据日本传统的5 点法,由放射科资生医生根据CT 影像估计腹水量[16],定量为+:<500mL,++:500~2000mL,+++:>2000mL。
新辅助化疗。NIPS 方案:第1 天经IP(腹腔)导管给予紫杉醇(30mg/m2)。第1 天静脉注射紫杉醇(45 mg/m2)和奥沙利铂(130 mg/m2),根据患者体表面积予以S-1(1.25 m2时80 mg/d;
1.25~1.5 m2时100mg/d;
1.5 m2时120mg/d PO d1-14 q3w );
NSC方案:在治疗首日根据患者病情情况静脉注射紫杉醇(75 mg/m2)和奥沙利铂(130 mg/m2),计算后予以S-1(1.25m2时80 mg/d,1.25~1.5m2时100mg/d,1.5m2时120 mg/d PO d1-14 q3w )。
化疗后患者瘤体反应及转化手术。通过肿瘤标志物CEA、CA19-9、CA125、腹膜细胞学检查和增强CT 或化疗每3 周后来评估化疗后肿瘤反应。将腹水反应分为消失、减少、进展和稳定,CT 评判依据依次为:CT 无法检测、腹水较前减少>30%、腹水较前增加>20%和体积无法定性为减少或进展。当机体可耐受瘤体手术切除或腹膜细胞学检查回示阴性或第二次CT 评估原发肿瘤可切除时行第二次腹腔镜探查,如果P0CY1 无不可切除的转移,P1-3 发现腹膜结节消失或其数目和大小减少,病理冰冻结果为阴性,即行转化手术,包括胃癌根治术和标准化的D2 淋巴结清扫;
当总体评估为稳定或更好时,非手术患者继续进行原化疗方案并按照上述相同的方式进行病情评估,直到疾病进展、出现不可耐受的毒性或无法继续配合治疗。评估为PD 的患者被转到二线治疗。
1.3 观察指标与疗效判定标准
观察指标:为了实时动态掌握患者的疾病治疗情况采用线上联系方式,通过运用现代化电子传媒对患者展开1~3 年随访,针对两组患者的生存率状况、手术转化、R0 切除、腹膜转移、细胞学反应及并发症等情况进行对比并详细记录;
密切监测患者在治疗期间出现的各种不良症状并做好记录,进行对比。
疗效判定标准:对所有患者近期治疗情况进行随访,通过医学影像技术评价新病灶进展状况,根据RECIST 指南1.1[17]的实体瘤反应评价标准(RECIST)来评估患者的近期肿瘤缓解情况,其中主要涉及的指标:病情进展为 PD、病情稳定为 SD,部分缓解为 PR,完全缓解为 CR。病情缓解率(ORR)= PR+ CR,病情控制率(DCR)= SD + CR + PR[18];
腹水反应:分为消失、减少、进展和稳定,CT 评判依据依次为:CT 无法检测、腹水较前减少>30%、腹水较前增加>20%和体积无法定性为减少或进展;
腹膜细胞学反应:膜细胞学检查回示阴性或阳性;
转换手术率及R0 切除率不断升高;
通过Log rank 检验分析确定的具有统计学意义影响预后的单一变量及通过Cox回归模型行影响疾病预后的多因素分析。
1.4 术后处理及随访
两组患者均优先采用奥沙利铂联合S-1 辅助化疗3 个周期。不能耐受2 种药物治疗的患者予以S-1 单药治疗。所有患者均按我们先前所述定期随访,从确诊之日起计算总生存期。
1.5 统计学方法
本次在展开实验调研分析时选择统计学工具为SPSS 26.0 统计学软件,通过各项数据资料进行收集整合后运用卡方检验和t 检验,同时采用Kaplan-Meier 法针对两组患者生存率状况进行了对比并描绘了生存曲线,Log rank 检验分析变量之间存在的差异是否具备统计学价值,存在差异性的则采用 Cox 回归模型。P <0.05 表明差异存在统计学价值。
2.1 对化疗的反应和手术结果的分析
如表2 所示,观察组和对照组平均每位患者的NAC周期数分别为6.7+1.9(2~12)和6.5+1.8(3~11)(P>0.05)。患者在临床治疗后反应存在着明显的差异性(P <0.05),其中观察组患者ORR 为50%,DCR 为93.75%,对照组患者ORR 为37.50%,DCR为62.50%,两组对比观察组明显较高(P <0.05);
在腹水反应(P <0.001)和细胞学反应(P <0.001)方面,观察组也优于对照组:观察组腹水消失率为45.3%,而对照组为10.8%.观察组细胞学检查阴性率为73.2%,对照组为43.7%;
转换手术结局:观察组中18 例(56%)行转换手术,其中R0 切除15 例(48%);
对照组11 例(35%)行转换手术,其中R0 切除10 例(31%),表明观察组与较高的转换手术率和R0 切除率显著相关。两组围手术期死亡0 例,手术并发症发生率无明显差异(观察组27.5%与对照组24.0%,P=0.426)。

表2 对化疗的反应和手术结果

表2 (续)
2.2 两组患者不良反应对比分析
如表3 所示,两组都没有与NAC 相关的死亡,两组中3 级和4 级化疗后相关不良事件的发生率状况并不存在明显的差异性(P >0.05),最主要出现的不良症状反应为患者白细胞和中性粒细胞数量的降低。

表3 3 级和4 级NAC 相关不良事件
文献来源:根据国家癌症研究所通用毒性标准3.0 版评估不良反应[19]。
2.3 两组生存分析
如表4 所示,观察组和对照组的中位随访时间分别为43.0(95% CI37.4~48.6)个月和59.0(95%CI29.9~88.1)个月(P <0.003)。两组患者中位生存期分别为21.0(95%CI:15.7~26.3)个月和16.0(95%CI:14.8~17.2)个月,针对各项指标进行对比后分析发现观察组的OS 较为优秀(P <0.001)。两组患者1 年内生存状况并不存在显著差异(P >0.05),而观察组患者2 年和3 年生存率较高(P <0.05)。

表4 两组患者远期生存率对比分析(n =32)
2.4 两组预后相关分析
如表5 所示,单变量分析表明预测患者生存率指标可能包括预后相关因素和治疗相关因素。预后相关因素包括:手术状态、CT 分期、CN 分期、P 分期和腹水量;
治疗相关因素(P <0.001)包括:化疗方案、化疗后瘤体反应、腹水反应、细胞学反应、转手术率、R0 切除率(以上P <0.001)及手术临床并发症发生状况(P=0.006)。如表6 所示,经多因素分析:P 分期、腹水反应、R0 切除率和中转手术率(以上P <0.001)是导致患者康复状况受到影响的重要因素。

表5 影响预后因素的单因素分析(n=32)

表5 (续)
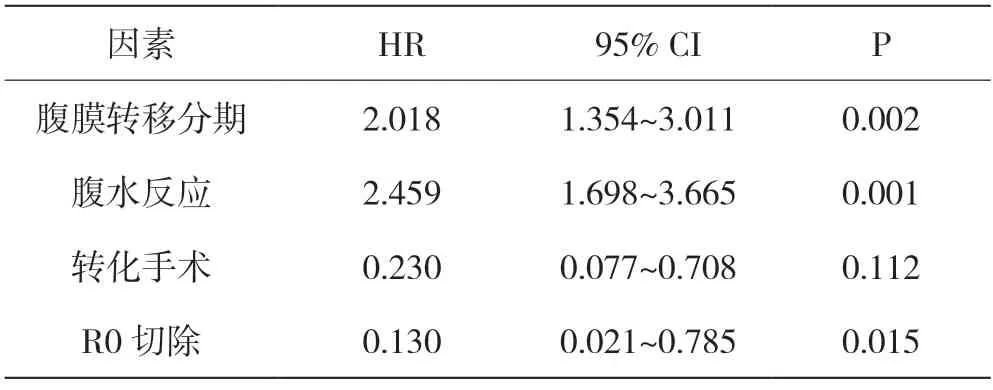
表6 影响预后因素的多因素分析(n=32)
本文论证了NIPS 方案较NSC 方案在GCPM 疗法更具疗效性和安全性。本研究表明NIPS 方案在腹水反应和细胞学反应方面较NSC 方案更具优势,且手术转化率和R0 切除率更高,显著提高了患者存活率。两者的总体化疗毒性虽相对较高但并不存在明显的差异性,在临床中主要表现为患者中性粒细胞、白细胞的降低以及神经病变,而这些不适症状对于患者身心方面都会带来极大的痛苦,需要采用有效的治疗干预对策。本研究成果的新三联NIPS 方案在备受争议的GCPM 治疗方案中又迈出了更近一步。美国和日本胃癌治疗指南推荐多西紫杉醇、顺铂和S-1 三联全身化疗方案用于治疗GCPM,总体预后较差[20-22],仅靠全身化疗难以消除PM。
紫杉烷类药物IP 给药可增强对原发肿瘤和PM的抗肿瘤作用。IP 给药后经淋巴系统吸收缓慢,可使药物与腹膜播散结节及腹膜腔内游离癌细胞直接相互作用,即使反复给药也很少引起腹部纤维化粘连,成效显著[23]。为了减少奥沙利铂用药的神经毒性,有些研究偶尔跳过或减少给药剂量,大多数患者都能耐受。事实上,在大多数患者中,奥沙利铂被停用,并在随后的联合化疗过程中给予S-1 加IPPTX。这表明,在以前的研究中确定的IP-PTX 推荐剂量(40mg/m2)减少后所有患者的1 年、2 年OS 率分别为79.5%和48.4%,PCI 评分低的患者预后更好;
全身性奥沙利铂给药的总剂量减少也可增加患者的R0 切除率,结果与IP-PTX 与S-1/PTX 联合应用的研究结果基本一致[24,25]。国外一项研究表明,IPPTX 的重复对于延长患者的生存期很重要[26],意义在于能够有效的增强对抗肿瘤的能力,有待于我们进一步研究探索[27]。
准确的术前评估PM 对于确定治疗方案至关重要。多变量分析显示腹水控制是影响患者生存的独立预后因素[28,29],恶性腹水的良好控制与患者的OS 改善密切相关[28]。然而,目前的影像技术对腹水精准诊断尚不完善。CT 在癌症研究和治疗GC 中检测腹膜转移的敏感性较低,通常仅在手术中诊断腹膜转移。但是术前ct 扫描仍然是必要的,因为它有助于确定恶性肿瘤的存在和大概腹水量。另一方面关于腹水反应的量的评估也无标准。目前广泛采用日本常规5 点法的ct 扫描对腹水体积进行量化,并对腹水体积变化设定+10%的截断值进行评估,同时也有人在超声检查的基础上估计腹水深度减少50%来评估腹水的反应[29]。所以未来对癌性腹水量的变化的精准评估在医学先进仪器上还需进一步研发并与现有仪器综合评估的经验还需交流。
腹腔化疗姑息性胃切除术能否提高GCPM 的生存率值得进一步考究。某些研究表明SOX 方案对腹膜外病变的治疗效果更加显著,毒性可接受,具有很强的抗肿瘤活性(pCR 率 33%,pRR 83%,病理分期 67%),可能更适合中转手术的诱导化疗[30,31]。以往文献很少将PM 与其他形式的转移进行区分,故对GCPM 的具体治疗效果难以评估[32]。在Nakamura等人的一项回顾性研究中,GC 合并CY1P0 或P1 的患者中28.8%(17/59)行转换手术,中位生存期CY1P0:41 vs 11个月;
P1:31 vs 10个月。Yasufuku 报道了铂和氟尿嘧啶联合NSC 方案对P0CY1 的GC患者的胃切除率为40.6%(13/32),3 年生存率为76.9%[33]。这些结果表明,对于无肉眼可见腹膜病变的GCMM 患者,仅使用NSC 而不使用IP 足以达到令人满意的转化率。由于本研究的样本量非常小,因此应谨慎解释。
转化胃切除的适应征标准和时机是未来最关键的问题。在PM 反应良好后进行胃切除术有助于改善患者的预后。患者术后化疗耐受性下降,抗肿瘤免疫功能下降,从而导致隐匿性残留肿瘤的进展,进行胃切除术可能防止原发肿瘤或腹膜外病变重新生长所引起的临床症状,并有助于维持整个治胃切除的适应证标准疗过程中的生活质量。在研究过程中仅仅针对在行腹腔镜检查之后体现出PM 有缩小趋势以及腹膜细胞学检查结果为阴性的患者展开胃部切除手术治疗,看似合理,然而,全身麻醉下的腹腔镜检查会引起手术压力,从肿瘤学的角度来看,会产生不利影响。需要进一步研究来验证适应症及确定合适的手术时机。术后辅助化疗应尽快恢复。未来通过生物标志物变化来预判转化手术时机或作为胃切除的适应征标准之一也是我们探索的领域。
综上所述,对胃癌腹膜转移患者应用NIPS 方案更能够有效控制疾病进展,提高患者远期生存率,而且安全性好,不增加不良反应现象。本研究为回顾性、单中心队列研究,人群相对较少。未行PSM 分析尽可能减少选择偏倚,未来仍需行前瞻性随机对照试验以进一步确认该结论。
猜你喜欢腹水紫杉醇腹膜肉鸡腹水咋防治今日农业(2020年18期)2020-12-14活血化瘀药对腹膜透析腹膜高转运患者结局的影响透析与人工器官(2020年1期)2020-11-16山莨菪碱在腹膜透析治疗中的应用透析与人工器官(2020年1期)2020-11-16一例黄颡鱼腹水病的处理案例当代水产(2019年8期)2019-10-12紫杉醇脂质体与紫杉醇不同途径灌注治疗兔舌癌的疗效研究实用口腔医学杂志(2017年6期)2017-09-19脂质体紫杉醇周疗方案与普通紫杉醇治疗乳腺癌的疗效及不良反应比较中外医疗(2016年15期)2016-12-01护理干预对预防紫杉醇过敏反应疗效观察哈尔滨医药(2015年2期)2015-12-01关于腹膜透析后腹膜感染的护理分析哈尔滨医药(2015年2期)2015-12-01中西医结合治疗肝硬化腹水30例中国中医药现代远程教育(2014年11期)2014-08-08紫杉醇新剂型的研究进展安徽医药(2014年4期)2014-03-20推荐访问:腹膜 胃癌 晚期