METTL16在鸡不同类型肌肉中的表达规律及其对肌肉功能的调控作用
来源:优秀文章 发布时间:2023-04-18 点击:
庞立川,单艳菊,刘一帆,章 明,甘达峰,屠云洁,姬改革,巨晓军,束婧婷*,邹剑敏*
(1.江苏省家禽科学研究所 江苏省家禽遗传育种重点实验室,扬州 225125;
2.崇仁县畜牧良种场,抚州 344200)
随着生活水平的不断提高,人们对鸡肉品质的要求也越来越高,如何提高鸡肉品质已成为肉鸡育种学者需要面对的关键问题。骨骼肌作为动物躯体最主要的组成部分,约占体重的40%[1]。肌纤维是骨骼肌的基本构成单位。肌纤维的形成是一个复杂的过程,由单核成肌细胞增殖融合形成多核肌管,最后肌管进一步分化形成。通常,骨骼肌群由具有不同理化特性的肌纤维混合组成,骨骼肌群中肌纤维类型的组成因部位和功能不同存在较大区别,并可能随着生长发育和环境应激发生相互转化[2]。研究表明,肌纤维类型与鸡肉品质密切相关,总体上,慢肌纤维含量多的肌肉其肉品质要优于快白肌纤维含量多的肌肉[3]。因此,揭示鸡骨骼肌肌纤维类型形成及其转化机制对改良鸡肉品质具有重要意义。
N6-甲基腺苷(m6A)修饰于1974年首次在大鼠的信使RNA中被发现[4]。m6A修饰是真核生物中含量最丰富的内部修饰,影响RNA的剪接、转录、翻译、定位、代谢和稳定性[5]。m6A修饰广泛存在并涉及多个生理过程,如胚胎发育、神经发生、性别决定和肿瘤发生等[6-8]。m6A修饰需要甲基转移酶、去甲基化酶以及识别蛋白来发挥作用。甲基转移酶METTL3和METTL14共同构成甲基转移酶复合体的异二聚体核心,介导RNA特定位点的甲基化[9]。METTL3发挥主要的催化活性[10],METTL14不具有催化活性但可以促进METTL3与底物的结合[11]。已有很多研究发现m6A甲基化与肌肉生长发育存在联系,但大多来自哺乳动物的研究。例如m6A甲基化酶METTL3通过提高Wnt通路的LEF1 mRNA甲基化水平,正向调控骨骼肌分化[12]。METTL3/14还可通过甲基化ERK信号通路的关键调节因子MNK2 mRNA,调节MNK2蛋白水平,反向调控骨骼肌分化[13]。去甲基化酶FTO可通过去甲基化GADD45BmRNA提高p38 MAPK磷酸化水平,促进骨骼肌分化[14]。
本课题组前期发现甲基化转移酶METTL3和METTL14在鸡不同类型肌肉组织中差异表达[15]。METTL16是继METTL3和METTL14之后,近几年新发现的另一种m6A甲基转移酶[16-18]。为深入探究METTL16甲基化转移酶在鸡肌肉功能中的作用,本研究检测了METTL16在鸡不同类型肌肉组织中的表达水平,同时在体外干扰鸡原代成肌细胞中的表达,分析METTL16敲低表达后对鸡成肌细胞增殖的影响以及对肌细胞分化相关基因和肌纤维类型标志基因表达的影响。本研究结果为进一步阐明m6A甲基化修饰在鸡骨骼肌中的作用提供理论依据。
1.1 试验动物
本研究使用的种蛋来源于扬州翔龙禽业发展有限公司,置于实验室孵化器(温度设为37.5 ℃,湿度设为60%)孵化至11胚龄时用于鸡成肌细胞提取。随机选取体重变异系数在5%之内的120日龄(上市日龄)广西麻鸡母鸡6只,采集胸大肌、胸小肌、缝匠肌、耻坐骨肌内侧肌、耻坐骨肌外侧肌、髂胫外侧肌、腓肠肌内侧头肌和背阔肌组织样,置于液氮速冻,然后转入-80 ℃冰箱保存备用。
1.2 主要试剂
DMEM培养基、EDTA胰酶、胎牛血清、马血清、Opti-MEMⅠReduced Serum Medium购自美国Gibco公司;
CellCounting-Lite 2.0试剂、反转录试剂盒、荧光定量试剂盒购自南京诺唯赞生物科技股份有限公司;
siRNA购自广州锐博生物科技有限公司;
LipofectamineTMRNAiMAX转染试剂购自美国Invitrogen公司;
RNase-free ddH2O、TRIzol购自天根生化科技(北京)有限公司;
DEPC、氯仿、无水乙醇、异丙醇购自生工生物工程(上海)股份有限公司。
1.3 引物设计及合成
根据GenBank公布的鸡METTL16及鸡成肌细胞分化标志基因MyoD、MyoG和肌纤维分型标志基因MyHC以及内参基因β-actinmRNA序列,利用在线工具Primer 3设计引物,送由生工生物工程(上海)股份有限公司合成。引物信息见表1。

表1 实时荧光定量PCR引物信息
1.4 鸡原代成肌细胞的分离、培养与诱导分化
取孵化11胚龄的鸡胚,PBS清洗后,分离腿肌,将肌肉剪碎后,用含有EDTA的胰酶,置于37 ℃消化20 min后,用生长培养基(DMEM+20%胎牛血清和1%青/链霉素)终止消化,1 000 r·min-1,5 min离心后,细胞沉淀用生长培养基重悬,分别用200目、400目滤筛过滤,置于37 ℃、5% CO2培养箱中培养。利用差速贴壁法纯化提取的鸡成肌细胞,即培养40 min后,将细胞液转入新的培养板中,并重复1次操作。待细胞汇合至80%时,换用分化培养基(DMEM+5%马血清和1%青/链霉素)诱导分化。分别在培养0 h、培养12 h(增殖50%密度)、培养28 h(增殖100%密度)及诱导分化后1、3、5、7 d用TRIzol总RNA提取试剂收集鸡成肌细胞。每组设4个重复。
1.5 siRNA转染
siRNA(包括METTL16-RNA和NC-siRNA)由广州锐博生物科技有限公司设计并合成。参照LipofectamineTM 3000转染试剂说明书进行操作,将100 nmol·L-1METTL16-siRNAs和NC-siRNAs分别用Lip3000包裹成转染复合物后,转染鸡成肌细胞,在Opti-MEM减血清培养基培养8 h后更换含有DMEM的增殖或分化培养液。
1.6 细胞增殖检测
将原代成肌细胞以1×105个·孔-1的密度接种96孔板,放入CO2培养箱过夜培养后,借助Lip3000将METTL16-siRNA和NC-siRNA分别转染细胞,每组6个重复。在转染24 和48 h用CellCounting-Lite 2.0试剂检测鸡成肌细胞增殖情况。具体操作步骤按CellCounting-Lite 2.0试剂说明书进行。用酶标仪检测发光值,按照说明书计算细胞增殖情况。
1.7 RNA提取及cDNA合成
使用TRIzol总RNA提取试剂分别提取胸大肌、胸小肌、缝匠肌、耻坐骨肌内侧肌、耻坐骨肌外侧肌、髂胫外侧肌、腓肠肌内侧头肌和背阔肌等肌肉组织及鸡成肌细胞的总RNA。NanoDrop1000微量分光光度计检测总RNA的纯度和浓度,-80 ℃保存备用。按照HiScript ⅢRTSuperMix反转录试剂盒操作程序进行cDNA合成,体系20 μL:4×gDNA wiper Mix 4 μL,5×HiscriptⅢ 4 μL,RNA模板1 000 ng,RNase-free ddH2O补足20 μL。反应程序:42 ℃ 2 min,50 ℃ 15 min,85 ℃ 2 min。cDNA于-20 ℃保存备用。
1.8 m6A甲基化水平检测
采用比色法检测成肌细胞m6A甲基化水平,具体步骤参考 m6A RNA Methylation Quantification Kit(Abcam,ab185912)说明书进行,反应结束后使用多功能酶标仪测量 450 nm 处的吸光度值,计算各样品的RNA m6A含量,每组3个重复。计算公式如下:m6A(%)=((Sample OD-NC OD)/S)/((PC OD-NC OD)/P)×100,式中:S为RNA含量,P为阳性对照RNA含量。
1.9 实时荧光定量PCR反应
对反转录获得的cDNA,使用ChamQ Universal SYBR qPCR Master Mix 荧光定量试剂盒进行定量分析。每个样本设3个生物学重复。PCR反应体系20 μL:2X ChamQ Universal qPCR Master Mix 10 μL,上、下游引物(10 μmol·L-1)各0.4 μL,cDNA模板2 μL,RNase-free ddH2O补足体系。PCR反应程序:95 ℃预变性30 s;
95 ℃变性10 s,56 ℃退火30 s,共40个循环。以β-actin为内参。
1.10 统计分析
实时荧光定量PCR结果采用2-ΔΔCt方法进行计算。将胸大肌设为不同部位肌肉组织中的表达对照组,ΔΔCt=ΔCt(其他部位肌肉)- ΔCt(胸大肌);
细胞分化前后表达分析将培养0 h设为对照组,ΔΔCt=ΔCt(其他时间点)-ΔCt(0 h)。每个样本至少4个重复;
用SPSS26.0软件进行统计学单因素方差分析表达量,组间差异采用独立样本t检验进行比较,用GraphPadPrism8.0作图。P<0.05表示差异显著,P<0.01表示差异极显著。
2.1 METTL16基因在鸡不同类型肌肉中的表达
对广西麻鸡胸大肌(XD)、胸小肌(XX)、缝匠肌(FJ)、耻坐骨肌内侧肌(CN)、耻坐骨肌外侧肌(CW)、髂胫外侧肌(QW)、腓肠肌内侧头肌(FN)和背阔肌(BK)8种类型肌肉中METTL16基因表达情况进行检测(图1)。由图1可见,METTL16基因在8种类型肌肉组织中均有表达,总体上,METTL16在白肌纤维为主的肌肉(XD、XX、QW、CW)中的表达要高于红肌纤维为主的肌肉(FJ、CN、FN、BK)。其中,METTL16基因在XD和XX中表达量较高,显著高于其它类型肌肉(P<0.05);
其次在QW中表达较高,显著高于其它5种类型肌肉(P<0.05);
其它5种类型肌肉间表达差异不显著(P>0.05)

XD. 胸大肌;
XX. 胸小肌;
FJ. 缝匠肌;
FN. 腓肠肌内侧头肌;
CN. 耻坐骨肌内侧肌;
CW. 耻坐骨肌外侧肌;
QW. 髂胫外侧肌;
BK. 背阔肌。柱上不同字母表示差异显著(P<0.05);
柱上相同字母表示差异不显著(P>0.05)。下同。n=6
2.2 METTL16基因在鸡原代成肌细胞中的表达规律
METTL16基因在鸡成肌细胞增殖和分化中的表达规律显示(图2),刚分离培养的鸡原代成肌细胞中METTL16基因表达最高,随着细胞的增殖,METTL16基因表达开始显著下降(P<0.05);
诱导分化1 d后,METTL16基因表达最低,随后随着细胞的分化METTL16基因表达开始显著上升;
分化5 d后,METTL16基因表达维持在相对稳定的水平。

图2 METTL16在鸡原代成肌细胞增殖分化过程中的表达
2.3 干扰METTL16基因对鸡成肌细胞增殖的影响
利用CellCounting-Lite 2.0增殖检测试剂盒检测干扰METTL16基因表达后鸡成肌细胞的增殖情况。由图3可见,干扰METTL16基因24 h时,鸡成肌细胞干扰组的增殖活力开始低于NC对照组,干扰METTL16基因48 h后,干扰组的细胞增殖活力显著低于NC组(P<0.05)。提示METTL16对鸡成肌细胞的增殖有促进作用。
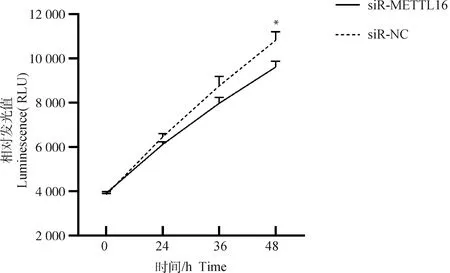
*. P<0.05,**. P<0.01.,***. P<0.001,下同
2.4 干扰METTL16基因对鸡成肌细胞m6A甲基化水平的影响
在分化期干扰鸡成肌细胞中METTL16基因表达后,采用比色法检测鸡成肌细胞RNA m6A甲基化水平。由图4可见,与NC组相比,干扰组的甲基化水平呈现下降的趋势。提示METTL16在鸡成肌细胞分化期,正向调控RNA m6A甲基化水平。

图4 干扰METTL16对鸡原代成肌细胞RNA m6A甲基化水平的影响
2.5 干扰METTL16基因对鸡成肌细胞分化的影响
在分化期干扰鸡成肌细胞中METTL16基因表达后的细胞形态如图5。由图5可见,各个时间点试验组(METTL16)与对照组(NC)细胞和肌管形态没有明显区别。在分化期干扰鸡成肌细胞中METTL16基因表达后,细胞分化及肌纤维类型相关基因表达结果见图6,与NC组相比,干扰组中MyoD的表达显著下降(P<0.05),MyoG的表达呈下降趋势(P>0.05),fast-MyHC的表达极显著上升(P<0.001),slow-MyHC的表达呈下降趋势(P>0.05)。

A、B分别表示对照组分化期转染si-NC 24与48 h后细胞形态;
C、D表示试验组分化期转染si-METTL16 24与48 h后细胞形态

A.干扰METTL16后MyoD mRNA表达情况;
B.干扰METTL16后MyoG mRNA表达情况;
C.干扰METTL16后fast-MyHC mRNA表达情况;
D.干扰METTL16后slow-MyHC mRNA表达情况
METTL16是RNA修饰领域的新成员,最初被认为是核糖体RNA甲基转移酶。现有研究显示METTL16通过m6A甲基化修饰前RNA(pre-RNA)和非编码RNA(ncRNA)[19]以及长非编码RNA(lncRNA)[20]调节小鼠细胞中MAT2A的mRNA水平,维持S-腺苷蛋氨酸(SAM)的稳态[21-22]。另外,METTL16不仅在细胞核内发挥m6A编写器的作用,在胞浆中还以不依赖m6A的方式,通过其甲基转移酶结构域(Mtase domain)直接与真核细胞起始因子3a(eIF3a)和3b(eIF3b)以及核糖体RNA相互作用,加快翻译起始复合体的组装,从而促进mRNA的翻译[23]。有研究发现通过紫外线辐射造成的DNA损伤后,METTL16被招募到损伤区域并与附近的小RNA相关联[24]。可见METTL16在m6A甲基化修饰过程中较重要。但METTL16在家禽中的研究报道还比较少。
课题组前期通过ATPase染色将8种类型肌肉分型,结果表明,胸大肌、胸小肌、耻坐骨肌外侧肌和髂胫外侧肌以白肌纤维为主;
腓肠肌内侧头肌、背阔肌、缝匠肌和耻坐骨肌内侧肌以红肌纤维为主[15]。为研究METTL16在鸡肌肉中的作用,本研究首先通过qRT-PCR对8种类型肌肉中METTL16基因表达情况进行检测,发现METTL16基因在胸小肌等以白肌纤维为主的肌肉中的表达要高于缝匠肌等以红肌纤维为主的肌肉。这与本课题组研究发现m6A甲基化转移酶METTL3、METTL14、WTAP和VIRMA在红肌纤维为主的肌肉中的表达量高于白肌纤维为主的肌肉的结果不一致[15]。同时对干扰METTL16基因后鸡成肌细胞RNA m6A甲基化水平进行检测表明,METTL16能够促进鸡成肌细胞RNA m6A甲基化水平的提高。提示METTL16表达水平与肌纤维类型分布相关,可能通过不同于METTL3等甲基化转移酶的特殊的机制参与肌肉m6A调控。
通过对METTL16基因在鸡成肌细胞中增殖和分化不同时期的表达水平检测表明,METTL16基因表达水平随着成肌细胞增殖逐渐降低,随着成肌细胞分化逐渐升高,提示METTL16可能在成肌细胞增殖与分化过程中发挥作用。本课题组前期研究发现甲基转移酶METTL3、METTL14和WTAP在鸡成肌细胞增殖过程中表达上调,在鸡成肌细胞分化的前4天表达下降,第5天表达回升[15]。丁浩等[25]研究发现,METTL3、METTL14和WTAP表达水平在细胞增殖时期逐渐上调。鸡成肌细胞中METTL16基因表达的趋势再次与METTL3等甲基化转移酶基因表达趋势相反,推测METTL16很可能通过不同于METTL3等甲基化转移酶的特殊的机制参与肌肉m6A调控。
成肌细胞的增殖分化是个非常复杂的过程,受很多因子的调控。如骨骼肌的分化被证明受生肌调节因子家族MyoD、MyoG、Myf5和Mrf4等调控[26],MyoD与Myf5在成肌细胞早期分化发挥作用,而MyoG与Mrf4在成肌细胞后期分化为肌纤维的过程中发挥调节作用[27-28]。骨骼肌纤维类型的转化归根结底是构成肌纤维的蛋白多肽链结构发生了变化,是多核肌纤维内反映不同种类特征的基因得以表达的结果[29]。而不同亚型的MYHC基因是表征肌肉纤维类型多样性的最佳标志[30]。最近的研究表明,m6A甲基化在骨骼肌的分化中发挥重要作用。甲基化转移酶METTL3已被证实介导MyoD等肌源性转录因子mRMA的5′UTR的m6A修饰来调控骨骼肌分化[31],但还未见METTL16在骨骼肌中的作用报道。Wang[32]等报道,敲低METTL16可通过降低胃癌细胞m6A水平,降低cyclinD1 mRNA稳定性,进而降低cyclinD1的表达来抑制G1/S期细胞增殖。本研究利用CellCounting-Lite 2.0细胞增殖试剂检测发现,干扰METTL16基因表达后,鸡成肌细胞增殖受到抑制。本研究在肌细胞分化条件下干扰METTL16基因的表达,结果表明MyoD的表达显著下降,MyoG的表达变化不显著,fast-MyHC的表达极显著上升,slow-MyHC的表达呈现下降趋势。提示METTL16可能在鸡成肌细胞的增殖、分化和肌纤维形成中发挥重要作用。但是METTL16是通过何种机制调控鸡成肌细胞增殖分化和肌纤维形成的还需进一步研究。
METTL16在鸡的不同类型肌肉中广泛表达,其表达水平与肌纤维类型组成相关。干扰METTL16基因表达能够明显抑制鸡原始成肌细胞的增殖和MyoD基因的表达,明显促进fast-MyHC基因的表达,提示METTL16可能调控鸡成肌细胞的增殖、分化和肌纤维类型形成,在鸡肌肉功能调控中发挥重要功能。
猜你喜欢成肌细胞坐骨肌纤维乳腺炎性肌纤维母细胞瘤影像学表现1例中国临床医学影像杂志(2022年6期)2022-07-26婴儿颅骨肌纤维瘤/肌纤维瘤病2例中国临床医学影像杂志(2022年5期)2022-07-26常坐硬物当心坐骨结节囊肿“光临”华声文萃(2022年5期)2022-06-01常坐硬物当心坐骨结节囊肿“光临”文萃报·周二版(2022年15期)2022-04-13谨防坐骨结节囊肿金秋(2021年22期)2021-12-02Ang Ⅱ诱导大鼠成肌细胞萎缩模型的构建昆明医科大学学报(2021年10期)2021-12-02顶骨炎性肌纤维母细胞瘤一例国际放射医学核医学杂志(2021年10期)2021-02-28成肌细胞原代培养及临床应用前景*生物骨科材料与临床研究(2017年2期)2017-04-018-羟鸟嘌呤可促进小鼠骨骼肌成肌细胞的增殖和分化中国运动医学杂志(2016年3期)2016-07-10臀大肌肌瓣联合臀下动脉穿支皮瓣修复坐骨结节区褥疮中国医疗美容(2015年4期)2015-04-27推荐访问:肌肉 不同类型 其对