骨髓基质细胞通过TSP-1/CD36,通路对急性髓系白血病细胞影响的初步研究*
来源:优秀文章 发布时间:2023-04-16 点击:
郑雅心 亢俊楠 陈泽慧 王丽娜 郑国光 热西担·努尔买买提 田晨
骨髓微环境参与急性髓系白血病(acute myeloid leukemia,AML)的发生发展和化疗耐药,骨髓基质细胞(bone marrow-derived mesenchymal stromal cells,BM-MSCs)作为微环境中重要的非造血成分,在此过程中发挥重要作用。研究指出,BM-MSCs 能够促进AML 细胞生长增殖和化疗耐药,从而促进AML 的发生发展[1-2]。凝血酶敏感蛋白-1(thrombospondin-1,TSP-1)作为细胞外基质产生的一种分泌型蛋白,在骨髓微环境中能够支持各种正常细胞和肿瘤细胞的黏附与运动,并调控细胞的增殖与凋亡[3-4]。
本研究采用过表达MLL-AF9 诱导的AML 小鼠模型,以野生型(wild type,WT)小鼠为对照,流式分选两组不同来源的BM-MSCs 后行q-PCR 验证其内TSP-1 的表达水平。随后构建过表达TSP-1 的慢病毒载体,设计transwell 共培养实验检测AML 细胞的增殖及凋亡水平,旨在探寻BM-MSCs 影响AML 细胞生长的潜在机制,为白血病的治疗提供新思路。
1.1 材料
1.1.1 试剂与仪器 PRMI 1 640 培养基、DMEM 高糖培养基、0.25%EDTA 胰蛋白酶、新生胎牛血清(FBS)购于美国Gibco 公司;
Lineage-APC-CY7、CD45-PerCP-CY5.5、CD31-PE、F4/80-FITC、CD36-FITC、CD47-APC-CY7 抗体购自美国Biolegend 公司;
0.4 μm transwell 小室购于美国Corning 公司;
TransScript®Allin-One First-Strand cDNA Synthesis SuperMix 购于北京全式金公司;
TB Green®Premix Ex Taq™购于日本Takara 公司;
高纯度质粒小提中量试剂盒购于Tiangen 公司;
X-treme GENE HP 购于瑞士 Roche 公司;
PE-Annexin-V 凋亡试剂盒、APC-BrdU 增殖试剂盒及CantoⅡ流式细胞仪为美国BD 公司产品;
CO2细胞恒温培养箱、低温台式离心机购自德国Thermo 公司;
实时荧光定量PCR 仪购自新加坡Thermo 公司。
1.2 方法
1.2.1 构建过表达MLL-AF9 的AML 小鼠模型 采用C57 和B6 的小鼠来构建AML 模型,如图1A 所示。成功构建过表达MLL-AF9 的逆转录病毒载体MSCV-MLL-AF9-PGK-GFP 后感染B6 小鼠来源的Lin-Sca-1+细胞(表达CD45.1),将感染后携带绿色荧光的GFP+细胞(CD45.1)经尾静脉注射至C57 小鼠(表达CD45.2)体内,建模后14 天解剖小鼠分析骨髓和脾中白血病细胞的浸润。
1.2.2 流式细胞术分选BM-MSCs 将WT 小鼠及建模14 天后的AML 小鼠处死,剥离其股骨、胫骨,冲出骨髓后4℃避光条件下孵育如下抗体:Lineage-APC-CY7,CD45-PerCP-CY5.5,CD31-PE 和F4/80-FITC,使用流式细胞仪分选Lin-CD45-CD31-F4/80-细胞群,为BM-MSCs 群,并进行后续实验[5]。
1.2.3 q-PCR 验证TSP-1 在BM-MSCs 的表达水平收集细胞后采用Trizol 法裂解提取总RNA,随后将RNA 逆转录为cDNA。使用Takara 公司的q-PCR 试剂盒(货号:RR420A)进行q-PCR 实验:实验体系为20 μL,其中TB Green Primer Ex Taq I 10 μL,PCR Primer Mix 0.8 μL,Rox Reference DyeⅠ0.4 μL,cDNA 2 μL,无DNA/RNA 酶水补至20 μL。PCR 扩增程序为:95℃ 30 s,95℃ 5 s,60℃ 34 s,40 个循环。引物序列如下:TSP-1 上游引物序列5"-AAGACTGTG TTGGCGATGTGAC-3",下游引物序列5"-ACCGAT GTTCTCCGTTGTGATTG-3";
GAPDH 上游引物序列 5"-ACAACTTTGGTATCGTGGAAGG-3",下游引物序列5"-GCCATCACGCCACAGTTTC-3"。
1.2.4 慢病毒载体感染 将1.2 μg 目的质粒pCDHCMV-TSP-1-EF1-GFP-Puro 和空载体pCDH-CMVEF1-GFP-Puro(优宝生物)分别与0.6 μg 包装质粒:PMD2.G、pSPAX2(优宝生物)、200 μL Opti-MEM 以及7.2 μL 转染试剂混合均匀,室温静置15 min 后加入293T 细胞,于37℃ 5%CO2孵箱中继续培养,12 h后更换为新鲜培养基,48 h 后于荧光显微镜下观察转染情况并收集病毒。
将收集到的病毒原液加入AML 小鼠BM-MSCs,按照 1∶1 000 比例加入 8 μg/mL 的 Polybrene。置于37℃ 5%CO2的培养箱中继续培养,48 h 后荧光显微镜下观察到绿色荧光,即感染成功。
1.2.5 transwell 共培养 将长势良好的BM-MSCs接种于0.4 μm transwell 细胞培养板的下室,细胞融合度达到90%以上时,将小鼠原代AML 细胞以1×105个细胞/孔接种于细胞培养板的上室,共培养16 h 后收集上室内的AML 细胞行后续实验。
1.2.6 流式检测AML 细胞表面CD36/CD47 的表达水平 将transwell 法共培养后的AML 细胞进行流式抗体标记:CD36-FITC、CD47-APC-CY7,4℃避光孵育30 min 洗去未特异性结合的抗体;
使用流式细胞仪分析AML 细胞表面CD36 和CD47 的表达。
1.2.7 BrdU 法检测细胞增殖 将BrdU 加入培养基中混匀后于37℃孵箱内孵育4~6 h,随后收集细胞,按BD 公司APC-BrdU 增殖检测试剂盒中说明书进行下述步骤:固定破膜、孵育、再固定、DNase 消化以暴露BrdU、标记anti-BrdU APC 抗体、DNA 染色。最后补足staining buffer 至500 μL,流式细胞仪低速分析(<400 events/s)。
1.2.8 Annexin V/PI 法检测细胞凋亡 100 μL 1×binding buffer 重悬细胞后加入5 μL Annexin V 和5 μL 7-AAD 抗体,冰上避光孵育15 min 后补加 400 μL 1×binding buffer,上流式细胞仪分析。
1.3 统计学分析
采用GraphPad Prism 8.0 软件进行统计学分析。应用FlowJo 软件分析流式结果。两组间数据比较采用独立样本t检验,各实验组数据以±s表示。以P<0.05 为差异具有统计学意义。
2.1 过表达MLL-AF9 的AML 小鼠模型构建
建模过程如图1A 所示。建模后14 d 解剖小鼠脾脏、肝脏对其称重,发现AML 小鼠较WT 小鼠的肝、脾更重(图1B~1E)。此外,AML 小鼠的骨髓细胞及脾脏细胞在倒置荧光显微镜下可见满视野绿色荧光(图1F),证明AML 小鼠建模成功。

图1 AML 小鼠模型的构建
2.2 AML 小鼠来源的BM-MSCs 低表达TSP-1
通过q-PCR 比较AML 小鼠和WT 小鼠BMMSCs 内TSP-1 的表达水平(图2)。结果显示,AML来源的BM-MSCs 低表达TSP-1。

图2 q-PCR 检测AML 小鼠来源的BM-MSCs 内TSP-1 表达水平
2.3 过表达TSP-1 的BM-MSCs 与AML 细胞共培养后CD36 与CD47 的表达变化
通过慢病毒载体感染AML 来源的BM-MSCs,使之过表达TSP-1(图3)。共培养前AML 原代细胞表面CD36 及CD47 的表达情况如图4A 所示,而与过表达TSP-1 的BM-MSCs 行transwell 共培养后的AML 细胞表面CD36 表达水平升高(图4 B),但CD47 的表达未见明显改变(图4 C),提示高水平的TSP-1 可能诱导AML 细胞表面CD36 受体升高。

图3 q-PCR 验证感染后BM-MSCs 的TSP-1 表达量
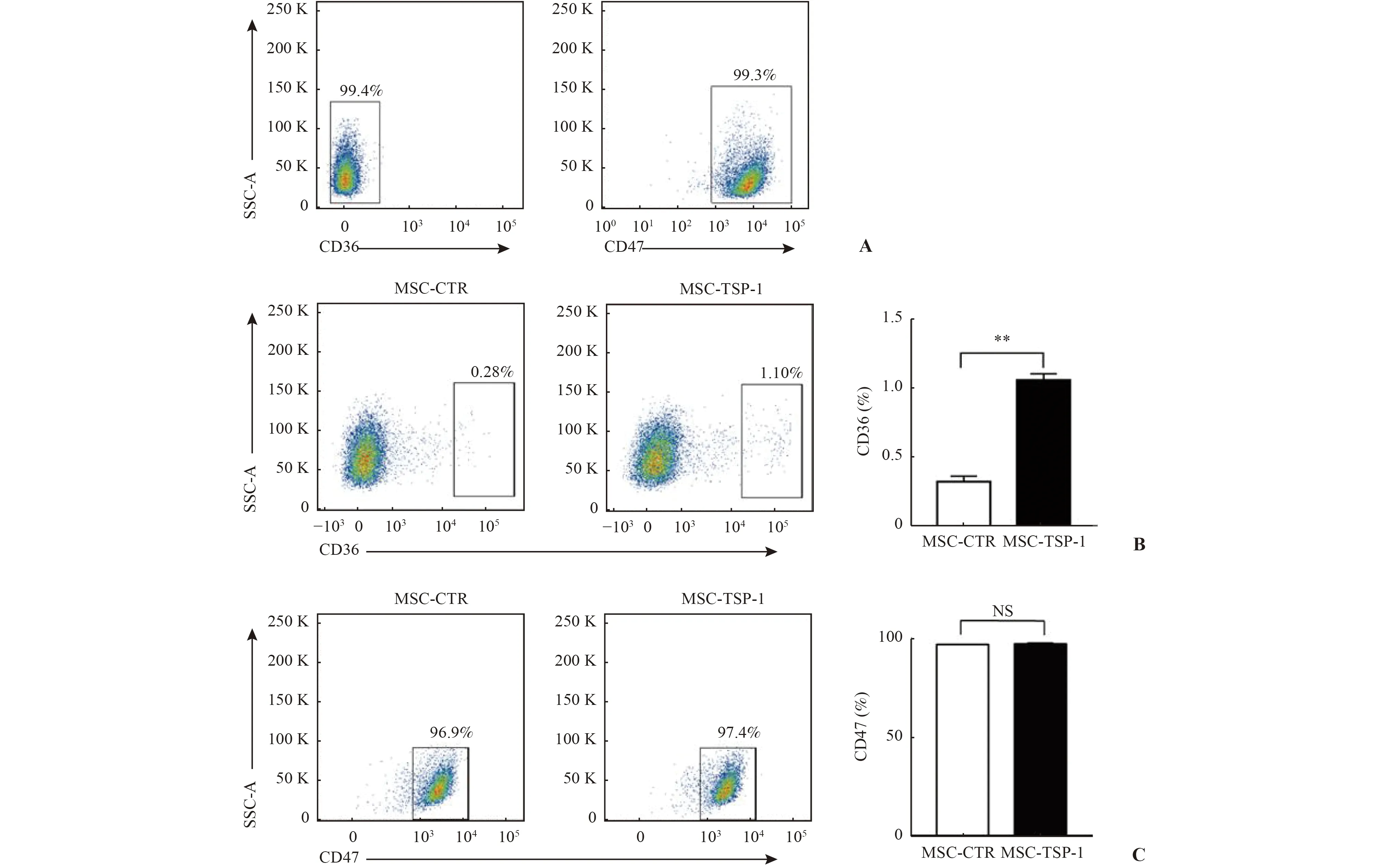
图4 流式检测CD36 及CD47 的表达水平
2.4 过表达TSP-1 的BM-MSCs 对AML 细胞生长的影响
经transwell 共培养16 h 后的AML 细胞增殖减少,凋亡增多(图5A~B)。为证实BM-MSCs 是否通过TSP-1/CD36 通路介导AML 细胞凋亡,我们在该共培养体系下加入CD36 抑制剂N-油酰基硫代琥珀酰亚胺,以加入等量的PBS 组为对照,检测AML 细胞的生长变化。结果发现,在抑制剂的作用下,AML细胞的增殖增多,凋亡减少(图5C~D)。上述结果表明,在AML 微环境中,阻断了BM-MSCs 和AML 细胞之间的TSP-1/CD36 通路,使得AML 细胞增殖增多,凋亡减少。

图5 流式检测AML 细胞的生长变化
骨髓微环境内的MSCs 可分泌丰富的细胞外基质蛋白与细胞因子,与白血病细胞相互作用,对AML的发生发展至关重要[6-9]。本研究前期工作[7]发现MSCs 通过c-Myc 依赖性途径保护AML 细胞免于凋亡。此外,AML 来源的BM-MSCs 较正常供体来源的BM-MSCs 具有更高的成脂潜能,更强的支持白血病祖细胞生存的能力[9]。
TSP-1 是一种多功能的粘附性糖蛋白,参与调节细胞增殖、迁移和分化,影响胚胎发育、形态发生、炎症、肿瘤转移等多种生物学进程[10]。研究发现,TSP-1在AML 患者骨髓血清中低表达,被认为是一种新的预后因子[10]。TSP-1 可与多种受体相结合,如CD47、CD36 等[11]。CD36 表达于多种细胞类型,介导免疫识别、炎症、分子黏附和细胞凋亡[12]。研究表明,CD36除了通过促进脂质摄取和脂肪酸氧化来诱导肿瘤转移和耐药外,还可诱导肿瘤微血管内皮细胞凋亡或阻断血管内皮生长因子2 途径来抑制血管生成[13]。在HL-60 细胞,TSP-1 可诱导由CD36 介导的caspase 依赖性细胞死亡[14]。此外,在慢性B 淋巴细胞白血病中,TSP-1 通过与CD47 结合触发caspase 非依赖性的细胞死亡[15],而在早幼粒细胞白血病中,TSP-1 则与CD47 结合触发caspase 依赖性的细胞死亡[16]。
本研究首先通过q-PCR 技术比较不同来源BMMSCs 内TSP-1 的表达水平,发现AML 来源的BMMSCs 分泌TSP-1 的水平显著下降。进而通过慢病毒载体诱导MSC 中TSP-1 高表达,并与AML 细胞共培养,结果发现共培养后的AML 细胞表面CD36 表达升高,且AML 细胞凋亡增多、增殖减少。在体外共培养体系中加入CD36 抑制剂后促进AML 细胞的生长。说明在AML 微环境中,BM-MSCs 内TSP-1 分泌减少,使得TSP-1/CD36 通路失活,从而促进了AML 细胞生长;
而活化TSP-1/CD36 通路则可抑制AML 细胞生长。总之,本研究揭示TSP-1/CD36 轴在AML 发生发展过程中的作用,为AML 的治疗提供了潜在靶点。
本文无影响其科学性与可信度的利益冲突。
猜你喜欢流式共培养白血病BMSCs-SCs共培养体系联合异种神经支架修复大鼠坐骨神经缺损的研究宁夏医学杂志(2020年3期)2021-01-21辐流式二沉池的结构优化研究工程与建设(2019年5期)2020-01-19紫锥菊不定根悬浮共培养中咖啡酸衍生物积累研究天然产物研究与开发(2018年4期)2018-05-07一例蛋鸡白血病继发细菌感染的诊治河南畜牧兽医(2017年12期)2017-11-13微球测速聚类分析的流式液路稳定性评估光学精密工程(2016年1期)2016-11-07白血病外周血体外诊断技术及产品中国科技信息(2015年6期)2015-11-10自调流式喷管型ICD的设计与数值验证西南石油大学学报(自然科学版)(2015年4期)2015-08-20流式在线直播视频的采集河南科技(2015年8期)2015-03-11角质形成细胞和黑素细胞体外共培养体系的建立中国医疗美容(2015年5期)2015-02-03阅读理解Ⅰ高中生学习·高三版(2014年3期)2014-04-29推荐访问:细胞 基质 通路