罗格列酮对IR-AKI的预保护作用研究
来源:优秀文章 发布时间:2023-04-16 点击:
王 娟 茅 松
急性肾损伤(acute kidney injury, AKI)指由多种病因引起的肾功能快速下降而出现的一系列功能紊乱的临床综合征,主要表现为肾小球滤过率的下降、体内代谢产物的蓄积等。统计显示,10%~15%的入院患者有AKI,而在重症监护患者中,其发生率已超过50%[1,2]。AKI的发生、发展是导致许多患者预后不佳的重要因素之一。虽然AKI与死亡之间没有直接的联系,但统计显示AKI每年会导致(100~700)万人死亡[3]。AKI的发生是多种因素作用的结果,其与个体差异、当地经济、医疗卫生水平均有密切关系。统计显示,全球每年有(130~300)万人发生AKI,其中85%的人生活在发展中国家[3]。中国作为世界上最大的发展中国家,AKI的发生率和病死率均较高,给个人、家庭和社会带来了沉重的负担。一项纳入22个省(自治区、直辖市)44家医院的研究显示,社区获得性AKI的比率为1.11%,而社区获得性AKI病例在所有AKI病例中的比例达到54.4%[4]。
多种疾病可能易并发AKI,除继发于肾脏本身的疾病外,也好发于多器官功能障碍综合征、败血症、休克、心脏外科手术创伤、烧伤、肾毒性药物应用及线粒体功能损伤等[5]。目前证实,肾脏也是新型冠状病毒感染的重要受累器官之一[6]。
缺血再灌注(ischemia reperfusion,IR)是诱发肾损伤的常见原因之一。如肾移植、肾动脉成形术、部分肾切除术、心脏相关大型手术和输尿管阻塞等临床情况中均易发生肾脏IR损伤。在此过程中,局部组织的氧气、营养物质的供需不平衡,受损的肾脏细胞分泌一些促炎性细胞因子等,导致了肾小管内皮细胞的损伤[7, 8]。缺血性AKI后肾小管细胞的存亡取决于损伤的严重程度。轻度损伤诱发细胞极性的丧失,如黏附分子/膜蛋白的错误定位和细胞骨架完整性的破坏。如果损伤及时停止了,细胞功能往往可以恢复。但更严重的损伤易诱发不可逆转的肾小管细胞凋亡或坏死,从而导致肾功能障碍[9]。
过氧化物酶体增殖剂激活受体(peroxisome proliferator activated receptor gamma,PPARγ)是核受体超家族的成员,其与新陈代谢、能量平衡、细胞发育和分化密切相关。业已证实,噻唑烷二酮类可以通过激活PPARγ发挥作用,临床上被用来改善2型糖尿病患者的血糖状态并减少胰岛素抵抗,罗格列酮(rosiglitazone,RSG)是噻唑烷二酮类经典药物[10]。研究表明,在甘油诱导的AKI中,PPARγ的表达和活性降低,用西格列酮预处理后小鼠PPARγ的表达和活性即增强,且可明显减轻AKI后肾功能的恶化[11]。激活PPARγ可以保护肾小管上皮细胞,减少AKI的发生[12]。PPARγ激活业已被证明可引起冠状动脉血管舒张[13]。研究也发现,PPARγ的激活可降低血压,这些研究表明PPARγ激动剂对血管功能和系统血流动力学有调节作用[14,15]。另一项研究则表明,吡格列酮对慢性肾脏病患者的内皮功能,包括血流介导的扩张、动脉顺应性和脉搏波传导速度没有影响[16]。一项临床试验的事后分析显示,吡格列酮可以降低慢性肾脏病 (chronic kidney diseases, CKD)糖尿病患者的全因病死率、心肌梗死和脑卒中的发生率,但是服用吡格列酮的队列肾功能的下降更为明显[17]。激活PPARγ保护肾功能的作用似乎有待于进一步评估。笔者团队设想给药的时间点与持续时间可能对其发挥肾脏预保护作用相互影响。因此本文研究了PPARγ激动剂罗格列酮对IR诱导的小鼠AKI的预保护作用及时间序列影响。
1.实验动物:本研究已通过上海交通大学附属第六人民医院动物实验伦理审核,动物实验许可证号:SYXK(沪)2011-0128。40只C57/B6雄性小鼠通过简单随机分组方法分为5组,即对照组(C0组)、单纯手术组(IR组)、术前1天给药组(1RSG组)、术前3天给药组(3RSG组)、术前7天给药组(7RSG组),每组各8只。C0组不做任何处理;
IR组通过夹闭小鼠右侧肾蒂45min,构建肾脏IR诱导AKI的模型,术后24h进行处理取材;
1RSG、3RSG和7RSG组分别为术前连续给药1、3、7天,药物RSG剂量为10mg/kg,手术造模同IR组,术后24h进行处理取材。
2.血液和尿液生物学标志物检测:术后24h通过眼球采血收集血液,4℃、12000r/min下离心机离心10min以制备冷冻的血清,批量分析。随后使用全自动生化分析仪(型号:日立7600全自动模块组合式生化分析仪)检测血清中的血尿素氮(blood urea nitrogen, BUN)、血清肌酐(creatinine, CREA)。术后24h收取尿液,收集的尿液在-80℃冻存,直到进行批次分析。肌酐试剂盒(C011-2-1,南京建成生物工程研究所)检测尿CREA水平。用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(ab108792,英国Abcam公司)检测尿微量白蛋白水平。
3.组织形态观察:术后24h处理取材右侧肾脏后,浸泡于甲醛溶液。后行苏木精-伊红(hematoxylin-eosin,HE)染色观察肾组织微观形态改变。
4.肾组织基因表达分析:术后24h处理取材右侧肾脏后,冻存于-80℃冰箱。用Trizol试剂(15596-018,美国Invitrogen公司)从组织中提取总RNA。用DNA酶试剂盒(K1622,美国Thermo Scientific公司)去除总RNA中混合的DNA,用cDNA反转录试剂(EN0521,美国Thermo Scientific公司)生成cDNA,后进行实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR,4913850001,瑞士Roche公司),检测肾脏损伤标志物(Kim-1、NGAL)mRNA水平,使用2-△△ct法计算与C0组的相对mRNA水平。
5.Western blot法检测:用4℃保存的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤肾组织,并用添加磷酸酶抑制剂(PMSF)的RIPA缓冲液裂解。通过SDS-PAGE凝胶电泳测定组织蛋白水平,并用以下抗体印迹:抗β-actin(4970S,美国CST公司),抗Kim-1(ab47635,英国Abcam公司),抗NGAL(ab125075,英国Abcam公司),使用Image J软件对蛋白印迹结果进行相对定量。统计数据由GraphPad Prism 8.0绘制。
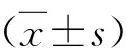
1.BUN和血CREA水平:IR组BUN、血CREA水平较C0组均明显增高(P<0.05);
1RSG、3RSG、7RSG组BUN、血CREA水平较C0组均明显增高(P<0.05);
1RSG、3RSG、7RSG组BUN、血CREA水平较IR组均降低,且呈逐渐下降趋势,其中7RSG组BUN、血CREA水平较IR组明显下降(P<0.05),详见图1。

图1 各组BUN和血CREA的变化趋势A.各组BUN的变化趋势;
B.各组血CREA的变化趋势;与C0组比较,*P<0.05;
与IR组比较,#P<0.05
2.尿微量白蛋白/肌酐比值:IR组尿微量白蛋白/肌酐比值较C0组均明显增高(P<0.05);
1RSG、3RSG、7RSG组较C0组均显著增高(P<0.05);
1RSG、3RSG、7RSG组尿微量白蛋白/肌酐比值较IR组明显均降低(P<0.05),且呈逐渐下降趋势,详见图2。

图2 各组尿微量白蛋白/肌酐比值的变化与C0组比较,*P<0.05;
与IR组比较,#P<0.05
3.组织病理学结果:从HE染色标本观察到,相较于C0组,IR组肾小管管腔可见大量红细胞,提示肾小管受到严重损伤;
与IR组比较,1RSG、3RSG、7RSG组管腔内红细胞有所减少,提示1RSG、3RSG、7RSG组肾小管损伤较IR组改善明显, 7RSG组改善最明显,详见图3。

图3 各组肾组织病理改变(HE染色,×40)A.C0组;
B.IR组;
C.1RSG组;
D.3RSG组;
E.7RSG组
4.Kim-1和NGAL mRNA水平:IR组Kim-1和NGAL mRNA水平较C0组均明显增高(P<0.05);
1RSG、3RSG、7RSG组Kim-1和NGAL mRNA水平较C0组均显著增高(P<0.05);
1RSG、3RSG、7RSG组Kim-1和NGAL mRNA水平较IR组明显均降低(P<0.05),且呈逐渐下降趋势,详见图4。
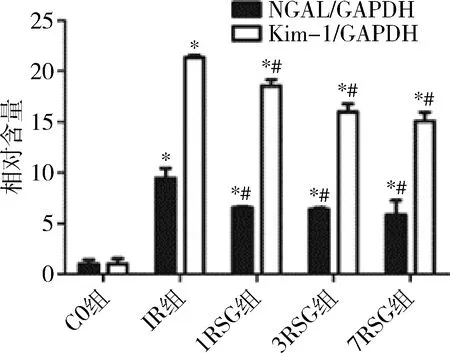
图4 各组Kim-1和NGAL mRNA水平变化与C0组比较,*P<0.05;
与IR组比较,#P<0.05
5.Kim-1和NGAL蛋白表达水平:IR组Kim-1和NGAL蛋白表达水平较C0组均明显增高(P<0.05);
1RSG、3RSG、7RSG组Kim-1和NGAL蛋白表达水平较C0组均显著增高(P<0.05);
1RSG、3RSG、7RSG组Kim-1蛋白表达水平较IR组明显均降低(P<0.05),且呈逐渐下降趋势;
3RSG、7RSG组NGAL蛋白表达水平较IR组明显均降低(P<0.05),且呈逐渐下降趋势,详见图5。
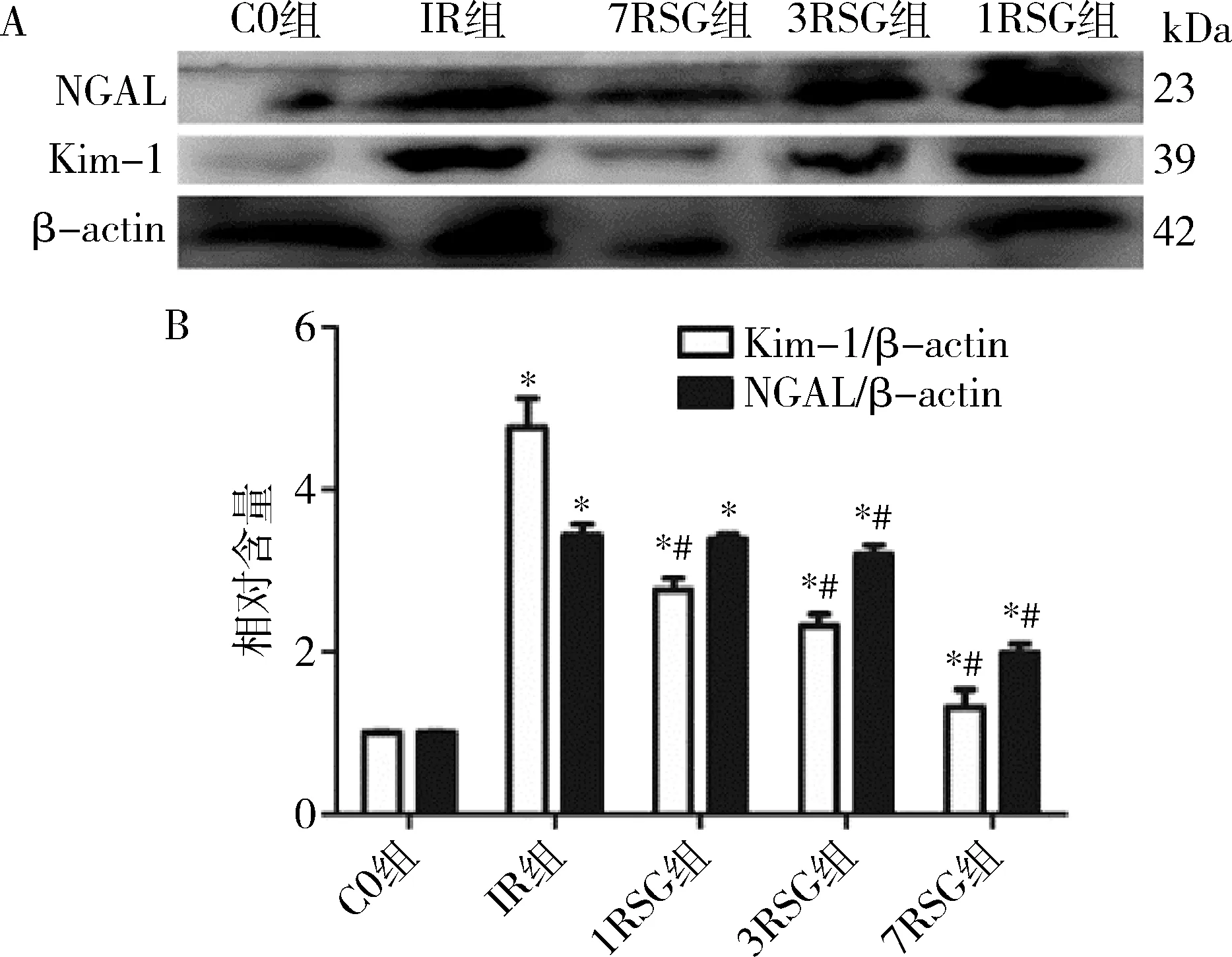
图5 各组Kim-1和NGAL 蛋白表达水平A.各组Kim-1和NGAL蛋白表达Western blot法条带图;
B.各组Kim-1和NGAL蛋白表达。与C0组比较,*P<0.05;
与IR组比较,#P<0.05
AKI在临床中广泛存在,可引起多种并发症,及早控制预防具有非常重要的意义,IR损伤是导致AKI的常见诱因。本研究结果表明,RSG可缓解IR诱导的AKI。给予RSG灌胃后,血CREA、BUN水平较单独IR组下降,在一定时间范围内(1~7天),降低程度与给药时间呈正相关。同时尿微量白蛋白/肌酐比值明显下降,相较于BUN、血CREA,尿微量白蛋白/肌酐比值只有术前7天给药下降程度才有统计学意义,即便术前1天给药,尿微量白蛋白/肌酐比值下降程度也有统计学意义,PPARγ激活可降低糖尿病患者尿微量白蛋白,提示PPARγ激动剂在降低尿微量白蛋白方面效果比较显著[18]。肾损伤分子Kim-1、NGAL在mRNA及蛋白表达水平均明显下降;
这提示早期应用PPARγ激动剂可有效减轻IR损伤所诱导的AKI,且在一定范围内,给药时间越长,保护作用越显著。
Elshazly等[19]研究发现,术前7天给予吡格列酮灌胃后,不但可以改善肾功能,还能改善因肾缺血损伤的肝功能。Singh等[20]研究发现,雌二醇通过PPARγ激活大鼠内皮一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)来缓解IR诱导的AKI。Zhang等[21]研究证明,油酸通过Ras/MAPKs/PPAR-γ信号通路上调PPARγ缓解脂多糖(lipopolysaccharide,LPS)诱导的急性肾损伤。有研究发现,甜菊糖(stevioside)可缓解横纹肌溶解诱导的AKI,但在用甜菊糖之前给予PPARγ受体拮抗剂-双酚A二缩水甘油醚预处理,可废除甜菊糖介导的肾脏保护作用,这表明PPARγ参与其肾脏保护作用[22]。近年来研究表明,AKI后肾功能并不是完全恢复,而是有向慢性肾脏病转化的倾向,及早干预有着重要意义,而PPARγ的激活可缓解AKI向CKD转化[23]。因此,激活PPARγ不但可以预保护AKI,而且长期也可发挥肾功能保护作用。PPARγ的激活可能为IR诱导的AKI患者提供了一种保护肾脏的潜在方法。
同时不容忽视的一点是,PPARγ激活有舒张血管的作用,由于肾脏与血流量的自身调节有密切的关系,所以PPARγ对血管的作用也与其对肾脏功能的作用相关联。Guan等[24]研究发现,PPARγ的激活可导致体内液体潴留。研究发现,PPARγ的激活可抑制一些血管相关基因的转录,如血管紧张素-1型受体和血栓素合成酶基因[25,26]。而且噻唑烷二酮类药物通过显著降低血管紧张素Ⅱ的Ⅰ型受体的表达和抑制通过该受体的信号转导调节血管紧张素Ⅱ信号转导,以抑制血管重塑和氧化应激反应[27]。PPARγ激动剂对血管与血流动力学的作用要求在考虑将其应用于肾脏病患者时格外谨慎。研究发现,一种吲哚衍生物可作为选择性PPARγ调节剂(SPPARγMs),相较于传统噻唑烷二酮类药物其增加血浆和细胞外液容量的潜力降低了,但还没有相关研究证明其对肾脏是否有保护作用,这说明选择性PPARγ调节剂有着巨大潜力[28]。
PPARγ激动剂对肾脏疾病起到一定的保护作用,但其机制尚未完全清楚。虽然RSG可舒张血管,影响血流动力学,但总体来看RSG对肾脏起到良好的保护作用,可能不是通过单纯的改善血流动力学来缓解肾脏损害。有研究者称未来的研究应该通过研究噻唑烷二酮类对肾脏相关终点的影响来解决这个问题,这将有助于定位真正适合PPARγ治疗的肾脏疾病患者类型[29]。一些衍生物或双重PPAR激动剂也有可能在规避不良反应的同时有特定的适应人群。噻唑烷二酮类药物作为一种成熟药物,若要考虑直接应用于AKI,则需要尤其注意剂量和摄入方式,以减轻不良反应对患者的危害,这需要进一步研究。
综上所述,罗格列酮作为PPARγ激动剂,对AKI有预保护作用,但要考虑直接将其应用于AKI患者,还需要对剂量和适应人群做更精准的研究,因此选择性PPARγ调节剂可能是潜在的研究方向。
猜你喜欢列酮激动剂微量微量行程变大行程的模具调整结构模具制造(2019年7期)2019-09-25绿萝花中抗2型糖尿病PPARs激动剂的筛选中成药(2018年10期)2018-10-26GPR35受体香豆素类激动剂三维定量构效关系研究天然产物研究与开发(2018年6期)2018-07-09微量注射泵应用常见问题及解决方案中国医学装备(2016年6期)2016-12-01吡格列酮对多囊卵巢综合征患者血清 CRP、IL-6、TNF-α水平的影响山东医药(2015年38期)2015-12-07AMPK激动剂AICAR通过阻滞细胞周期于G0/G1期抑制肺动脉平滑肌细胞增殖医学研究杂志(2015年5期)2015-06-10吡格列酮对肥胖小鼠血清抵抗素的影响及其对肾脏的作用天津医科大学学报(2015年3期)2015-06-05吡格列酮对肥胖小鼠肾脏中TNF-α表达的影响天津医科大学学报(2015年3期)2015-06-05吡格列酮对膀胱癌患者机体炎症因子抑制作用的分析现代检验医学杂志(2015年2期)2015-02-06早期微量肠内喂养对极低出生体质量儿预后的影响河南医学研究(2014年7期)2014-02-27推荐访问:作用 保护 研究