荞麦多酚干预对高脂膳食诱导小鼠的降脂作用及其调控机制
来源:优秀文章 发布时间:2023-04-14 点击:
姚轶俊,鞠兴荣,王立峰
荞麦多酚干预对高脂膳食诱导小鼠的降脂作用及其调控机制
姚轶俊,鞠兴荣,王立峰
南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心,南京 210023
【背景】目前已有相关动物实验证实荞麦对于高脂膳食引起的肥胖和脂代谢紊乱具有良好的干预作用。同时研究表明,棕色脂肪适应性产热可以有效改善人体能量新陈代谢。因此,增加棕色脂肪活性、促进白色脂肪棕色化可作为一种预防肥胖和改善能量代谢疾病的有效途径。【目的】采用原粮及从荞麦中鉴定出的4种主要酚类物质按在原粮中的含量比例配制成多酚干预物进行干预,研究荞麦多酚通过调节白色脂肪棕色化对高脂膳食小鼠的干预及改善作用,系统研究荞麦中发挥降脂功能的主要酚类物质及其对脂代谢的调控机制。【方法】通过UHPLC-Q-Orbitrap质谱结合数据库对荞麦多酚提取物中的酚类物质进行鉴定,并通过相对定量将其中含量最多的主要多酚按其在荞麦原粮中的含量比例配制成多酚复合物。通过添加荞麦饲料以及荞麦多酚复合物干预C57BL/6J小鼠饮食,研究荞麦酚类物质改善脂质代谢的作用。以10%、20%、40%比例的荞麦替换基础饲料和2.5 mg∙mL-1荞麦多酚复配物对小鼠进行饮食干预,探究荞麦对小鼠体重、脏器指数和血脂水平的调节作用。并通过Western-blot和q-PCR探究荞麦饲料及多酚干预对小鼠皮下脂肪组织中与产热相关的蛋白及基因表达的影响。【结果】通过UHPLC-Q-Orbitrap质谱鉴定出荞麦多酚提取物中的20种酚类化合物,其中含量最高的4种酚类化合物羟基肉桂酸、槲皮素、滨蒿内酯和芦丁含量达到酚类总量的80%以上,为荞麦中的主要酚类物质。在饮食干预39 d后,与高脂饮食组相比,添加荞麦饲料以及荞麦多酚干预对小鼠的体重、肝脏指数以及血清中甘油三酯、总胆固醇、低密度脂蛋白、谷草转氨酶和谷丙转氨酶的增加有显著的抑制作用,并且随着荞麦添加量的提高,其抑制作用也增加。同时,添加荞麦饲料以及荞麦多酚干预对小鼠肾脏指数、高密度脂蛋白的降低起到了保护和改善的作用。高剂量40%荞麦和多酚干预组的效果最好,表明荞麦饮食干预对高脂膳食诱导的肥胖小鼠脂代谢异常的改善是其中的酚类物质发挥了主要作用。与正常饮食组相比,高脂饮食组中与棕色脂肪相关的UCP1、PRDM-16和PGC-1α蛋白表达水平显著降低,而与白色脂肪特异性表达的Tcf21和HOXC8水平显著上调(<0.05)。饮食干预后,荞麦干预组中UCP1、PRDM-16和PGC-1α的蛋白表达水平均显著上调,Tcf21和HOXC8的蛋白表达均显著下降(<0.05)。此外,40%荞麦和多酚干预组还有效地提高了小鼠皮下脂肪组织中和的表达(<0.05),并下调和的表达。【结论】荞麦干预可以有效改善高脂饲料诱导小鼠脂代谢紊乱情况,并证实了荞麦多酚在其中发挥了主要作用,其作用机理主要是荞麦多酚可以显著提高棕色脂肪产热活性,同时下调白色脂肪特异性表达,调节能量代谢平衡,改善高脂饮食诱导的高脂血症和能量代谢紊乱。研究结果为荞麦的利用和相关降脂功能食品的开发提供了新的研发思路和理论依据。
荞麦;
多酚;
高脂膳食小鼠;
降脂作用;
白色脂肪棕色化
【研究意义】近年来,肥胖已经成为一个国际性的公共问题,增加了大部分国家及地区的疾病风险[1-2]。肥胖与很多慢性代谢疾病密切相关,如高血压、心血管疾病、炎症、Ⅱ型糖尿病和癌症[3-4]。因此,预防和治疗肥胖症正受到越来越多研究人员的关注。由于人体脂肪组织主要分为白色脂肪和棕色脂肪两种。白色脂肪负责储存能量;
棕色脂肪负责适应性产热以消耗能量,在调节能量平衡中起重要作用,它的适应性产热可以有效改善人体能量新陈代谢。因此,激活棕色脂肪,下调白色脂肪特异性表达可作为一种预防高脂血症和改善能量代谢疾病的有效途径[5]。越来越多的杂粮及其功能性成分被证明具有减轻血脂异常,减轻炎症并治疗肥胖等生物活性功能[6-7],在一定条件下可干预白色脂肪向棕色转变(获得棕色脂肪表型、具有产热效能),发挥拮抗肥胖形成的作用[8]。利用天然食品诱导白色脂肪棕色化在肥胖防治中具有可行性和现实意义。【前人研究进展】荞麦中富含具有生物活性功能的酚类化合物,包括酚酸、香豆素、单宁酸、黄酮类化合物、烷基间苯二酚等,具有降糖、降脂、降胆固醇、抗氧化、抗衰老和清除自由基的功能[9]。荞麦多酚一般分布于壳及种皮中,由于分子内的苯环上一个或多个氢原子被羟基及其衍生物取代,因此其作为良好的电子供体具有很好的功能活性[10]。相关研究已鉴定出苦荞中含有松柏醇、丁香酸、阿魏酸、丁香脂素等酚类化合物,并且这些酚类化合物都具有显著的抗氧化活性,显示出了良好的调节糖脂代谢能力[11]。此外,越来越多的酚类物质被证明具有诱导白色脂肪棕色化作用,如相关研究发现绞股蓝皂苷可通过调节PGC-1α和PRDM-16的表达来提高棕色脂肪活性,从而增加脂代谢异常的能量消耗[8];
姜黄素可通过减轻白色脂肪炎症并提高线粒体解偶联蛋白1(UCP1)的表达来维持能量代谢稳态[12]。作为棕色脂肪线粒体中的解偶联蛋白,UCP1在产热脂肪细胞中起着重要的作用,并通过非颤抖性产热来消耗能量[13]。PGC-1α是与能量代谢密切相关的转录辅助活化因子,可调控线粒体生物合成并提高能量代谢[14]。PRDM-16作为转录调节因子,促进白色脂肪转化为棕色脂肪前体细胞[15]。而和是白色脂肪细胞特异性基因[16]。【本研究切入点】目前,已有相关动物实验证实荞麦对于高脂膳食引起的肥胖和脂代谢紊乱具有良好的干预作用;
同时,对于酚类化合物基于白色脂肪棕色化调节脂代谢作用机制的相关研究也有报道。但是还未见荞麦及其主要酚类物质对于高脂膳食诱导肥胖小鼠的干预及其作用机制的系统研究。【拟解决的关键问题】本研究利用UHPLC-Q-Orbitrap质谱对荞麦多酚进行鉴定,并将其中4种主要酚类物质按原粮含量比例配制成多酚干预物,利用动物实验研究荞麦及其酚类物质对高脂膳食诱导肥胖小鼠的干预及改善作用;
并进一步通过研究其对激活棕色脂肪,下调白色脂肪特异性表达相关的蛋白与基因的影响揭示荞麦及其多酚调节脂代谢的作用机制,为进一步提高荞麦资源的营养价值提供理论依据。
试验于2020年在南京财经大学进行。
1.1 试验材料与试剂
荞麦(大三棱,市售),购于山西东方亮生命科技有限公司。基础饲料(荞麦、动植物蛋白、油脂、必需氨基酸、复合维生素、矿物质),购于江苏省协同医药生物工程有限公司。实验动物,健康雄性C57BL/6J小鼠36只,6—8周龄,普通饲料适应性喂养1周,根据体重随机分组,每笼6只。
羟基肉桂酸、槲皮素、滨蒿内酯、芦丁标准品,购于Sigma-Aldric;
甘油三酯(TC)检测试剂盒、总胆固醇(TG)检测试剂盒、高密度脂蛋白胆固醇(HDL-C)检测试剂盒、低密度脂蛋白胆固醇(LDL-C)检测试剂盒、丙氨酸氨基转移酶(ALT)检测试剂盒、天门冬氨酸氨基转移酶(AST)检测试剂盒,购于碧云天生物科技研究所;
通用型组织固定液,购于武汉塞维尔生物科技有限公司;
逆转录试剂、SYBR qPCR试剂、BCA蛋白浓度测定试剂盒、PI蛋白酶抑制剂购于美国Thermo Fisher生物科技有限公司;
RIPA裂解液、30%丙烯酰胺,购于生工生物工程(上海)股份有限公司;
其他分析试剂购于南京化学试剂公司。
数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;
ALpHA2-4型真空冷冻干燥机,德国Christ公司;
M2e多功能酶标仪,美国分子仪器公司;
AL204分析天平,德国梅特勒托利多公司;
Gel Doc XRS+凝胶成像系统、Mini Trans-Blot电转印单元、Mini-P4微型垂直电泳仪,美国Bio-Rad公司;
7500 Real-Time PCR仪、RNA浓度测定仪、QE HF-X质谱仪、Vanquish UHPLC色谱仪、Accucore Vanquish C18 column色谱柱、ST16R低温离心机,美国Thermo Fisher生物科技有限公司。
1.2 试验方法
1.2.1 荞麦多酚的提取 取荞麦20 g,加蒸馏水180 mL于器皿中,用电磁炉以1 800 w功率加热,待水开始沸腾后蒸煮25 min,并在蒸煮后关掉电磁炉再焖制10 min。冷却至室温后用料理机匀浆3 min后取20 mL,10 000 r/min离心10 min取上清液,再分别按照体积比1﹕1加入80%乙醇除去剩余的蛋白和多糖,10 000 r/min离心10 min取上清液,40℃下用旋转蒸发仪真空浓缩除去有机溶剂,冻干后于-20℃保存备用。
1.2.2 基于UHPLC-Q-Orbitrap质谱对荞麦多酚组成的鉴定 取100 mg荞麦多酚提取物置于EP管中,以400 μL的80%甲醇进行溶解,涡旋震荡,14 000×、4℃离心15 min,取上清液进样UHPLC-Q-Orbitrap质谱分析。
色谱条件:柱温40℃,流速0.3 mL∙min-1,正离子模式,流动相A:0.1%甲酸、95%乙腈、10 mmol∙L-1醋酸铵;
流动相B:0.1%甲酸、50%乙腈、10 mmol∙L-1醋酸铵洗脱程序见表1。
质谱条件:扫描范围选择m/z 100—1 500;
ESI源的设置如下:Spray Voltage:3.2 kV;
Sheath气流量:35 arb;
Aux气流量:10 arb;
温度:320℃。正离子模式;
MS/MS二级扫描为data-dependent scans。

表1 色谱梯度洗脱程序
1.2.3 动物分组喂养 健康雄性C57BL/6J小鼠,6—8周龄,普通饲料适应性喂养1周,根据体重随机分及组:①对照组(Control,Con),②基础高脂组(high fat diet,HFD),③多酚给药组(Treat),④10%荞麦高脂组,⑤20%荞麦高脂组,⑥40%荞麦高脂组。每笼6只,在温度(22±2)℃,湿度(55±5)%,12 h/12 h的昼夜交替环境下饲养,每笼小鼠每日食用饲料配方按照表2配制,饲料量限定为(20±1)g。基础饲料详细成分如表2所示,高脂饲料及荞麦饮食干预组饲料配方如表3所示。多酚干预组基肉桂酸、槲皮素、滨蒿内酯、芦丁质量比12﹕2﹕2﹕1。同时根据本笔者实验室前期研究中细胞试验结果(当多酚浓度为2.5 mg∙mL-1时具有最佳的降脂功效[17]),本试验中所配制的多酚干预物浓度为2.5 mg∙mL-1。按每2 d灌喂一次,每3 d称一次体重,饲养13周收集完粪便后处死小鼠,收集血液,室温静置40 min后,在离心机中3 500 r/min离心15 min,分离出血清,取肝脏、肾脏、心脏、胰腺以及皮下脂肪称重,计算脏器系数。肝脏组织除用于病理观察外,分成两部分,与皮下脂肪分别包于锡箔纸放进液氮壶中,隔夜取出于-80℃储存备用。

表2 基础饲料主要成分

表3 各组动物饲料主要配方
1.2.4 血清指标检测 本试验采用眼球血清来测定各组小鼠的血清生化指标。检测的血清指标及使用的试剂盒分别为:总甘油三酯(TG),索莱宝BC0620;
总胆固醇(TC),索莱宝BC1980;
高密度脂蛋白(HDL-C),建成A112-1;
低密度脂蛋白(LDLC),建成A113-1;
谷丙转氨酶(ALT),原叶;
谷草转氨酶(AST),原叶。所有血清指标测定均按照试剂盒说明书进行。
1.2.5 肝脏组织病理切片及HE染色 随机选择小块肝脏,并在10%中性甲醛溶液中固定24 h后用水洗净。然后经乙醇梯度脱水,流程为:50%乙醇(30 min),70%乙醇(30 min),85%乙醇(30 min),95%乙醇(30 min),100%乙醇(30 min)。脱水后,用二甲苯对其进行透明处理以去除脱水剂。最后,将其包埋在石蜡中以制备组织切片(平均厚度约为5 μm),以备HE染色并观察病理学形态。HE染色流程为:(1)脱蜡:二甲苯脱蜡,两次,每次10 min。(2)水化:用梯度为100%、95%、85%、70%、50%乙醇洗涤,再用去离子水冲洗5 min。(3)染色:苏木精染色10 min,水洗5 min;
1%盐酸乙醇分化30 s,水洗30 s;
去离子水洗5 s,0.5%伊红液染色2 min,去离子水洗1 min。(4)脱水、透明:经70%乙醇(1 min),85%乙醇(1 min),95%乙醇(3 min),100%乙醇(3 min),100%乙醇(3 min)梯度脱水,再经二甲苯浸泡10 min。(5)封片:以中性树胶封固[18]。
1.2.6 小鼠皮下脂肪组织总蛋白提取及蛋白定量 每组取4只小鼠皮下脂肪组织各约20 mg,加入含有终浓度为1 mmol∙L-1PMSF的RIPA裂解液100 μL冰上裂解30 min。裂解完成后,在4℃下,以12 000×离心5 min。将上清液转移至微量离心管中,-20℃保存待用。采用Thermo的BCA蛋白浓度测定试剂盒进行蛋白定量。
1.2.7 Western Blot蛋白表达的检测 取一定量的蛋白样品与上样缓冲液混合,95—100℃煮沸5 min。将蛋白加入10%聚丙烯凝胶电泳进行分离。浓缩胶:80 V,30 min;
分离胶:120 V,60 min。电泳结束后将分离胶上的蛋白转移至PVDF膜上。转膜条件为:320 mA,60 min。转膜结束后,用封闭液(20 mL TBST、1 g脱脂奶粉)将膜封闭1 h,后用合适的稀释一抗,4℃孵育过夜。然后将膜自一抗稀释液中取出,用TBST洗涤4次,每次6 min。随后将膜用合适的稀释二抗室温孵育1 h。二抗孵育完毕后,将膜用TBST洗4次,每次6 min。最后用ECL系统进行曝光,测定目标蛋白。
1.2.8 小鼠皮下脂肪组织总RNA提取及实时荧光定量PCR分析 根据说明书,使用TRIzol(Sigma,USA)从小鼠皮下脂肪组织中分离总RNA。用逆转录试剂盒(Takara,JP)将分离出的mRNA逆转录成cDNA。实时荧光定量PCR反应体系(20 μL)为:2×SYBR qPCR Mastermix 10 μL,Primer forward 0.4 μL,Primer reversed(10 μm)0.4 μL,Template DNA 1 μL,DEPC水8.2 μL。上述体系在实时定量PCR仪上反应,PCR反应程序为:Step 1:95℃,30 s;
Step 2:95℃,10 s;
Step 3:60℃,20 s,Step 4:72℃,60 s。其中Step 1—3重复40次。从60℃升到95℃时,温度爬升速率为:△T=1℃,15 s。本试验中选取的目标基因及相关引物序列如表4所示[19]。
1.2.9 数据分析 使用Excel 2017和SPSS Statistics 21.0软件对数据进行整理与统计分析,所有试验至少测量3次,结果显示为平均值。采用单因素方差分析(ANOVA)进行差异显著性比较(<0.05)。使用Excel 2017作图。
2.1 荞麦多酚提取物成分鉴定
如表5所示,通过UHPLC-Q-Orbitrap质谱并结合3个数据库(mzCloud、mzVault和ChemSpider)分析多酚类化合物的质谱信息。鉴定结果优先级为数据库比对结果优于推测结果。3种数据库mzCloud>mzValut>ChemSpider,如果不同数据库鉴定结果不一致,则采用优先级更高的鉴定结果[17]。根据以上标准鉴定出荞麦多酚提取物中的20种多酚类化合物,包括羟基肉桂酸、槲皮素、滨蒿内酯、儿茶素、芦丁、大豆苷、咖啡酸、柚皮素、甲氧基肉桂酸、东莨菪素、原花青素、二羟基苯基丙酸、黄豆黄素苷、金丝桃苷、根皮素、虾青素、橙皮甙、儿茶酸、槲皮甙和异鼠李素。根据这20种化合物的峰面积进行相对定量分析,发现相对含量最多的4种酚类为羟基肉桂酸、槲皮素、滨蒿内酯和芦丁,占酚类总量的80.61%,且他们在荞麦中的含量之比为12﹕2﹕2﹕1。因此,在后续试验中将这4种荞麦主要多酚按荞麦原料中的比例配制成多酚混合物,用生理盐水配制成2.5 mg∙mL-1作用于多酚干预组小鼠,通过与不同比例的荞麦替换基础饲料干预的高脂膳食小鼠做对比,探讨荞麦的降脂功能及荞麦多酚在其中发挥的作用。
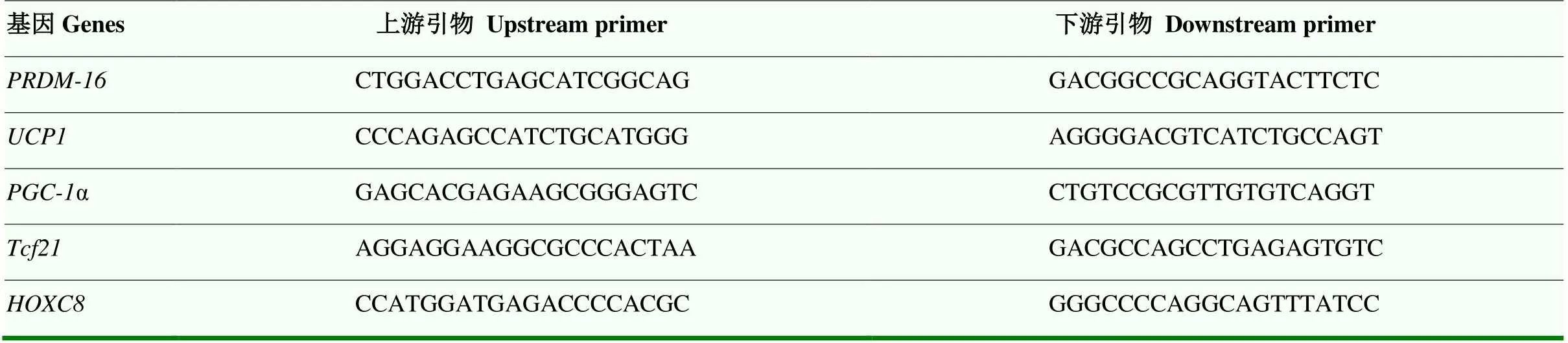
表4 目标基因及相关引物序列
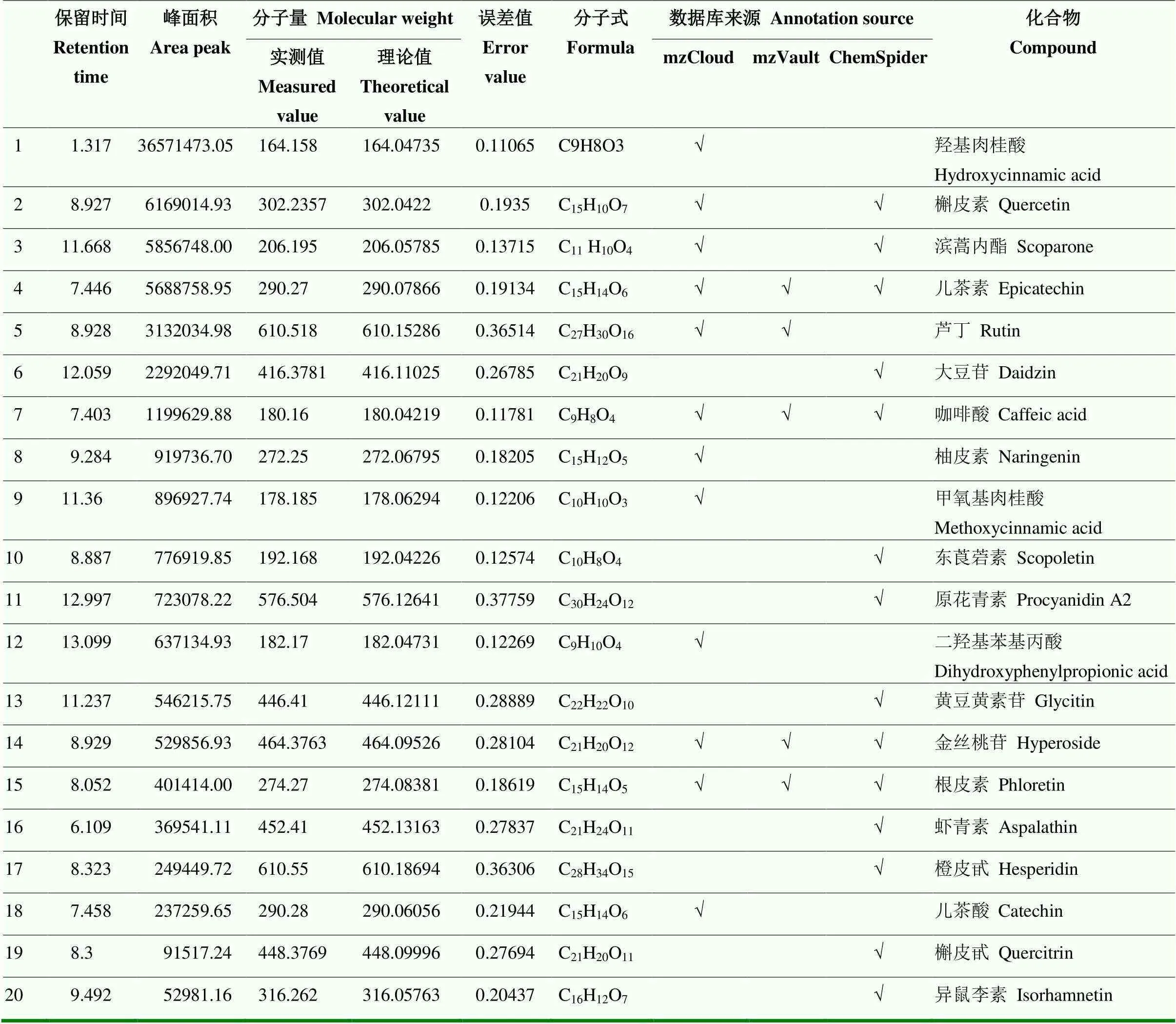
表5 基于UHPLC-Q-Orbitrap质谱鉴定荞麦提取物中多酚的组成
2.2 荞麦及其多酚干预对高脂小鼠体重及脏器指数的影响
高脂饮食喂养可借助动物建立与人类病理生理学比较相似的抗肥胖干预试验的体内模型[20]。小鼠的体重变化趋势如图1所示。喂养39 d后,高脂饮食组小鼠体重平均增加10.61 g,显著高于正常饮食组的5.32 g。同样在饮食干预39 d后,与高脂饮食组相比,高、中、低剂量的荞麦饮食干预组中体重增加均显著降低(P<0.05),分别为6.8、7.6和9.27 g。随着荞麦添加比例的增加,小鼠体重的增加量逐渐减小,说明荞麦对高脂饲料诱导的小鼠体重增加有显著的抑制效果。同时,在多酚干预组发现经39 d干预后,多酚干预组小鼠体重平均增加4.11 g,低于对照组增加量,说明荞麦多酚标品混合物对于高脂膳食小鼠体重增长抑制作用显著,可以考虑其在减脂领域的应用价值。

###: P<0.001 (vs HFD)。下同The same as below
图2为高脂饮食组和不同比例荞麦及多酚干预组小鼠的脏器指数的变化,用以评估荞麦及其多酚干预样品对小鼠脏器指数的影响。喂养39 d后,高脂饮食组小鼠的肝脏指数与对照组相比显著增加,肾脏指数与对照组相比显著降低(图2-A、B),说明连续高脂饮食使小鼠肝周产生脂肪堆积,同时对于小鼠的肾脏产生了一定程度的损伤。在饮食干预39 d后,与高脂饮食组相比,高、中剂量的荞麦饮食干预组中小鼠肝脏指数的增加均显著降低(P<0.05)、肾脏指数的增加均显著上升(P<0.05)。随着荞麦添加比例的增加,小鼠肝脏指数的增加量逐渐减小,其中40%荞麦添加组与高脂组相比差异极显著。同时,多酚标品干预组经39 d干预后,干预组与高脂组相比肝脏指数的下降和肾脏指数的上升也差异极显著。说明20%和40%的荞麦添加量以及荞麦多酚干预对高脂饲料诱导的小鼠脂肪肝有显著的改善作用,对其肾脏损伤则有显著的保护效果。此外,高脂饲料以及饮食干预对于小鼠心脏、胰脏指数则不直接相关(图2-C、D)。
2.3 荞麦及其多酚干预对高脂小鼠血生化指标的影响
如图3所示,高脂饲料喂养39天后,小鼠血清中的总胆固醇含量从2.56 mmol·L-1上升至4.02 mmol·L-1,甘油三酯含量从1.78 mmol·L-1上升至3.89 mmol·L-1,变化极显著(图3-A、B)。随着饲料中荞麦含量的增加,小鼠血清中总胆固醇、甘油三酯的含量逐渐降低,抑制效果显著;
多酚干预组中小鼠血清中总胆固醇和甘油三酯的含量也明显降低,表明荞麦饮食干预对高脂膳食诱导的肥胖小鼠脂代谢异常的改善是其中的酚类物质发挥了主要作用[21]。同时,随着饲料中荞麦含量的增加,小鼠血清中低密度脂蛋白的含量逐渐降低,高密度脂蛋白的含量则逐渐增加,其中高、中剂量荞麦饮食干预以及多酚干预对小鼠血清中低密度脂蛋白的抑制作用显著;
对高脂饲料造成的小鼠血清中高密度脂蛋白下降则有显著的保护作用。研究表明,谷丙转氨酶和谷草转氨酶是肝脏健康的指标。只要有1% 的肝细胞坏死,血液中的酶活性就会增加一倍。当肝细胞膜的通透性增加时,即使无坏死,细胞内转氨酶也可由于如此明显的浓度梯度差而泄露入血中,因此血清转氨酶(谷丙转氨酶、谷草转氨酶等)是肝细胞损伤的敏感指标,血清转氨酶升高在一定程度上反映了肝细胞的损害程度,是急性肝细胞损伤的敏感标志物[22]。从图3-E、F中可以看出,高、中、低剂量荞麦饮食干预以及荞麦多酚干预组在39 d后,小鼠血清中谷丙转氨酶含量分别为9.04、11.30、13.56和9.02 U·L-1;
谷草转氨酶含量分别为25.01、27.14、29.12和24.33 U·L-1。随着饲料中荞麦含量的增加,小鼠血清中两种酶的含量均逐渐降低,抑制效果显著。多酚干预组的抑制效果和40%荞麦干预组相当。
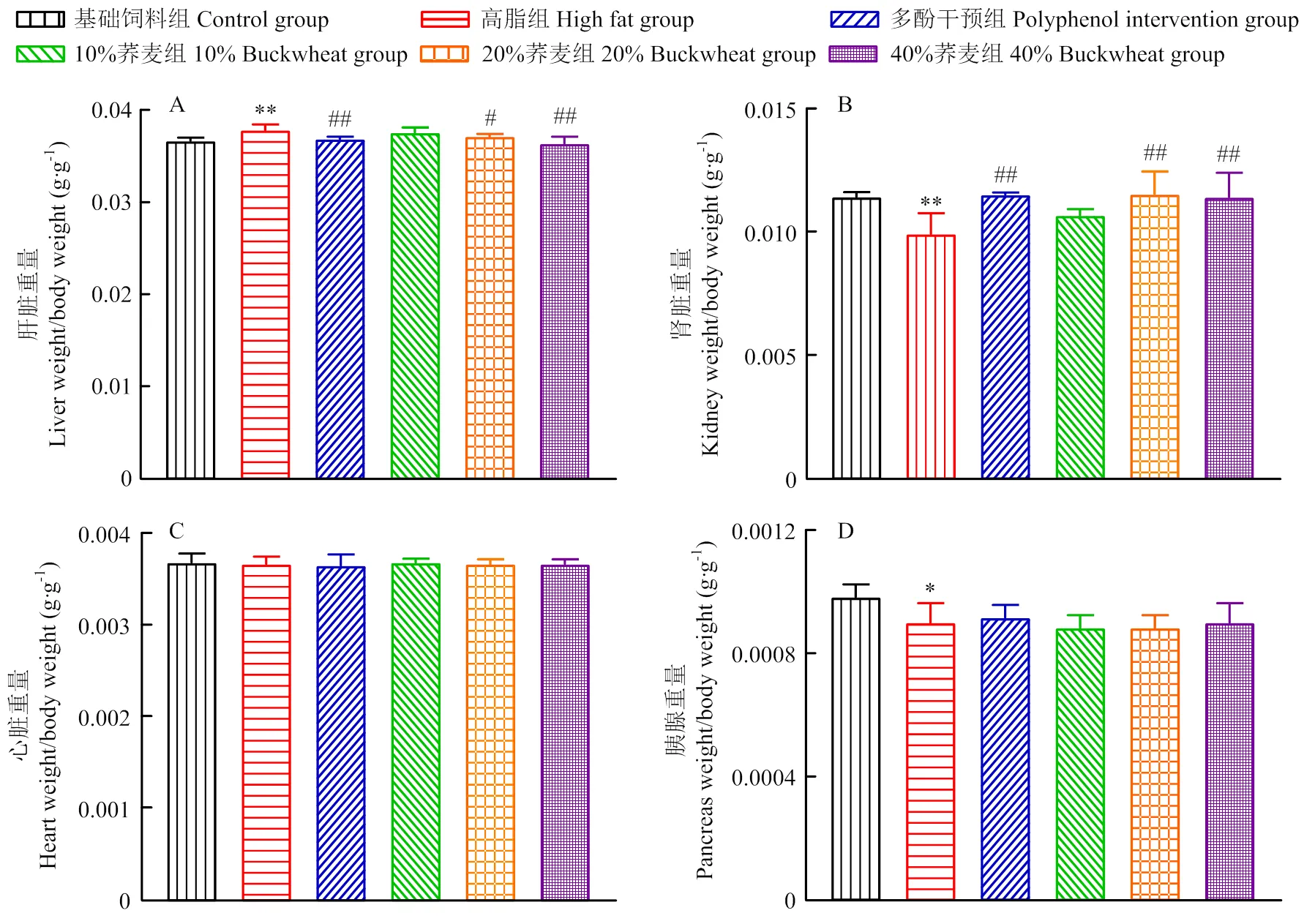
*: P<0.05, **: P<0.01 (vs Con); #: P<0.05, ##: P<0.01 (vs HFD)。下同 The same as below
2.4 荞麦及其多酚干预对高脂小鼠体肝脏组织形态的影响
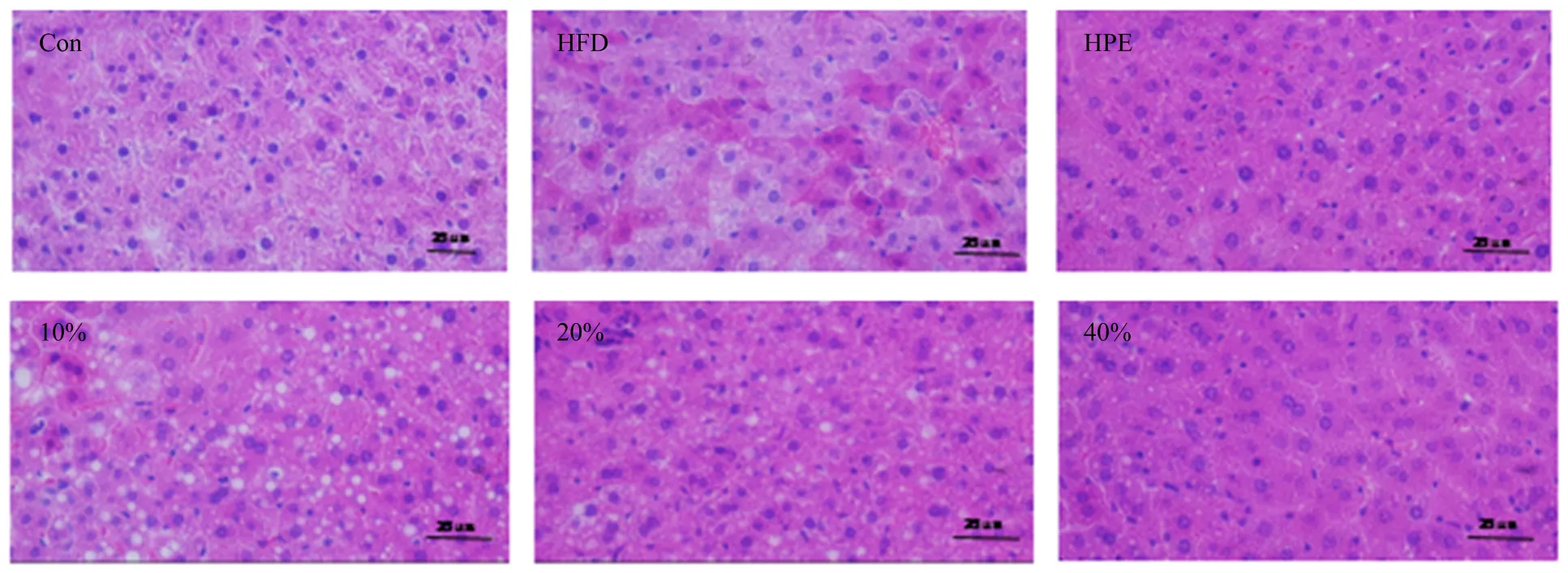
肝脏脂肪堆积引起的脂肪性肝炎可进一步导致肝脏疾病,包括肝硬化、肝癌等[23]。本研究通过小鼠肝脏病理组织切片,从组织形态学分析了高脂饮食喂养、杂粮饮食以及多酚干预对小鼠肝组织形态的影响。从图4可看出,正常饮食组小鼠肝脏细胞较为清晰完整;
而高脂饮食组小鼠的肝细胞模糊紊乱,脂肪在肝细胞内堆积至形成脂肪滴,出现了严重的脂肪变性。当体内脂肪、糖类、蛋白质代谢异常时,尤其致胰岛素抵抗后,可促使血中大量脂肪酸进入肝脏,使肝内新合成甘油三酯增加,从而肝内脂肪酸的氧化负荷增加,并产生大量自由基,可导致线粒体DNA损伤,出现类结晶包涵体,这是氧化应激反应的结果。由于线粒体损伤加重了肝细胞的能量代谢障碍,使脂质氧化途径受损,造成大量脂质储积于肝细胞内形成脂肪肝[24]。饮食干预后,与高脂组动物相比,荞麦饲料组和多酚干预组小鼠肝组织中脂肪滴体积均有所减小,肝细胞更加清晰,表明荞麦多酚在不同程度上缓解了小鼠肝组织中脂肪累积,减轻了肝脂肪变性。同样,40%荞麦组和多酚干预组小鼠肝组织损伤减轻效果更为明显,表明随荞麦添加量的增加,对肝脏的保护作用逐渐加强,其中的酚类物质发挥了主要作用。

***: P<0.001 (vs Con)。下同 The same as below
2.5 不同含量的荞麦及其多酚干预对高脂小鼠白色脂肪棕色化相关蛋白表达的影响
如图5所示,经高脂饲料喂养39 d后,小鼠皮下脂肪组织中UCP1、PRDM-16和PGC-1α的表达量均降低至对照组的50%以下,Tcf21和HOXC8的表达量则上升至对照组的1.76及1.93倍。经高、中、低剂量荞麦饲料以及荞麦多酚干预39 d后,小鼠皮下脂肪组织中UCP1、PRDM-16和PGC-1α的表达量显著上升;
Tcf21和HOXC8的表达量则明显下降,其对相关蛋白表达的影响与饲料中荞麦的添加量成正相关(图5-E、F)。说明添加不同比例的荞麦以及多酚干预可以有效增加小鼠皮下脂肪组织中与褐色脂肪产热相关蛋白UCP1、PRDM-16和PGC-1α的表达,同时抑制与白色脂肪相关蛋白Tcf21和HOXC8的表达。通过调控线粒体生物合成并提高能量代谢从而促进褐色脂肪的能量代谢,同时减少白色脂肪相关蛋白的表达,调节白色脂肪转化为棕色脂肪前体细胞从而促进白色脂肪的棕色化。另外,随着荞麦添加量的增加,干预效果显著增加,即40%比例的荞麦饲料的改善效果最好。因此,后续试验采用实时荧光定量PCR检测40%荞麦及其多酚对高脂小鼠褐色脂肪、白色脂肪特异性基因以及白色脂肪棕色化相关基因表达的调控作用。
Con:基础饮食组;
HFD:高脂饮食组;
HPE:高脂饮食组多酚干预组;
10%:10%荞麦饲料;
20%:20%荞麦饲料;
40%:40%荞麦饲料Con: Basic diet group; HFD: High-fat diet group; HPE: High-fat diet group was given polyphenols; 10%: Feed containing 10% buckwheat; 20%: Feed containing 20% buckwheat; 40%: Feed containing 40% buckwheat
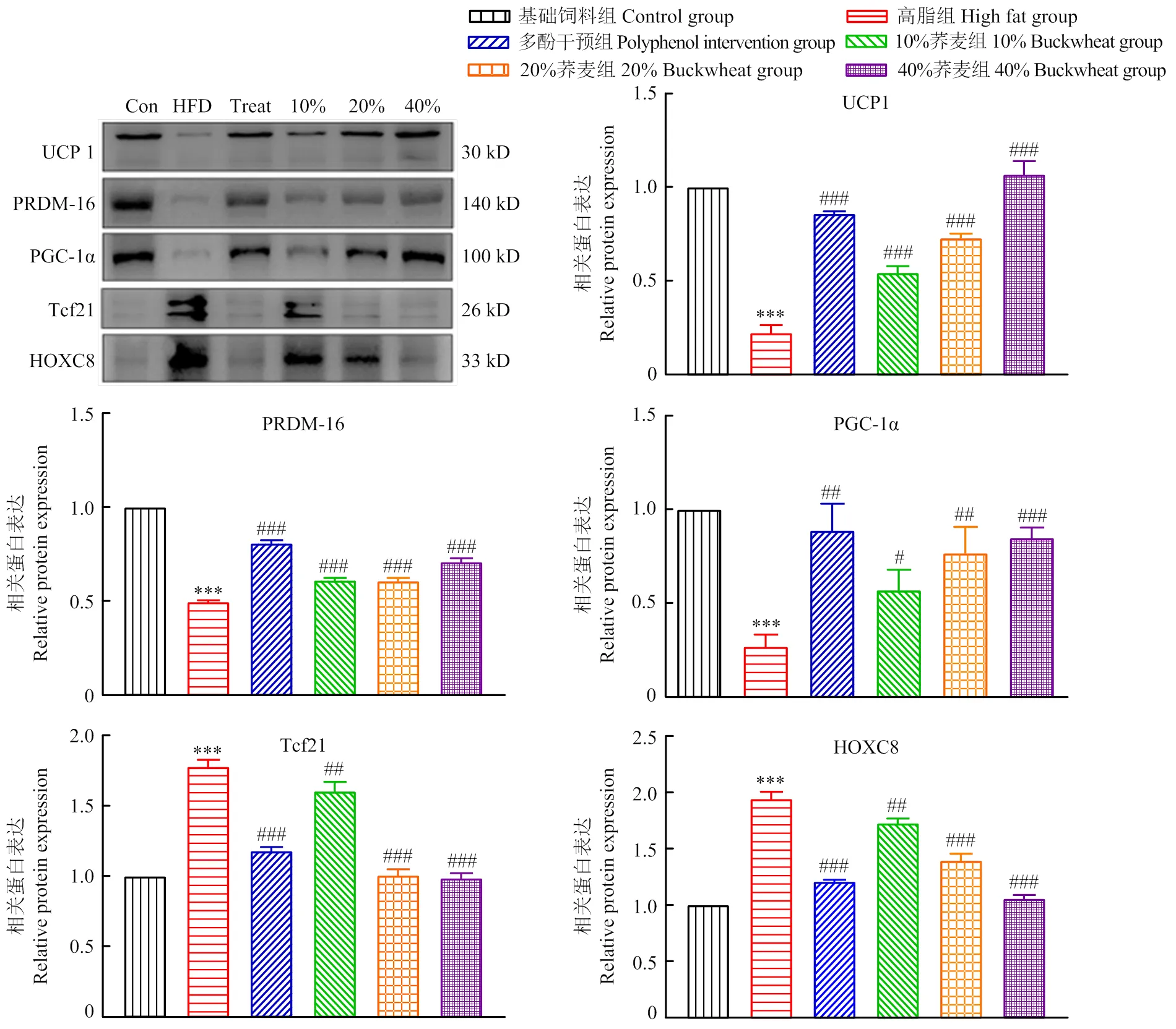
图5 不同添加量荞麦饲料及其多酚干预对高脂膳食小鼠皮下脂肪组织中相关蛋白表达的影响
2.6 荞麦及其多酚干预对高脂小鼠白色脂肪棕色化相关基因表达的影响
如图6所示,经高脂饲料喂养39 d后,小鼠皮下脂肪组织中和表达量分别降低为对照组的28%、24%和21%;
和表达量则上升到对照组的4倍以上。经过39 d的40%荞麦饲料以及荞麦多酚干预后,小鼠皮下脂肪组织中和的表达量显著上升(图6-A—C),和表达量则明显下降(图6-D—E)。说明含有40%荞麦饲料以及荞麦多酚干预可有效提高小鼠脂肪组织中和的表达量,调控线粒体生物合成并提高能量代谢从而促进褐色脂肪的能量代谢。同时下调的表达,减少白色脂肪相关蛋白的表达从而促进褐色脂肪能量代谢。

图6 40%添加量荞麦饲料及其多酚干预对高脂膳食小鼠皮下脂肪组织中相关基因表达的影响
3.1 荞麦及其多酚对高脂膳食诱导肥胖小鼠具有显著降脂作用
长期的高脂饮食会导致能量过剩脂肪促使肥胖的发生,伴随而来肥胖、血脂异常等慢性疾病症状。因此,膳食干预在肥胖管理及其与相关疾病预防上的重要性也逐渐被关注。本研究通过鉴定出荞麦多酚提取物中的20种酚类化合物,根据相对定量分析发现相对含量最多的4种酚类为羟基肉桂酸、槲皮素、滨蒿内酯和芦丁,已有相关文献报道其具有降脂功效[19]。研究表明,总胆固醇、甘油三酯、低密度脂蛋白、谷丙转氨酶、谷草转氨酶等血清指标与心血管疾病相关,是心血管疾病的生物标志物[25]。高脂膳食干预会导致小鼠血脂异常以及肝脏脂肪性病变[26]。
本研究证实了添加荞麦饲料以及荞麦多酚干预对小鼠体重、肝脏指数以及血清中甘油三酯、总胆固醇、低密度脂蛋白、谷草转氨酶和谷丙转氨酶的增加有显著的抑制作用,并且随着荞麦添加量的提高,抑制作用也增加。Singh等[21]也研究杂粮中-葡聚糖对小鼠胆固醇代谢相似的影响,结果表明经-葡聚糖处理后,TG降低24.14%,T-CHO降低15.53%。
高脂膳食诱导脂肪在肝细胞内堆积至形成脂肪滴,出现了严重的脂肪变性。当体内脂肪、糖类、蛋白质代谢异常时,尤其致胰岛素抵抗后,可促使血中大量脂肪酸进入肝脏,使肝内新合成甘油三酯增加,从而肝内脂肪酸的氧化负荷增加,并产生大量自由基,可导致线粒体DNA损伤,出现类结晶包涵体[27]。荞麦饲料的添加可减缓小鼠肝组织中脂肪累积,减轻肝脂肪变性。同时也发现直接用荞麦多酚干预对肝脏的保护作用更强,证实了是荞麦多酚起到了主要的改善作用。
3.2 荞麦多酚影响高脂小鼠白色脂肪棕色化的作用机制
脂肪组织主要分为两种,白色脂肪和棕色脂肪。白色脂肪负责储存能量,棕色脂肪负责适应性产热以消耗能量,在调节能量平衡中起重要作用。PORTER等[28]研究发现,褐藻素可诱导高脂饮食的实验动物腹部白色脂肪棕色化,上调mRNA和蛋白表达水平,增加脂肪分解代谢相关基因表达。此外,槲皮素等植物化学物的抗肥胖作用也被证实与增加白色脂肪细胞中线粒体含量、上调UCP1蛋白表达、诱导白色脂肪细胞棕色化、增强脂肪酸氧化和能量消耗有关。因此,从天然作物中筛选具有诱导白色脂肪棕色化作用的功能性植物基食品,可成为肥胖防治的又一方向[12]。
研究发现可以刺激核呼吸因子1和2(,)基因表达,与共同结合于线粒体转录激活因子(mitochondrial transcription activating factor a,mtTFA)的启动子区,增强表达,促进线粒体DNA复制、转录,刺激线粒体生物合成[13-14]。已经证实PGC-1α可以诱导白色脂肪细胞棕色化、增强细胞代谢活性以及整体代谢速率。还可以共活化PPARα、维甲酸受体、甲状腺受体等信号因子,增强褐色脂肪特异基因的表达,促进氧化磷酸化解耦联、增加产热[28]。因此,在诱导白色脂肪细胞棕色化中发挥了关键的作用。
是调控前体细胞分化为棕色脂肪细胞的分子开关,它曾被认为仅在白色脂肪中存在。高表达的转基因小鼠,腹股沟白色脂肪中出现表达等棕色脂肪特异基因的棕色样脂肪细胞,而白色脂肪标志基因抵抗素表达下调,动物表现为能耗增加、葡萄糖耐受性升高和肥胖抵抗。但是如对来自腹股沟的白色脂肪细胞进行沉默,细胞内产热基因表达与氧化磷酸化解耦联均显著减少,表达增加[15]。同时发现表达不足时,3-AR激动剂诱导的白色脂肪棕色化作用明显受抑制。研究证实,除了参与前体细胞向褐色脂肪细胞的分化外,对于诱导白色脂肪棕色化、增强机体产热活性也具有重要作用。
为白色脂肪特异性基因,在白色脂肪中高表达。冷驯化导致其表达量下降,因而在棕色脂肪中的表达量很低[16]。因此,通过WB和qPCR结果表明添加荞麦可以明显提高小鼠棕色脂肪产热活性,减少白色脂肪含量,调节能量代谢平衡,从而对高脂膳食小鼠起到干预及改善作用,并再次证实了其中荞麦多酚起到了主要的干预作用。
本研究通过UHPLC-Q-Orbitrap质谱鉴定出荞麦多酚提取物中的20种酚类化合物,并将其中4种主要多酚羟基肉桂酸、槲皮素、滨蒿内酯、芦丁按荞麦原料中的比例(质量比12﹕2﹕2﹕1)配制成多酚混合物。动物实验表明,添加40%荞麦饲料以及荞麦多酚干预均可有效改善高脂膳食诱导的肥胖小鼠的高脂血症和能量代谢紊乱,并初步推断其作用机理是荞麦中的酚类物质激活棕色脂肪并诱导白色脂肪细胞向棕色脂肪前体转变,下调白色脂肪特异性基因的表达,从而调控脂质代谢。
[1] Bray G A, Frühbeck G, Ryan D H, Wilding J P. Management of obesity. The Lancet, 2016, 387(10031): 1947-1956.
[2] Scully T. Public health: Society at large. Nature, 2014, 508(7496): S50-S51.
[3] Ruby M A, Massart J, Hunerdosse D M, Schönke M, Correia J C, Louie S M, Zierath J R. Human carboxylesterase 2 reverses obesity-induced diacylglycerol accumulation and glucose intolerance. Cell Reports, 2017, 18(3): 636-646.
[4] Chen G J, Xie M H, Dai Z Q, Wan P, Ye H, Zeng X X, Sun Y. Kudingcha and fuzhuan brick tea prevent obesity and modulate gut microbiota in high-fat diet fed mice. Molecular Nutrition & Food Research, 2018, 62(6): 1700485.
[5] Lu P, Zhang F C, Qian S W, Li X, Cui Z, Dang Y J, Tang Q Q. Artemisinin derivatives prevent obesity by inducing browning of WAT and enhancing BAT function. Cell Research, 2016, 26(10): 1169.
[6] Liu L, Wen W, Zhang R F, Wei Z C, Deng Y Y, Xiao J, Zhang M W. Complex enzyme hydrolysis releases antioxidative phenolics from rice bran. Food Chemistry, 2017, 214: 1-8.
[7] ZHAI X C, LIN D H, ZHAO Y, LI W W, YANG X B. Enhanced anti-obesity effects of bacterial cellulose combined with konjac glucomannan in high-fat diet-fed C57BL/6J mice. Food & Function, 2018, 9(10): 5260-5272.
[8] Liu W, Zhao S Q, Wang J Q, Shi J, Sun Y K, Wang W Q, Ning G, hONG j, Liu R X. Grape seed proanthocyanidin extract ameliorates inflammation and adiposity by modulating gut microbiota in high-fat diet mice. Molecular Nutrition & Food Research, 2017, 61(9): 1601082.
[9] 谢佳函, 刘回民, 刘美宏, 郑明珠, 徐倩, 刘景圣. 杂粮多酚功能活性研究进展. 食品工业科技, 2017, 38(14): 326-329, 335.
XIE J H, LIU H M, LIU M H, ZHENG M Z, XU Q, LIU J S. Research progress of functional activities of polyphenols in coarse cereals. Science and Technology of Food Industry, 2017, 38(14): 326-329, 335. (in Chinese)
[10] Huang D W, Chung C P, Kuo Y H, Lin Y L, Chiang W C. Identification of compounds in adlay (L. var.Stapf) seed hull extracts that inhibit lipopolysaccharide- induced inflammation in RAW 264.7 Macrophages.Journal of Agricultural & Food Chemistry, 2009, 57(22): 10651-10657.
[11] 肖杰, 王曦, 侯粲, 牛兴和, 董志忠, 应剑. 苦荞调控糖脂代谢作用及其生物学机制研究进展. 食品科学, 2019, 40(21): 343-349.
XIAO J, WANG X, HOU C, NIU X H, DONG Z Z, YING J. Recent advances in understanding the role and mechanism of action of Tartary buckwheat in regulating glucolipid metabolism. Food Science, 2019, 40(21): 343-349. (in Chinese)
[12] Song Z, Revelo X, Shao W, Tian L, Zeng K, Lei H, sun h s,Minna w,Daniel W, Jin T. Dietary curcumin intervention targets mouse white adipose tissue inflammation and brown adipose tissue UCP1 expression: Curcumin intervention targets both WAT and BAT. Obesity, 2018, 26(3): 547558.
[13] You Y L, Yuan X X, Liu X M, Liang C, Meng M H, Huang Y Y, HAN X, GUO J L, GUO Y, REN C L, ZHANG Q W, SUN X Y, MA T T, LIU G J, JIN W Z, HUANG W D, Zhan J C. Cyanidin-3-glucoside increases whole body energy metabolism by upregulating brown adipose tissue mitochondrial function. Molecular Nutrition & Food Research, 2017, 61(11): 1700261.
[14] Lagouge M, Argmann C, Gerhart-Hines Z, Meziane H, Lerin C, Daussin F, Auwerx J. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha. Cell, 2006, 127(6): 1109-1122.
[15] Seale P, Bjork B, Yang W L, Kajimura S, Chin S, Kuang S H, SCIME A, DEVARAKONDA S, CONROE H M, ERDJUMENT- BROMAGE H. PRDM16 controls a brown fat/skeletal muscle switch. Nature, 2008, 454(7207): 961-967.
[16] Waldén T B, Hansen I R, Timmons J A, Cannon B, Nedergaard J. Recruited vs. nonrecruited molecular signatures of brown, “brite,” and white adipose tissues. American Journal of Physiology Endocrinology & Metabolism, 2012, 302(1): E19-E31.
[17] Yao Y L, Xu F R, Ju X R, Li Z F, Wang L f. Lipid-lowering effects and intestinal transport of polyphenol extract from digested buckwheat in Caco-2/HepG2 coculture models. Journal of Agricultural and Food Chemistry, 2020, 68(14): 4205-4214.
[18] Waterman C, Rojas-Silva P, Tumer T B, Kuhn P, Richard A J, Wicks S, STEPHENS J M, WANG Z, MYNATT R, CEFALU W, Raskin I. Isothiocyanate-richextract reduces weight gain, insulin resistance, and hepatic gluconeogenesis in mice. Molecular Nutrition & Food Research, 2015, 59(6): 1013-1024.
[19] Wang J Q, Liu R X, Wang F, Hong J, Li X Y, Chen M P, YE Y Y, ZHANG X F, MA Q Y, WANG R, SHI J, CUI B, GU W Q, ZHANG Y F, ZHANG Z G, WANG W Q, XIA X F, LIU M Y, Ning G. Ablation of LGR4 promotes energy expenditure by driving white-to-brown fat switch. Nature Cell Biology, 2013, 15(12): 1455-1463.
[20] Buettner R, Schölmerich J, Bollheimer L C. High-fat diets: Modeling the metabolic disorders of human obesity in rodents. Obesity, 2007, 15(4): 798-808.
[21] Singh B N, Shankar S, Srivastava R K. Green tea catechin, epigallocatechin-3-gallate (EGCG): Mechanisms, perspectives and clinical applications. Biochemical Pharmacology, 2011, 82(12): 1807-1821.
[22] Murphy E F, Cotter P D, Hogan A, OSullivan O, Joyce A, Fouhy F, Shanahan F. Divergent metabolic outcomes arising from targeted manipulation of the gut microbiota in diet-induced obesity. Gut Microbes, 2013, 62(1): 220-226.
[23] Loomba R, Sanyal A J. The global NAFLD epidemic. Nature Reviews Gastroenterology & Hepatology, 2013, 10(11): 686-690.
[24] Feng X J, Yu W, Li X D, Zhou F F, Zhang W L, Shen Q, LI J X, ZHANG C, Shen P P. Apigenin, a modulator of PPARγ, attenuates HFD-induced NAFLD by regulating hepatocyte lipid metabolism and oxidative stress via Nrf2 activation. Biochemical Pharmacology, 2017, 136: 136-149.
[25] Qu L L, Liu Q Q, Zhang Q, Tuo X X, Fan D D, Deng J J,Yang H X. Kiwifruit seed oil prevents obesity by regulating inflammation, thermogenesis, and gut microbiota in high-fat diet- induced obese C57BL/6 mice. Food and Chemical Toxicology, 2019, 125: 85-94.
[26] SUDIRMAN S, CHANG H W, CHEN C K, KONG Z L. A dietary polysaccharide fromdownregulates proinflammatory cytokines and ameliorates osteoarthritis-associated cartilage degradation in obese rats. Food & Function, 2019, 10(9): 5697-5706.
[27] Wang J J, Tang H, Zhang C H, Zhao Y F, Derrien M, Rocher E, VAN-HYLCKAMA VLIEG J E T, STRISSEL K, ZHAO L P, OBIN M, Shen J. Modulation of gut microbiota during probiotic-mediated attenuation of metabolic syndrome in high fat diet-fed mice. The ISME Journal, 2015, 9: 1-15.
[28] PORTER C, HERNDON D N, CHONDRONIKOLA M, CHAO T, ANNAMALAI P, BHATTARAI N, SARAF M K, CAPEK K D, REIDY P, DAQUIANG A C, KOLONIN M G, RASMUSSEN B B, BORSHEIM E, KINSKY T T, SIDOSSIS L S. Human and mouse brown adipose tissue mitochondria have comparable UCP1 function. Cell Metabolism, 2016, 24(2): 246-255.
Lipid-Lowering Effects and Its Regulation Mechanism of Buckwheat Polyphenols in High-Fat Diet-Induced Obese Mice
YAO YiJun, JU XingRong, WANG LiFeng
College of Food Science and Engineering, Nanjing University of Finance and Economics/Collaborative Innovation Center for Modern Grain Circulation and Safety, Nanjing 210023
【Background】At present, relevant animal experiments have confirmed that buckwheat had a good intervention effect on obesity and lipid metabolism disorder caused by high-fat diet. At the same time, studies have shown that the adaptive thermogenesis of brown fat could effectively improve the body’s energy metabolism. Therefore, increasing the activity of brown fat and promoting the browning of white fat could be used as an effective way to prevent obesity and improve energy metabolism diseases.【Objective】The raw buckwheat and four kinds of main polyphenols identified from buckwheat were prepared according to the content proportion to study the lipid-lowering effects of buckwheat polyphenols in high-fat diet-induced obese mice via browning of white adipocytes.【Method】Phenolic compounds in buckwheat polyphenol extract were identified by UHPLC-Q-Orbitrap mass spectrometry combined with database. And the main polyphenol compound was prepared according to the content proportion in the raw buckwheat. In order to explore the regulating effects of buckwheat on body weight, organ index and blood lipid level in C57BL/6J mice, the dietary intervention was carried out with 10%, 20% and 40% proportion of buckwheat to replace basic feed and the 2.5 mg∙mL-1of mixture buckwheat polyphenol standard substance. Last but not least, Western-blot and q-PCR were used to investigate the effects of buckwheat feed and polyphenol intervention on the expression of heat-producing proteins and genes in white and brown fat in mouse subcutaneous adipose tissue.【Result】Twenty phenolic compounds in buckwheat polyphenol extract were identified by UHPLC-Q-Orbitrap mass spectrometry, and the content of four phenolic compounds with the highest content (hydroxycinnamic acid, quercetin,scoparone, and rutin) accounted for more than 80% of the total phenolic compounds, which were the main polyphenols in buckwheat. The results showed that after 39 d in the diet intervention, compared with high-fat diet group, adding buckwheat feed and buckwheat polyphenol intervention on body weight in mice, the liver index and serum triglyceride (TG), total cholesterol (T-CHO), low-density lipoprotein cholesterol (LDL-c), aspartate aminotransferase (ALT) and third transaminase (AST) increased significantly inhibitory effect; with the increase of amount of buckwheat, the inhibition increased. At the same time, adding buckwheat feed and buckwheat polyphenol could protect and improve the decrease of renal index and HDL-c in mice. It was also the high dose 40% buckwheat and polyphenol group that had the best effect, which showed that phenolic substances played a major role in the improvement of abnormal lipid metabolism in high-fat diet-induced obese mice. UCP1, PRDM-16, and PGC-1α protein and gene expression levels were significantly decreased in the high-fat diet group compared with the normal diet group, while Tcf21 and HOXC8 expression levels were significantly increased (<0.05). After dietary intervention, protein expression levels of UCP1, PRDM-16 and PGC-1αin the buckwheat intervention group were significantly up-regulated, while protein expression levels of Tcf21 and HOXC8 were significantly decreased (<0.05). In addition, the 40% buckwheat and polyphenol intervention group significantly increased the expression of,andgenes in mouse visceral adipose tissue (<0.05), and which down-regulated the expressions ofandgenes.【Conclusion】Buckwheat intervention could effectively improve the lipid metabolism disorder in high-fat diet-induced obese mice, and it was confirmed that buckwheat polyphenols played a major role. The mechanism was mainly buckwheat polyphenols could significantly improve the thermogenic activity of brown fat, reduce the content of white fat, and regulate the energy metabolism balance. This study provided a new idea and theoretical basis for the utilization of buckwheat and the development of functional foods about lipid-lowering products.
buckwheat; polyphenols; high-fat diet-induced mice; lipid-lowering effects; browning of white adipocytes

10.3864/j.issn.0578-1752.2023.05.013
2022-04-26;
2022-11-25
国家重点研发计划(2021YFD2100904)、国家自然科学基金面上项目(32172147)、江苏省现代农业产业技术体系建设项目(JATS [2021]522)、江苏省现代农业重点项目(BE2022317)
姚轶俊,E-mail:yyj@nufe.edu.cn。通信作者王立峰,E-mail:wanglifeng_8@nufe.edu.cn
(责任编辑 赵伶俐)
猜你喜欢棕色荞麦高脂红山荞麦看木森今日农业(2022年13期)2022-09-15我国科学家发现荞麦属新种今日农业(2021年3期)2021-12-05又香又甜的棕色方块科普童话·学霸日记(2021年6期)2021-09-05高脂血标本对临床检验项目的干扰及消除对策中华养生保健(2020年5期)2020-11-16荞麦小小说月刊(2018年12期)2018-12-13荞麦花开黄河·黄土·黄种人(华夏文明)(2017年3期)2017-08-22无论什么颜色和棕色米娜·女性大世界(2016年8期)2016-08-17运动降低MG53表达及其在缓解高脂膳食大鼠IR中的作用中国运动医学杂志(2016年3期)2016-07-10高脂饮食诱导大鼠生精功能障碍医学研究杂志(2015年12期)2015-06-10味精与高脂日粮对生长猪胴体性状与组成的影响食品工业科技(2014年5期)2014-03-11推荐访问:小鼠 荞麦 膳食推荐文章
- [高考励志:倒计时冲刺语录] 高考倒计时励志语录
- 2018江苏高考成绩查询入口,点击进入:江苏高考2018成绩查询
- [英语阅读:细数英语中那些出口的汉语]带汉语的英语阅读视频
- 双语阅读:英文吐槽“变凉”的天气_喜剧中心吐槽大会2018
- 2018年福建高考成绩查询网址:http://www.eeafj.cn/:2018福建二建成绩查询
- 小学五年级下册语文阅读理解练习题五道_5年级下册语文书人教版
- 河北教育考试院2018高考查分_福建教育考试院网2018年高考查分系统
- 2018年山西省拟录用公务员公示 [2018年浙江瑞安市各级机关公务员拟录用人员公示(五)]
- 好舌头绕口令 [英语绕口令:挑战你的舌头]
- [2018福建高考成绩什么时候可以查询] 2018中级会计成绩查询