HDAC5对成牙本质细胞增殖和分化影响的研究
来源:优秀文章 发布时间:2023-04-10 点击:
白玉 柳鑫 程小刚 郭倩 何文喜 余擎
当龋病突破牙釉质进展到牙本质层时,微生物增殖和代谢活动产生的细菌会沿着牙本质小管向外周牙髓扩散,牙本质脱矿也可能使基质中的活性分子释放。成牙本质细胞会识别这些细菌产物以及分子触发一系列宿主保护事件,包括抗菌、免疫炎症反应[1]及分泌形成修复性牙本质[2],从而阻止发展为不可逆的牙髓炎症。当炎症发展迅速或加重时会通过多种机制损害成牙本质细胞的功能[3],因此牙髓牙本质修复是炎症反应和修复反应之间的一种平衡,这一过程受多种分子信号共同调控[4-5],了解这些分子功能有助于优化牙髓的保存治疗。组蛋白去乙酰化酶(histone deacetylases,HDACs)是表观遗传学中的重要调控因子,可以调节组蛋白及非组蛋白的乙酰化修饰,参与免疫调节、炎症反应和组织再生过程[5]。本课题组前期及其它学者已证实泛HDAC抑制剂可促进牙髓干细胞的分化[6-7],说明HDACs参与调控了牙本质形成的过程。HDAC5是一种Ⅱ类HDAC,已证实其在免疫反应以及成骨过程中有重要的调节作用[8],但HDAC5在牙髓牙本质炎症及再生过程中的功能还未见相关研究。本实验拟通过观察HDAC5在不同牙髓组织中的表达变化,体外建立过表达HDAC5的成牙本质细胞系,初步探讨HDAC5在牙髓炎中的表达以及对成牙本质细胞功能的影响,为临床治疗提供新的靶点和思路。
本实验涉及人牙实验已由空军军医大学第三附属医院伦理委员会审批(批号:
IRB-REV-2019018)。
1.1 实验主要试剂
α-MEM培养基(C12571500BT)、胎牛血清(10270-106)(Gibco,美国);
RIPA裂解液(P0013B)、蛋白酶抑制剂(P1005)、Western blot封闭液及抗体稀释液(P0239)、免疫染色封闭液(P0260)、免疫染色一抗稀释液(P0239)、免疫荧光染色试剂盒-抗鼠Alexa Fluor(P0191)、碱性磷酸酶检测试剂盒(P0321S)、BCIP/NBT碱性磷酸酯酶显色试剂盒(C3206)(上海碧云天生物技术有限公司);
茜素红染液(G1038)、苏木素染液(G1004)(武汉赛维尔生物科技有限公司);
Western blot凝胶配制套装(1610172)、电泳液(1610732 )、转膜液(10026938)(Bio-Rad,美国);CCK-8(CK04,同仁,日本);
慢病毒载体(上海吉凯基因科技有限公司);
反转录试剂盒(G490)、实时定量PCR试剂盒(G895)(ABM,加拿大);
BSP(5468)、COL1α(7206)、Runx2抗体(12556)(CST,美国);
HDAC5(sc-133225)、DSPP(sc-73632)、OCN抗体(sc-390877)(Santa,美国);
DMP-1抗体(NBP1-45525,Novus,美国);
GAPDH(60004,Proteintech,美国);
HRP山羊抗小鼠IgG(33201ES60)、HRP山羊抗兔IgG(33101ES60)(上海翌圣生物科技有限公司)。成牙本质细胞系(OLCs)由日本秋田大学Arany教授馈赠。
1.2 离体牙HE染色和免疫荧光染色
经患者知情同意收集颌面外科因治疗需要拔除的第三磨牙,分为健康组(无牙体牙周疾病)及牙髓炎组(组织染色结合临床诊断),立即用涡轮机磨除釉质及根尖三分之一,4%多聚甲醛固定48 h,17%EDTA脱钙液脱矿2 个月,常规脱水浸蜡包埋切片,HE染色,免疫荧光染色观察HDAC5在牙髓炎及健康牙髓组织中的表达变化。
1.3 建立HDAC5过表达OLCs
OLCs培养于含10%血清的培养基中。设置含空载体的阴性对照组,过表达HDAC5慢病毒转染组,按照吉凯公司慢病毒使用手册进行转染实验。48 h后荧光显微镜下观察细胞转染情况,TRIzol提取RNA进行qRT-PCR检测HDAC5 mRNA表达情况,72 h后提取蛋白Western blot检测HDAC5蛋白表达情况,均选择GAPDH为内参。
引物序列如表 1。
1.4 细胞增殖实验
将各组细胞按照1×103个/孔种于96 孔版中,分别于1、 3、5和7 d在固定时间加入含10% CCK8的培养基,37 ℃孵育2 h,酶标仪450 nm波长检测各孔吸光度值,取平均值绘制生长曲线。
1.5 成牙/成骨能力检测
1.5.1 ALP染色及活性检测 矿化诱导7 d后,根据说明书进行ALP染色及活性检测。
1.5.2 茜素红染色 矿化诱导14 d后固定细胞后茜素红染色15 min,拍照后每孔加入1 mL 10%氯化十六烷基吡啶,完全脱色后酶标仪562 nm波长检测脱色液吸光度值。
1.5.3 Western blot 矿化诱导14 d后RIPA裂解液提取蛋白,BCA法检测蛋白浓度,蛋白变性后按照20 μg每泳道上样进行电泳、转膜、封闭,加入COL1α、DSPP、Runx2、OCN、BSP、DMP-1和GAPDH抗体4 ℃孵育过夜,加入二抗室温孵育1 h,滴加ECL发光液成像仪采集印记结果,Image J软件测算灰度值。
1.6 统计学分析
实验数据结果统计学分析及作图使用GraphPad Prism 8软件,统计学方式为配对t检验,当P<0.05时,差异有统计学意义。
2.1 HDAC5在牙髓组织中的表达
HE染色可见正常牙髓组织结构完整,成牙本质细胞层排列整齐(图 1A), HDAC5(红色荧光)在正常牙髓组织仅在髓核血管位置阳性表达(图 1B)。牙髓炎标本的牙髓组织HE染色可见血管增多,炎性细胞增多牙髓细胞减少,成牙本质细胞体积缩小(图 1C),其免疫荧光染色显示HDAC5表达增多,并在成牙本质细胞层可见HDAC5的表达(图 1D,白色箭头指向成牙本质细胞层)。

图 1 HDAC5在牙髓组织中的表达情况
2.2 HDAC5过表达慢病毒转染效率
慢病毒转染48 h后,倒置显微镜下观察可见两组细胞形态均为梭形并无明显差异,各组均观察到绿色荧光染色阳性细胞(图 2A),qRT-PCR和Western blot结果表明,与NC组相比,过表达组细胞中HDAC5的mRNA表达(P<0.000 1)和蛋白水平(P<0.000 1)均明显上升(图 2B~2C)。

图 2 慢病毒转染后OLCs中HDAC5的表达
2.3 HDAC5抑制细胞增殖
CCK8结果表明,在第1天两组之间增殖能力无明显差异(P=0.977 5),而第3、5及7天(P<0.000 1),HDAC5过表达组细胞增殖活性受到抑制(图 3)。
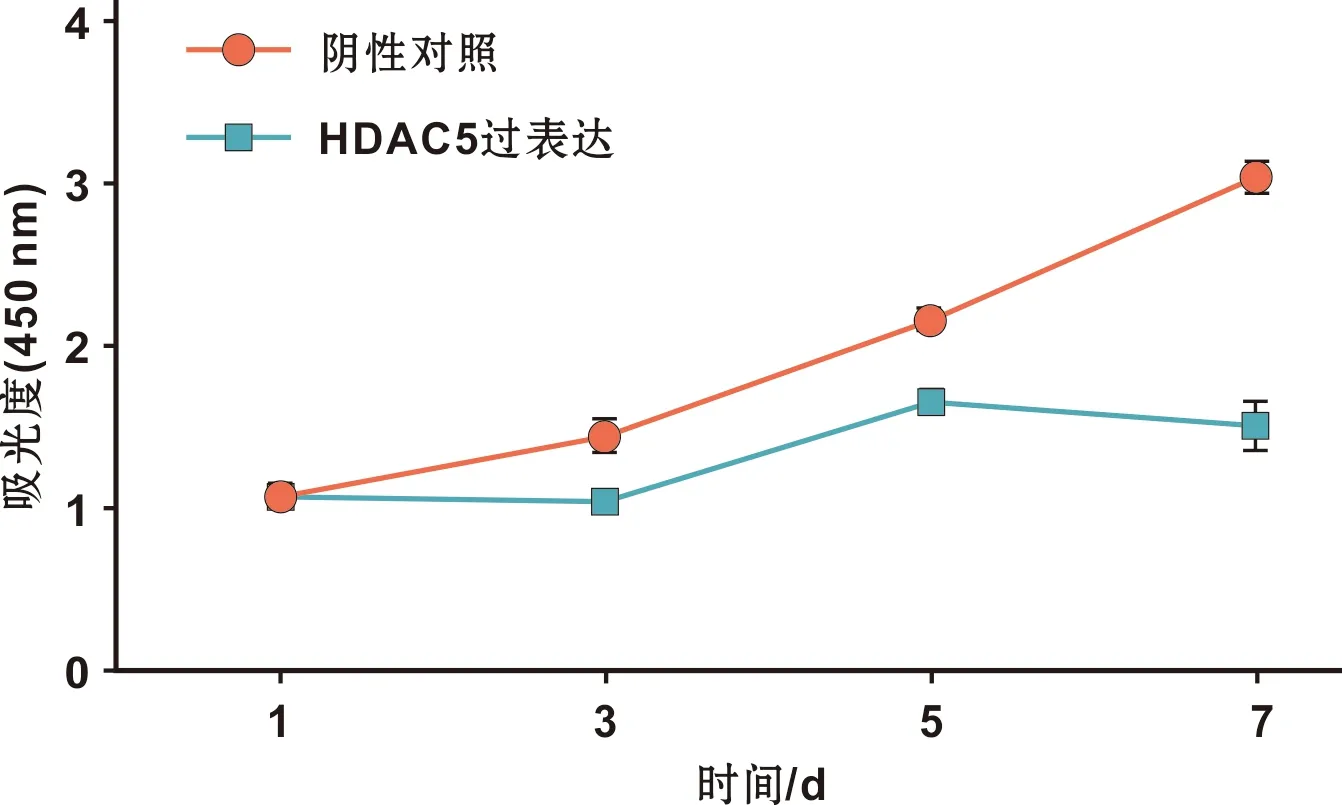
图 3 HDAC5对OLCs增殖的影响
2.4 HDAC5抑制OLCs成牙/成骨分化
ALP染色和活性检测结果(图 4A)及茜素红染色结果(图 4B)可见,与NC组相比,过表达HDAC5组早期和晚期成骨/成牙分化均受到抑制,矿化结节形成减少(P<0.001)。

图 4 HDAC5对OLCs矿化能力的影响
同时, Western blot实验结果可见HDAC5过表达组的COL1α,DSPP,Runx2,OCN,BSP,DMP-1蛋白表达均降低(P<0.05)(图 5),进一步验证了HDAC5对OLCs成牙/成骨分化的抑制作用。
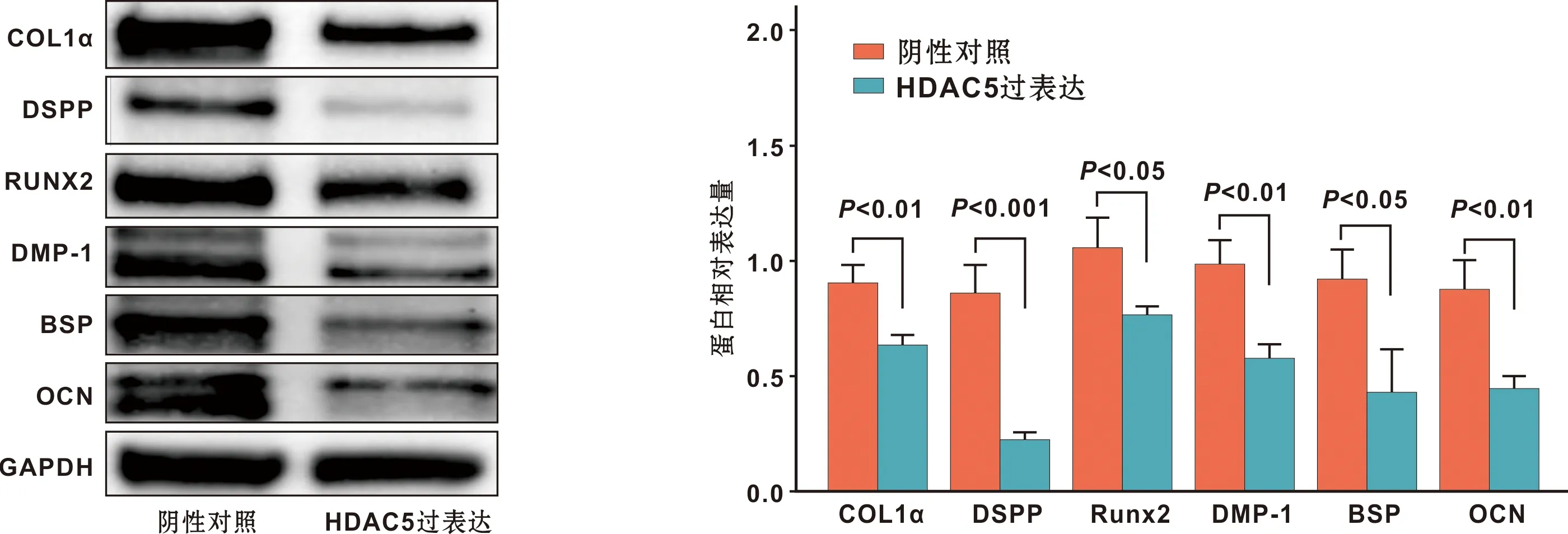
图 5 HDAC5对OLCs成牙/成骨相关蛋白表的影响
龋病是牙体牙髓疾病最常见的病因,在龋病发展过程中,细菌及他们的代谢产物以及牙本质基质中分解的活性分子与牙髓中的细胞发挥相互作用,参与这一过程[9]。在进展相对缓慢的病程中,这些分子会诱导牙本质再生反应,相反的,在进展迅速或感染未阻断的损伤下,细胞和分子作用会引起更强烈的免疫炎症反应,导致牙髓组织的坏死[10],而如果在疾病发展过程中给予适当的干涉,可能会促进再生反应自然发生,也是临床活髓保存术及再生根管治疗的生理学基础。炎症和再生这两个过程之间的平衡受到了复杂的信号网络调控,了解这其中的生物分子是如何调控细胞行为,有助于掌握临床再生治疗的局限性和设计改进治疗方法。
目前已有很多研究阐明了分子信号通路在牙髓牙本质再生中的作用[11],但最近越来越多的研究发现表观遗传学在炎症及组织修复中也起到了关键作用[12]。翻译后修饰(PTMs)是其中的一种调控方式,包括了磷酸化、糖基化、甲基化、乙酰化、泛素化和类泛素化等[13]。其中乙酰化的发生主要是通过HDACs和组蛋白乙酰基转移酶,他们根据细胞需要改变染色质结构,调节转录过程发挥重要功能[14]。现已发现组织中有18种HDAC酶存在,但其在牙髓炎症及损伤修复中的表达和作用尚不清楚。在本研究中,首先通过免疫荧光染色发现与健康牙髓组织相比,HDAC5在牙髓炎标本中表达增强,尤其在成牙本质细胞层出现阳性表达,但高表达的HDAC5究竟对成牙本质细胞有什么作用还不清楚。
为了进一步确定HDAC5对成牙本质细胞的影响,利用通过慢病毒转染技术,成功建立了HDAC5过表达OLCs的细胞模型,在此基础上研究HDAC5的调控功能。发现HDAC5过表达抑制OLCs的增殖,ALP染色活性及茜素红结果显示过表达HDAC5的OLCs成骨能力和矿化结节形成能力受到抑制。为进一步验证HDAC5对OLCs分化的影响,通过Western blot实验观察了成牙/成骨分化相关蛋白的表达,结果可见,无论是早期分化相关蛋白COL1α、Runx2、BSP和DMP-1,还是晚期基质矿化相关蛋白DSPP、OCN的表达均受到了抑制,说明了HDAC5在OLCs分化过程中起负调控作用。
通过的实验以及文献报道可以推测组蛋白去乙酰化酶是骨、牙周膜和牙髓矿化过程中的重要调节因子点[15-16],但其作用机制还未明确。HDACs除对组蛋白修饰还可以通过对非组蛋白(如转录因子)去乙酰化修饰调控转录活性[17],有学者发现HDAC4和HDAC5可以结合Runx2抑制其启动OCN的转录进而抑制成骨细胞分化[18],为下一步研究HDAC5对OLCs的调控机制提供思路。
由于组蛋白修饰高度不稳定可以被干预,随着特异性HDAC抑制剂的发展,HDACs将会是临床治疗中容易控制的治疗靶点[19]。综上所述,本研究发现牙髓炎中HDAC5的表达增强,同时通过过表达HDAC5证实其对OLCs增殖及分化有抑制作用,未来还需进一步研究如何调控HDACs促进牙本质修复再生。
猜你喜欢 乙酰化牙本质成骨 抑癌蛋白p53乙酰化修饰的调控网络中国生物化学与分子生物学报(2022年8期)2022-09-08激光联合脱敏剂治疗牙本质过敏症中国典型病例大全(2022年11期)2022-05-13经典Wnt信号通路与牙周膜干细胞成骨分化口腔医学(2021年10期)2021-12-02糖尿病大鼠Nfic与成骨相关基因表达的研究中华老年口腔医学杂志(2016年2期)2017-01-15Single Bond Universal牙本质粘结强度及牙本质保护作用的实验研究中国美容医学(2017年2期)2017-01-10慢性支气管哮喘小鼠肺组织中组蛋白H3乙酰化修饰增强中国组织化学与细胞化学杂志(2016年4期)2016-02-27液晶/聚氨酯复合基底影响rBMSCs成骨分化的研究中国病理生理杂志(2015年8期)2015-12-2130例Ⅰ型成骨不全患者股骨干骨折术后康复护理天津护理(2015年4期)2015-11-10组蛋白去乙酰化酶抑制剂的研究进展中国当代医药(2015年16期)2015-03-01Nd:YAG激光作用下牙本质脱敏机制的研究西安交通大学学报(医学版)(2015年2期)2015-02-28推荐访问:增殖 分化 细胞