化学-酶法串联一锅合成R-γ-氨基酸
来源:优秀文章 发布时间:2023-03-27 点击:
杨 鹏,程 熹,吴星均,朱虹旭,刘雪粉,杨华云,许 可
(1. 杭州师范大学钱江学院,浙江 杭州 310036;
2. 浙江省天正设计工程有限公司,浙江 杭州 310030)
γ-氨基酸是哺乳动物中枢神经系统中一类具有重要生理作用的神经递质抑制剂,它的缺失会导致亨廷顿病、帕金森病及癫痫等多种神经性疾病[1].随着非天然氨基酸领域研究的不断深入,手性γ-氨基酸在多肽合成、纳米材料及生物医药等领域也呈现出许多独特的性能.例如,手性γ-氨基酸被广泛用于α, β-和β, γ-混合多肽二级结构修饰及自组装环肽纳米管等领域[2];
一些抗痉挛药物如喜宝宁、巴氯芬等的活性成分主要为γ-氨基丁酸类似物.因此,新型手性γ-氨基酸合成将是手性化合物合成领域的重要研究方向.
手性非天然氨基酸领域的研究工作主要集中在手性α-非天然氨基酸的合成上.迄今为止,有机化学家们开发了一系列合成手性α-氨基酸的方法,如:α-亚胺酯的不对称加成反应、α-烯胺及亚胺酯不对称氢化、α-酮酸及其派生物的不对称还原胺化、亚胺的不对称环加成反应等[3-4].近年来,随着手性γ-氨基酸在生物医药和材料化工等领域显示出的巨大应用前景,其合成方法也逐渐得到重视,多位学者相继开发出了一系列手性γ-氨基酸的合成方法[5-7].但现有合成方法通常需要昂贵的手性催化剂,反应历程比较复杂,且往往只能得到一种构型的手性γ-氨基酸.因此,开发手性γ-氨基酸的简易高效合成方法并实现其立体构型调控对拓展非天然氨基酸应用范围具有重大的科学价值.
酶促动态动力学拆分(dynamic kinetic resolution,DKR)是一种绿色高效、低毒环保的制备手性小分子的有效途径,国内外研究者通过酶促拆分制备了多种具有重要生物活性的手性仲醇或仲胺[7-12].虽然酶促拆分具有种种优点,但是其底物谱较窄,一般只能用于制备一些结构比较简单的仲醇与仲胺.本文报道了一种手性γ-氨基酸合成策略.该方法以烯丙基胺作为起始底物,在脂肪酶催化下利用酯化动态动力学拆分反应得到光学纯的烯丙基酰胺,烯丙基酰胺再与α, β-不饱和酸发生烯烃复分解反应制得相应的手性γ-氨基酸,从而实现手性γ-氨基酸立体构型可调控生物合成的目的.该策略充分利用了酶促动态动力学拆分绿色、高效、高度专一性等优点,可以在温和的反应条件下得到光学纯度高的烯丙基酰胺,且反应历程简单,通过一锅反应就可以获得单一构型手性γ-氨基酸衍生物.
1.1 试剂与仪器
1-苯基烯丙基胺、1-(4-溴)苯基烯丙基胺、1-(4-氯)苯基烯丙基胺、1-(4-甲基)苯基烯丙基胺和1-(4-甲氧基)苯基烯丙基胺,一代和二代Grubbs试剂,钯(Pd)、镍(Ni)、钴(Co)等过渡金属,PS-IM脂肪酶,乙酸乙酯,乙酸苯酚酯,乙酸乙烯酯,乙酸对氯苯酚酯及其他必要的化学试剂.
化合物的核磁共振氢谱(1H-NMR)采用Bruker Advance DMX 400 MHz 型核磁共振仪测定,其中四甲基硅烷(TMS)作为内标.
手性γ-氨基酸的对映体过量值(e.e.)采用手性液相色谱仪测定.检测条件为:手性色谱柱为大赛璐AD-H,流动相为正己烷/异丙醇=90/10,流速0.1 mL/min,检测波长254 nm.
1.2 实验过程
1.2.1 酶促动态动力学拆分合成手性烯丙基酰胺
在干燥的Schlenck管中加入Pd催化剂 (摩尔分数5.0%)、Na2CO3(5 mmol)和固定化脂肪酶(质量分数10%).用针状注射器注入除水甲苯(10 mL),50 ℃搅拌5 min,注入5 mmol 烯丙基胺 (溶于10 mL除水甲苯).5 min后,加入15 mmol 酰化试剂(溶于20 mL除水甲苯),50 ℃下搅拌24 h后检测.TLC 检测显示原料完全转化,过滤,脱溶剂,得手性烯丙基酰胺粗产物.粗产物经柱色谱纯化(流动相V石油醚∶V乙酸乙酯=2∶1).手性液相色谱测定产物e.e.值.
1.2.2 烯烃复分解反应合成手性γ-氨基酸
50 mL三颈烧瓶中将取代-烯丙基胺(0.1 mmol)、酰化试剂(0.3 mmol)溶解到5.0 mL无水甲苯中,加入Pd催化剂(摩尔分数5%)、脂肪酶(质量分数20%),50 ℃下反应48 h.再加入丙烯酸甲酯(0.11 mmol),第二代Grubbs催化剂(质量分数10%),加热回流48 h.反应结束后过滤,脱溶得粗产物.粗产物经柱色谱纯化(流动相V石油醚∶V乙酸乙酯=3∶1),得手性γ-氨基酸.
R-4-苯基-4-乙酰氨基-2-乙烯-丁酸甲酯:1H NMR(400 MHz, CDCl3) δ 7.31~7.20(m,5H),6.80~6.76(m,1H),5.87~5.84(m,1H),5.11~5.09(m,1H),3.71(s,3H),1.96(s,3H)ppm.e.e.值95%.
R-4-(4-溴-苯基)-4-乙酰氨基-2-乙烯-丁酸甲酯:1H NMR(400 MHz, CDCl3) δ 7.31~7.20(m,4H),6.80~6.76(m,1H),5.87~5.84(m,1H),5.11~5.09(m,1H),3.71(s,3H),1.96(s,3H)ppm.e.e.值93%.
R-4-(4-氯-苯基)-4-乙酰氨基-2-乙烯-丁酸甲酯:1H NMR(400 MHz, CDCl3) δ 7.31~7.20(m,4H),6.80~6.76(m,1H),5.87~5.84(m,1H),5.11~5.09(m,1H),3.71(s,3H),1.96(s,3H)ppm.e.e.值90%.
R-4-(4-甲基-苯基)-4-乙酰氨基-2-乙烯-丁酸甲酯:1H NMR(400 MHz, CDCl3) δ 7.31~7.20(m,4H),6.80~6.76(m,1H),5.87~5.84(m,1H),5.11~5.09(m,1H),3.71(s,3H),2.20(s,3H),1.96(s,3H)ppm.e.e.值94%.
R-4-(4-甲氧基-苯基)-4-乙酰氨基-2-乙烯-丁酸甲酯:1H NMR(400 MHz, CDCl3) δ 7.31~7.20 (m,4H),6.80~6.76(m,1H),5.87~5.84(m,1H),5.11~5.09(m,1H),3.81(s,3H),3.71(s,3H),1.96(s,3H)ppm.e.e.值90%.
2.1 酶促动态动力学拆分手性烯丙基酰胺
酶促反应最大的优点在于其高度立体专一性,源自不同菌属和种类的酶通常会呈现出不同的催化活性及立体选择性.脂肪酶PS-IM已被证明是催化仲醇或仲胺酯化拆分反应最为有效的酶催化剂.有鉴于此,本文采用野生型PS-IM催化的1-苯基烯丙基胺的动态动力学拆分作为模板反应.表1中序号1—4分别为1-苯基烯丙基胺在PS-IM催化下与不同酰化试剂的动态动力学拆分结果,其中乙酸乙酯的拆分结果最佳,其e.e.值可以达到92%,同时转化率达到80%.

表1 酰化试剂和外消旋化试剂对拆分结果的影响Tab.1 DKR with different acyl and racemic reagents

序号RCat.e.e./%产率/%a1-乙烯基Pd/C20822-乙基Pd/C92803-苯基Pd/C83754-4-氯苯基Pd/C64725-乙基Pd/BaSO496936-乙基雷尼镍90327-乙基雷尼钴9325

表2 烯丙基胺动态动力学拆分底物扩展Tab.2 DKR substrate scope of allylamine

序号Re.e./%产率/%1-苯基96932-(4-溴)苯基95963-(4-氯)苯基92934-(4-甲基)苯基93925-(4-甲氧基)苯基9290
除了酶催化剂之外,外消旋化试剂也是影响酶促动态动力学拆分的重要因素.常见的仲胺酶促动态动力学拆分反应外消旋化试剂包括Pd、Ni、Co等过渡金属.在确定最佳酰化试剂后,对这些常用的外消旋化试剂进行了考察,表1结果(序号5—7)显示,以Pd/BaSO4的催化结果最佳,其产率可以达到93%.综上,后续反应采用乙酸乙酯作为酰化试剂,Pd/BaSO4作为外消旋化试剂.
基于最佳拆分条件继续考察底物的适用范围,分别选取1-苯基烯丙基胺、1-(4-溴)苯基烯丙基胺、1-(4-氯)苯基烯丙基胺、1-(4-甲基)苯基烯丙基胺和1-(4-甲氧基)苯基烯丙基胺5种不同底物的酶催化动态动力学拆分反应.从表2可以看出,该拆分条件对5种底物均呈现出较佳的拆分结果,其中1-(4-溴)苯基烯丙基胺的拆分效果最佳,其e.e.值和产率分别达到95%和96%;
而1-(4-甲氧基)苯基烯丙基胺的拆分结果最差,e.e.值和产率分别为92%和90%,原因可能是苯环上取代基为吸电子基的底物的拆分效果要优于给电子取代基底物.
2.2 化学-酶法串联一锅合成手性γ-氨基酸
烯烃复分解反应是增长碳链的重要反应之一.20世纪70年代初期,Chauvin提出的烯烃与金属卡宾通过[2+2]环加成形成金属杂环丁烷中间体的相互转化过程,是当时被广泛认同的反应机制;
1992年Nguyen等[13]发现了钌卡宾络合物,并成功应用于降冰片烯的开环聚合反应.该催化剂克服了钛、钨等催化剂对功能基团容许范围小的缺点,并且对空气稳定,甚至在水、醇或酸的存在下,仍然可以保持催化活性.在成功实现手性取代烯丙基胺的动态动力学拆分后,本文继续探讨利用烯烃复分解反应与酶促动态动力学拆分相结合串联一锅制备手性γ-氨基酸的可能性.

表3 烯烃复分解反应条件优化及底物扩展Tab.3 Optimization and substrate scope of cross metathesis reaction

序号R溶剂 Cat.e.e./% 产率/%1-苯基乙酸乙酯一代86452-苯基甲苯一代93753-苯基二氯甲烷一代35834-苯基甲苯二代9587
本文采用1-苯基烯丙基胺的酶促动态动力学拆分-烯烃复分解串联反应作为模板反应,结果如表3(序号1)所示.在模板反应中,笔者采用前一步拆分的酰化试剂乙酸乙酯作为后续反应的溶剂,结果烯烃复分解反应转化率较低,只有45%,导致整体收率不高.为此,对溶剂和烯烃复分解反应的催化剂进行了进一步考察(表3序号2—4),发现当溶剂为甲苯、催化剂为二代Grubbs催化剂时效果最佳,所得R-γ-氨基酸e.e.值和产率分别达到95%和87%.因此,后续底物谱扩展中将采用甲苯/Grubbs 2nd体系作为最佳反应体系.
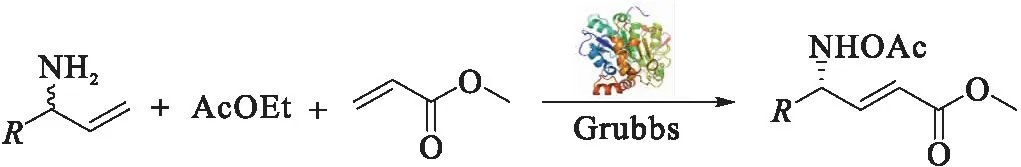
表4 化学-酶法串联一锅合成R-γ-氨基酸Tab.4 Chemo-enzymatic synthesis of R-γ-amino acid in one pot
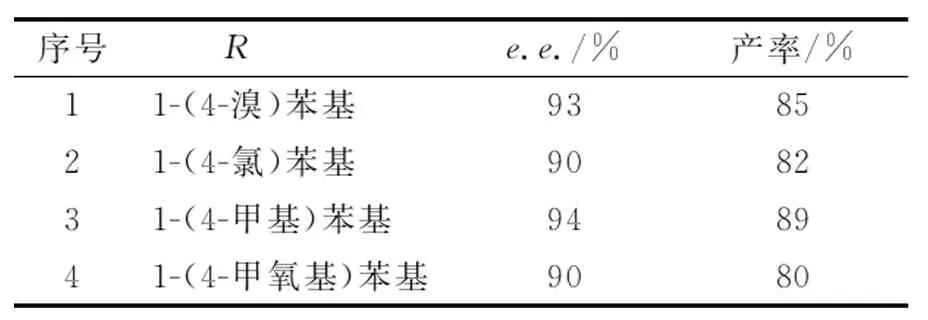
序号 Re.e./%产率/%11-(4-溴)苯基938521-(4-氯)苯基908231-(4-甲基)苯基948941-(4-甲氧基)苯基9080
在最佳反应体系下,分别考察了1-苯基烯丙基胺、1-(4-溴)苯基烯丙基胺、1-(4-氯)苯基烯丙基胺、1-(4-甲基)苯基烯丙基胺和1-(4-甲氧基)苯基烯丙基胺为起始原料的化学-酶法串联一锅合成R-γ-氨基酸过程,结果如表4所示.可以看出,采用该方法所制备的R-γ-氨基酸e.e.值均可以保持在90%以上,其中以1-苯基烯丙基胺得到的e.e.值最佳,达95%;
而以1-(4-甲基)苯基烯丙基胺为起始原料,其最终产率达到89%,e.e.值为94%.
本文报道了一种手性γ-氨基酸的化学-酶法一锅串联合成方法,采用烯丙基胺为起始原料,利用烯丙基胺末端烯烃的反应活性与丙烯酸甲酯发生烯烃复分解反应,从而实现碳链增长获得手性γ-氨基酸的目的.通过该方法制备的手性γ-氨基酸的e.e.值均在90%以上,产率也高于80%.鉴于该方法利用了酶促动态动力学拆分在制备手性仲胺中的优势,也具有烯烃复分解在碳链增长方面的优点,因此对推动手性非天然氨基酸领域的合成研究有一定的作用.
猜你喜欢 烯丙基手性苯基 酿酒酵母发酵制备蒜氨酸的工艺研究中国调味品(2022年12期)2022-12-05手性磷酰胺类化合物不对称催化合成α-芳基丙醇类化合物分子催化(2022年1期)2022-11-02手性碳量子点的研究进展*功能材料(2022年5期)2022-06-02烯丙基腰果酚单体光固化反应特性研究林产化学与工业(2021年2期)2021-05-11手性分子合成效率提至新高度山西化工(2020年2期)2020-02-161-[(2-甲氧基-4-乙氧基)-苯基]-3-(3-(4-氧香豆素基)苯基)硫脲的合成农药科学与管理(2019年8期)2019-11-23加成固化型烯丙基线形酚醛树脂研究中国塑料(2015年1期)2015-10-142-羧乙基苯基次膦酸的胺化处理及其在尼龙6中的阻燃应用浙江理工大学学报(自然科学版)(2015年7期)2015-03-01锌胺模型化物催化苯乙酮的烯丙基化反应机制西华大学学报(自然科学版)(2015年5期)2015-02-20纯手性的三联吡啶氨基酸—汞(II)配合物的合成与表征郑州大学学报(理学版)(2014年3期)2014-03-01推荐访问:串联 氨基酸 合成推荐文章
- [高考励志:倒计时冲刺语录] 高考倒计时励志语录
- 2018江苏高考成绩查询入口,点击进入:江苏高考2018成绩查询
- [英语阅读:细数英语中那些出口的汉语]带汉语的英语阅读视频
- 双语阅读:英文吐槽“变凉”的天气_喜剧中心吐槽大会2018
- 2018年福建高考成绩查询网址:http://www.eeafj.cn/:2018福建二建成绩查询
- 小学五年级下册语文阅读理解练习题五道_5年级下册语文书人教版
- 河北教育考试院2018高考查分_福建教育考试院网2018年高考查分系统
- 2018年山西省拟录用公务员公示 [2018年浙江瑞安市各级机关公务员拟录用人员公示(五)]
- 好舌头绕口令 [英语绕口令:挑战你的舌头]
- [2018福建高考成绩什么时候可以查询] 2018中级会计成绩查询