CREB激活促进神经痛大鼠脊髓背角HCN4转录的实验研究
来源:优秀文章 发布时间:2023-03-23 点击:
王 蓉,万 琪,谢 晔,徐 陶,曾俊伟,刘晓红
(遵义医科大学 生理学教研室,贵州 遵义 563099)
脊髓背角可以接受来自外周的伤害性信息并将其传至大脑高级中枢,而脑内的下行抑制/易化系统也可对伤害性信息进行调制[1]。近年研究表明,超极化激活的环核苷酸门控(Hyperpolarization-activated cyclic nucleotide-gating,HCN)通道有4个成员,分别为HCN1-4,在神经病理性疼痛的发生与维持中发挥重要作用[1-2]。在脊髓背角,HCN4表达于GABA能抑制性中间神经元和蛋白激酶Cγ(Protein kinase Cγ,PKCγ)阳性兴奋性中间神经元[3-7]。鞘内给予HCN通道阻滞剂ZD7288明显减轻慢性坐骨神经缩窄性损伤(Chronic constriction injury, CCI)或糖尿病大鼠的热痛及机械痛症状,并显著抑制其脊髓背角HCN4表达上升[3-6]。而且,鞘内注射HCN4慢病毒颗粒导致背角HCN4表达下调,明显缓解化疗大鼠的机械痛敏,其机制与抑制背角γ-氨基丁酸B型受体(Gamma-amino butyric acid receptor,GABABR)表达有关[8]。因此,探讨HCN4通道的表达调控机制有助于以HCN4通道作为靶点进行镇痛药物研发。
环磷酸腺苷-蛋白激酶A (Cyclic adenosine monophosphate-protein kinase A,cAMP-PKA)信号通路在HCN4通道的活性调节中具有重要作用。环磷酸腺苷(Cyclic adenosine monophosphate,cAMP)与HCN4通道蛋白的cAMP结合域结合,随后HCN4通道开放,形成的净内向电流使细胞兴奋性增强[9]。PKA 抑制剂可抑制大鼠背根节以及前额叶皮层神经元 HCN 通道电流,导致神经元兴奋性降低[10-11]。在坐骨神经损伤大鼠中,脊髓背角cAMP-PKA信号通路的激活促进钙调蛋白依赖性蛋白激酶Ⅱ (Calmodulin-dependent protein kinase Ⅱ,CaMKⅡ)活化和转录因子cAMP反应元件结合蛋白(Cyclic-AMP response binding protein,CREB)磷酸化,引起下游疼痛相关基因转录[12-14]。然而,目前并不清楚信号分子PKA、CaMKII和CREB的激活是否促进神经痛大鼠脊髓背角HCN4转录和表达。CREB作为转录因子,是否能够结合到HCN4启动子序列并促进其转录和表达,尚需实验证实。因此,本实验制备CCI神经痛模型,鞘内分别给予H-89(PKA抑制剂),KN-93(CaMKⅡ抑制剂)或Naphthol AS-E(CREB抑制剂),观察这些工具药对神经痛大鼠的机械痛行为的影响,分析PKA、CaMKII和CREB的激活对脊髓背角HCN4转录及蛋白表达的影响。
1.1 试剂 H-89(PKA抑制剂,B1427)、KN-93(CaMKⅡ抑制剂,K1385)来自美国Sigma;
Naphthol AS-E(CREB抑制剂,HY-104068)来自MCE;
兔抗 HCN4 多克隆抗体(55224-1-AP)、兔抗 CREB多克隆抗体(12208-1-AP)、兔抗β-actin 多克隆抗体(20536-1-AP)、小鼠抗β-actin单克隆抗体(66009-1-Ig)均来自美国 Proteintech;
兔抗p-CaMKⅡ(Ser286)单克隆抗体(12716S)、兔抗 p-CREB(Ser133)单克隆抗体(9198S)来自美国 Cell Signaling Technology;
兔抗GAPDH单克隆抗体(ET1601-4)来自华安生物;
小鼠抗PKA单克隆抗体(sc-365615)、小鼠抗 CaMKⅡ 单克隆抗体(sc-5306)来自Santa Cruz;
兔抗 p-PKA单克隆抗体(ab75991)来自 Abcam;
CREB探针及引物来自上海生工有限公司;
核蛋白提取试剂盒(NT-032)来自Invent公司;
Triozl试剂(9108)、逆转录试剂盒(RR037A)和SYBR Green荧光染料试剂盒(RR820A)来自TaKaRa;
EMSA试剂盒(GS009)来自上海碧云天生物科技公司。
1.2 主要仪器 电子Von Frey测痛仪购自美国IITC Life Science;
电泳仪和电泳槽和半干电转移系统购自美国 Bio-Rad Laboratories;
全能型凝胶成像系统购自英国 Syngene;
Quant Studio TM 6 Flex PCR仪购自美国Thermo Fisher scientific。
1.3 实验动物分组 体重200~230 g雄性SD大鼠购自长沙天勤公司[许可证号SCXK(湘)2019-0014];
实验期间大鼠分笼,于温度(22±2)℃、湿度50%左右、昼夜交替12 h环境中饲养。分为6 组:(1) Sham组;
(2) Sham+Vehicle组;
(3) CCI+Vehicle组;
(4)CCI+H-89(8nM);
(5)CCI+KN-93(50nM);
(6)CCI+Naphthol AS-E(5 μg/10uL)。Sham组大鼠仅暴露坐骨神经不结扎。其余各组大鼠在鞘内置管7 d后建立CCI模型,术后分别鞘内注射0.005 % DMSO生理盐水、H-89、KN-93 或Naphthol AS-E。10 μL/次,连续7 d,每天1次。
1.4 建模
1.4.1 鞘内置管 戊巴比妥钠(40 mg/kg,i.p.)麻醉大鼠,取俯卧位固定,在L3~L4间隙纵向切开背部皮肤,分离L4棘突两侧肌肉,剪掉L4棘突及相邻的白色椎板,使L3与L4棘突间隙得以暴露出来,用弯针挑破黄韧带及硬脑膜,当看到脑脊液溢出时,在此处插入PE-10导管,然后轻轻向上推2 cm,到达腰膨大处,随后将导管尖端固定在大鼠颈部区域。术后注射青霉素预防感染。术后第2天通过导管注射2%利多卡因(15 μL),若注射后30 s内出现双侧下肢瘫软,则为置管成功。只有无明显神经症状的正常大鼠被纳入实验。
1.4.2 CCI模型 大鼠置管成功7 d后,戊巴比妥钠(40 mg/kg,i.p.)麻醉并固定,在股骨外侧上方纵向切开长约1.5 cm的切口,钝性分离肌肉,使坐骨神经完全暴露,用4.0非吸收性医用缝合线结扎坐骨神经4道,每道间距大约为1 mm。结扎强度一般以引起小腿肌肉轻微颤动为宜。术后分笼饲养并注意清洁以防感染。Sham组大鼠仅暴露坐骨神经不结扎。
1.5 行为学测定 利用电子足底触觉测定仪来检测大鼠的MWT。在相对安静的环境中,将上述各组大鼠分别单独放置于金属丝网眼的透明玻璃笼中,待大鼠适应环境15~20 min后,将刚性尖端垂直地刺向大鼠后爪足底皮肤,在此过程中,若大鼠出现轻微的肌肉收缩或后爪抬起的反应,则判断为阳性反应,此时可记录下仪器上显示的缩爪阈值,切断值设置为60 g。每5分钟检测1次,重复进行3次,取平均值。所有大鼠均在CCI手术前1 d,术后1、3、5、7 d测定。
1.6 WB检测脊髓背角HCN4、PKA、p-PKA、CaMKⅡ、p-CaMKⅡ、CREB和p-CREB表达 CCI术后7 d,戊巴比妥钠对大鼠进行麻醉,取术侧的背侧脊髓约7 mm(L4~ L6),置于EP管中,加入200 μL RIPA裂解混合液(RIPA:蛋白酶抑制剂:磷酸酶抑制剂=100∶1∶1)后,用高通量组织研磨仪研磨混合后置于冰上,裂解30 min,每隔10 min震荡一次;
4 ℃,12 000 rpm离心20 min,取上清液,用BCA法检测总蛋白浓度,其余上清液加入上缓变性。每孔加80 μg蛋白,SDS-PAGE电泳,膜转移,5%脱脂奶粉封闭2 h。加入兔源HCN4抗体(1∶500),小鼠源 PKA抗体(1∶100),兔源p-PKA抗体(1∶1 000),小鼠源CaMKⅡ抗体(1∶100),兔源p-CaMKⅡ抗体(1∶1 000),兔源CREB抗体(1∶500),兔源p-CREB抗体(1∶1 000),兔源GAPDH抗体(1∶50 000),兔源β-actin抗体(1∶3 000),小鼠源β-actin抗体(1∶5 000),4℃过夜后。将膜放在TBST中清洗3次,每次间隔10 min,随后加入HRP标记的羊抗兔二抗(1∶3 000)或羊抗小鼠二抗(1∶5 000),室温孵育1 h,再次洗膜30 min,清洗完毕的PVDF膜采用化学发光法进行检测,将显影液混匀后滴在膜上,并放入仪器内曝光显色。数据采取ImageJ 1.48软件处理,GAPDH或β-actin为内参,以相对蛋白表达水平进行统计分析[(实验组目的蛋白灰度值/实验组内参灰度值) / (Sham组目的蛋白灰度值/Sham组内参灰度值)]。
1.7 RT-qPCR检测HCN4 mRNA表达 CCI术后7 d,用戊巴比妥钠对大鼠进行麻醉,取术侧的背侧脊髓约7 mm(L4~ L6),置于无酶的EP管中,Trizol 法抽提组织总 mRNA。纯化后,使用无酶水洗脱RNA,并测定其浓度和纯度。260∶280的吸光度比应在1.9~2.1的范围内。使用逆转录试剂盒和荧光染料试剂盒进行逆转录和扩增反应。根据GenBank上搜索的序列设计引物。本研究中使用的引物的核苷酸序列如下:(1) HCN4 (genebank:NM_021658.2):F:5′-CACTAAGGGCAACAAGGAGACCAAG-3′;
R:5′-TGAGTAGAGGCGGCAGTAAGTATCC-3′,(2)β-actin(genebank:NM_007393.5):F:5′-GGCTGTATTCCCCTCCATCG-3′;
R:5′-CCAGTTG GTAACAATGCCATGT-3′。qPCR的体系为20 μL,其中7 μL DEPC水、10 μL TB Green® Premix Ex TaqTMⅡ、0.5μL PCR Forward Primer (10μM)、0.5μL PCR Reverse Primer(10 μM)和2 μL cDNA。每个孔均要做复孔。逆转录反应条件为:37 ℃,15 min,85℃,5 s;
扩增反应条件为:95 ℃,30 s;
95 ℃,5 s;
60 ℃,30 s;
40 个循环。以β-actin为内参对照,统计各组CT值,采用2-△△CT(Livak法)法进行数据分析。
1.8 电泳迁移率实验(EMSA)检测CREB与HCN4启动子区域的DNA结合活性 CCI术后7 d,用戊巴比妥钠对大鼠进行麻醉,取术侧的背侧脊髓约7 mm(L4~ L6),置于EP管中,根据胞核提取试剂盒说明书步骤提取核蛋白,BCA法测定核蛋白浓度,-80℃保存。在PROMO和JASPAR数据库预测到转录因子CREB可能与HCN4启动子区域的四段序列结合。因此,由上海生工有限公司合成生物素3′端DNA标记的CREB探针,分别为CREB-1 (234-255bp):5′-GCTCCAGGTGATGTCATCACCC-3′;
CREB-2(838-859bp):5′-CAGAGTATCAGGTCACCAGAGG-3′;
CREB-3(1409-1430bp):5′-GGAGTAAGGACGCCTCCTACCT-3′;
CREB-4(1668-1689bp):5′-CGGCGGCTGATGTAAGCCCGGC-3′,将探针退火为双链。使用EMSA化学发光试剂盒检测CREB与HCN4启动子之间的结合活性。核蛋白-DNA探针反应总体积为10 μL:核蛋白5 μg,2μL 5×Binding buffer,室温反应10 min后,加入生物素标记探针1 μL,反应20 min,剩余用无酶水补足10 μL;
随后加入1 μL 10×Loading buffer。对于竞争实验:体系中添加100倍量的未标记的CREB探针,室温孵育20 min后加入标记探针,其余步骤一致。然后将反应物在5%凝胶上进行电泳,随后转移到带正电荷的尼龙膜上,其余步骤参照EMSA试剂盒说明书。
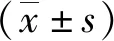
2.1 鞘内注射H-89、KN-93或 Naphthol AS-E 抑制剂对CCI大鼠机械痛阈的影响 在坐骨神经结扎前1 d,结扎后 1、3、5、7 d内,检测各组大鼠机械痛阈变化。结果显示(见图1),Sham 组和Sham+Vehicle组的MWT 始终稳定于基础水平,差异无统计学意义。与Sham组相比,CCI+Vehicle组在第1、3、5、7天的MWT明显降低,具有统计学意义(P<0.05)。与CCI+Vehicle组相比,鞘内注射H-89、KN-93或Naphthol AS-E的药物治疗组MWT显著升高(P<0.05)。
2.2 鞘内注射H-89、KN-93或 Naphthol AS-E对CCI大鼠脊髓背角HCN4表达的影响 如图2A,Sham组和Sham+Vehicle组背角HCN4 mRNA的表达无统计学意义。与Sham组相比,CCI+Vehicle组脊髓背角HCN4 mRNA表达显著升高,具有统计学意义(P<0.05)。与CCI模型组相比,鞘内注射H-89、KN-93或Naphthol AS-E的药物治疗组背角HCN4 mRNA表达显著下降,具有统计学意义(P<0.05)。如图2B所示,Sham 组和Sham+Vehicle组背角HCN4在蛋白表达水平无统计学意义。与Sham组相比,CCI+Vehicle组HCN4 蛋白表达显著升高,具有统计学意义(P<0.05)。与CCI+Vehicle组相比,鞘内注射H-89、KN-93或Naphthol AS-E的药物治疗组背角HCN4 蛋白表达显著下降,具有统计学意义(P<0.05),说明HCN4表达受PKA、CaMKII和CREB调控。
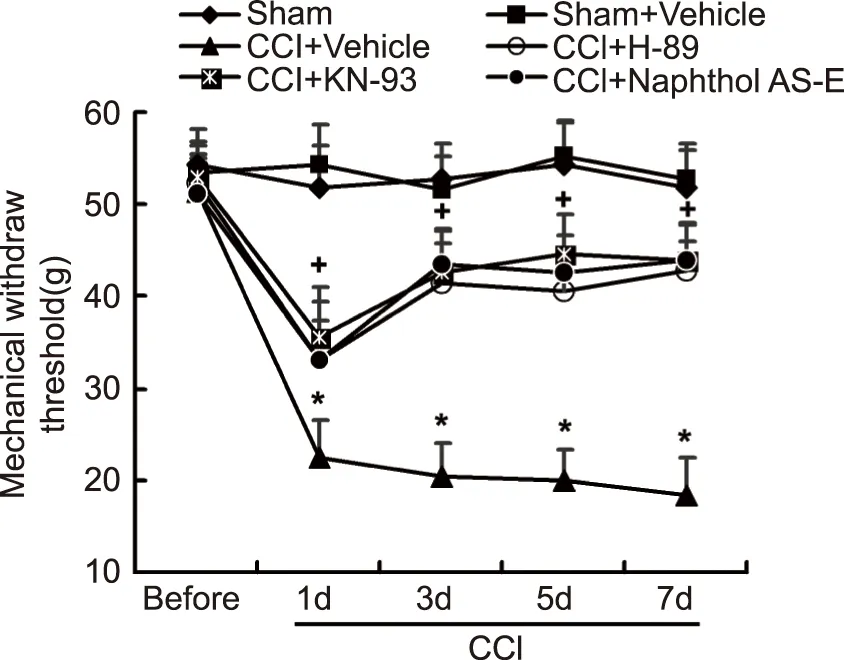
*:与Sham组比较,P<0.05;
+:与CCI+Vehicle组比较,P<0.05,n=8。图1 各组大鼠的机械痛敏变化情况
2.3 鞘内注射H-89、KN-93或 Naphthol AS-E对CCI大鼠脊髓背角PKA、p-PKA、CaMKⅡ、p-CaMKⅡ、CREB和p-CREB表达的影响 如图3,Sham组和Sham+Vehicle组脊髓背角PKA、p-PKA、CaMKII、p-CAMKⅡ、CREB和p-CREB的表达无统计学意义。与Sham组相比, CCI+Vehicle组PKA、p-PKA、CaMKII、p-CAMKⅡ、CREB和p-CREB表达显著增加,具有统计学意义(P<0.05)。与CCI+Vehicle组相比,鞘内注射H-89、KN-93或Naphthol AS-E的药物治疗组背角PKA、p-PKA、CaMKII、p-CAMKⅡ、CREB和p-CREB表达显著下降,具有统计学意义(P<0.05)。
2.4 鞘内注射H-89、KN-93或 Naphthol AS-E对CREB与HCN4启动子区域结合活性的影响 如图4,探针CREB-1(含有CREB激活位点元件的生物素3’端DNA标记探针)与来自CCI+Vehicle组的大鼠背角核蛋白提取物混合,进行凝胶电泳。与Sham组相比,来自CCI+Vehicle组的核提取物有效地结合大量CREB-1探针,显示浓重的迁移条带,然而,H-89、KN-93或Naphthol AS-E药物治疗组CREB迁移条带减少。CCI+Vehicle组的核提取物添加过量的未标记探针后无法检测到CREB结合条带。同时,尽管反复变换试验条件,但均未观察到其他探针(CREB-2、CREB-3、CREB-4)与来自CCI组的核提取物形成的凝胶条带,这初步证实CREB可以识别并结合到HCN4启动子区域242-249bp的序列(5′-GCTCAGGTGAGTGCCCC-3′),参与HCN4基因转录。

*:与Sham组比较,P<0.05;
+:与CCI+Vehicle组比较,P<0.05,n= 4~6。图2 各组大鼠脊髓背角HCN4的表达

*:与Sham组比较,P<0.05;
+:与CCI+Vehicle组比较,P<0.05,n=4。图3 各组大鼠脊髓背角PKA、p-PKA、CaMKⅡ、p-CaMKⅡ、CREB和p-CREB的表达

CREB:探针与DNA-转录因子结合条带;
NS:non-specific band,非特异条带;
NP:no protein,未加入蛋白提取物;
UP:unlabeled probe,无标记探针。图4 CREB 与HCN4启动子区域DNA结合活性
在脊髓背角,HCN4通道表达于抑制性中间神经元和PKCγ+兴奋性中间神经元,参与神经痛的形成与维持。在本试验中,鞘内注射PKA 抑制剂H-89、CaMKⅡ抑制剂KN-93或CREB抑制剂Naphthol AS-E均可以减轻大鼠坐骨神经结扎导致的机械痛敏,同时抑制脊髓背角HCN4在mRNA和蛋白水平的表达,提示HCN4的表达受PKA、CaMKⅡ及转录因子CREB的调控。
cAMP 是一种细胞内的第二信使物质,胞内 cAMP 浓度升高和随后的PKA激活均有助于背根神经节神经元 HCN 通道开放并形成净内向电流,感觉神经元兴奋性增加,引起痛觉敏化[15]。目前已发现的4种HCN 通道(HCN1-4)中,对 cAMP的反应敏感性依次为:HCN4>HCN2>HCN3>HCN1[4,16]。本试验中,鞘内注射PKA 抑制剂H-89导致CCI大鼠脊髓背角PKA表达下降,磷酸化减弱,同时也下调HCN4在mRNA和蛋白水平的表达。可见,PKA激活不仅有助于HCN4通道开放,也有助于其转录表达。
在神经痛的发生和维持过程中,背角cAMP/PKA通路的激活促进CaMKII活化和其下游转录因子CREB磷酸化,特别是CREB的Ser-133位点磷酸化直接受PKA和CaMKII的调控[12-13,17]。
本试验分别鞘内注射KN-93或Naphthol AS-E,随后CCI大鼠脊髓背角CaMKII和CREB的表达及磷酸化程度均减弱,HCN4在mRNA和蛋白水平的表达明显下降。更重要的是,鞘内注射PKA抑制剂H-89导致CCI大鼠背角CaMKII和CREB的表达及磷酸化程度均减弱,这说明PKA的激活有助于CaMKII和CREB的表达及磷酸化,而CaMKII和CREB的激活对于HCN4的转录和蛋白表达也非常重要。
CREB是一种重要的转录因子,其C端的亮氨酸拉链结构既可以与靶基因的经典cAMP反应元件(cAMP response element,CRE,含5"-TGACGTCA-3′回文序列) 结合,或与CRE变体序列5′-TGATGTCA-3′结合,也可以与非经典CRE序列(如5′-AGGCGTGG-3′或5′-AGGATGCG-3′等)结合并启动靶基因转录[18]。Smith等[19]针对哺乳动物(如人、大鼠、小鼠以及狗)的基因组序列进行研究,观察到5′-TGATGTCA-3′是最常见的CRE变体序列。本试验检测到CREB可以识别并结合到HCN4启动子区域242-249bp序列(5′-TGATGTCA-3′,为哺乳动物体内最常见的CRE变体序列),促进HCN4基因转录。在HCN4启动子序列中并没有检测到经典cAMP反应元件的存在。因此,初步推测,在CCI大鼠脊髓背角HCN4的转录增加,是由于转录因子CREB磷酸化之后,进入细胞核,结合到HCN4启动子的CRE变体序列(5′-TGATGTCA-3′),促进HCN4的转录和随后的蛋白表达。鞘内注射H-89或KN-93明显下调神经痛大鼠脊髓背角CREB与HCN4启动子之间的结合活性,说明CREB与HCN4启动子之间的结合受到PKA和CaMKII的调控。
在脊髓背角神经元,主要表达两种腺苷酸环化酶(Adenylate cyclase,AC),即ACⅠ 和ACⅧ。当胞质中Ca2+浓度上升时,与钙调蛋白结合为Ca2+/钙调蛋白复合物,迅速激活ACⅠ和ACⅧ[20];
其中,磷酸化的CREB既可以与ACⅧ启动子区域的CRE位点结合,促进ACⅧ 的转录生成[21],也可以与NMDA受体的NR1和NR2亚单位启动子结合促进其转录生成[22]。本试验中,鞘内注射CREB抑制剂NaphtholAS-E明显抑制CCI大鼠脊髓背角PKA和CaMKII的表达及磷酸化。这可能有两个原因:CREB表达及磷酸化程度下降,一方面导致ACⅧ生成减少,不能促进cAMP生成和PKA磷酸化,另一方面导致NMDA受体表达和激活减弱,神经元Ca2+内流减弱,Ca2+/钙调蛋白复合物生成减少,无法充分激活ACⅠ和ACⅧ,导致cAMP生成和PKA磷酸化减弱,CaMKII的表达及磷酸化也相应减弱。此外,本试验中,鞘内注射CaMKII抑制剂KN-93可以通过抑制CREB的表达及活性,间接导致CCI大鼠脊髓背角PKA表达及磷酸化减弱。
综上所述,在坐骨神经损伤的神经痛大鼠,脊髓背角PKA、CaMKII和CREB的表达及磷酸化程度增强,其中,PKA和CaMKII的激活明显促进转录因子CREB活化,导致CREB与HCN4启动子序列上的CRE变体序列(5′-TGATGTCA-3′)结合,这促进了HCN4在mRNA和蛋白水平的表达。有关HCN4的表达调控机制的探讨有助于研发以HCN4作为靶点的新型镇痛药物,将来应用于临床,通过抑制HCN4表达,间接下调感觉神经元兴奋性,从而发挥镇痛效应。
猜你喜欢 背角鞘内探针 不同剂量两性霉素B鞘内注射联合脑脊液持续引流置换治疗新型隐球菌性脑膜炎的对比昆明医科大学学报(2020年12期)2021-01-26基于FANUC数控系统的马波斯探针标定原理及应用装备制造技术(2020年1期)2020-12-25独一味对糖尿病痛大鼠脊髓背角内胶质细胞激活的影响中成药(2018年12期)2018-12-29多通道Taqman-探针荧光定量PCR鉴定MRSA方法的建立现代检验医学杂志(2016年3期)2016-11-15多发性硬化应用β干扰素鞘内注射治疗的效果分析中外医疗(2015年18期)2016-01-04脊髓背角MCP-1-JAK2/STAT3信号转导参与大鼠2型糖尿病神经病理性痛的机制研究中国病理生理杂志(2015年8期)2015-12-21脑脊液置换联合鞘内给药治疗结核性脑膜炎的临床效果中国当代医药(2015年31期)2015-03-01新型隐球菌脑膜炎鞘内药物治疗1例报道中国民族民间医药·下半月(2014年2期)2014-09-26多种探针的RT-PCR检测H5N1病原体方法的建立及应用现代检验医学杂志(2014年5期)2014-02-02靶向毁损触液核对大鼠痛行为及脊髓背角5-HT和c-Fos表达的影响中国应用生理学杂志(2014年3期)2014-01-22推荐访问:转录 脊髓 神经痛