黄姑鱼三倍体的诱导、鉴定及其性腺发育特征
来源:优秀文章 发布时间:2023-03-23 点击:
卢 磊 陈睿毅 杨 阳 竺奇慧 胡伟华 李海东 徐冬冬
(1.浙江海洋大学水产学院, 舟山 316022; 2.浙江省海洋水产研究所, 舟山 316021;3.浙江省海水增养殖重点实验室, 舟山 316021)
染色体多倍化可以改变鱼类的生物学性状, 是鱼类遗传改良的重要技术手段。其中, 三倍体鱼类是目前研究最多和最受关注的。由于具有低育或不育特征, 三倍体鱼类不仅在促进生长、防止养殖逃逸带来的生态风险等方面具有重要的应用价值,而且在生殖细胞移植、基因编辑育种等遗传操作的研究与应用中也极具价值。目前, 国内外学者已在多种淡水和海水鱼类中培育出三倍体群体, 如虹鳟(Oncorhynchus mykss)[1]、大黄鱼(Larimichthys crocea)[2]、鲶(Parasilurus asotus)[3]和黄颡鱼(Pelteogagrus fulvidraco)[4]等。研究表明, 三倍体鱼类往往具有不同于二倍体的生物学性状, 如在生长、性腺发育、繁殖及肌肉品质等方面, 三倍体鱼类与其二倍体可能会存在明显差异。因此, 有必要对于三倍体鱼类的生长发育特征进行比较分析, 为其应用提供科学依据。
黄姑鱼(Nibea albiflora)隶属石首科(Sciaenidae), 黄姑鱼属(Nibea), 具有生长快、抗逆性强等优点, 经过20余年的繁育和养殖技术开发, 已经成为我国沿海网箱、池塘养殖的重要品种。黄姑鱼的性成熟周期较短(1—2龄), 属于分批多次产卵类型, 采用人工控制技术可以实现其常年繁殖。因此黄姑鱼三倍体在石首鱼类的生殖细胞移植、基因编辑育种等方面具有较大的应用潜力; 并且其在生长、出肉率等方面可能具有优势, 有望提高养殖效益。
三倍体鱼类的性腺发育与其生长、发育、繁殖等生物学习性密切相关, 成为研究学者关注的首要问题。三倍体与二倍体鱼类性腺发育的差异因种而异, 虽然大多数的三倍体性腺表现出不育或低育, 但在一些淡水鱼类中也发现了三倍体可育的现象[5,6]。在石首鱼科的大黄鱼[2]和箕作黄姑鱼(Nibea mitsukurii)[7]中, 已经建立了三倍体的诱导方法,并初步分析了三倍体的生长、成活及性腺发育等特征。如林琪等[2]发现大黄鱼的三倍体较二倍体的性腺发育缓慢, 卵巢和精巢始终处于性原细胞阶段。日本学者Takeuchi等[7]发现三倍体的箕作黄姑鱼的生殖腺指数较二倍体降低, 虽能产生少量的配子, 但其后代不能存活。因此, 不同鱼种三倍体的诱导条件、性腺发育特征等存在明显差异。本研究通过冷休克诱导黄姑鱼三倍体, 并通过组织学和基因表达分析了性腺发育和育性特征, 以期为其后续的遗传改良和生殖细胞移植应用提供基础。
1.1 试验亲鱼和精子、卵子收集
试验用亲鱼来自浙江省海洋水产研究试验场(舟山, 西轩岛), 在室内水泥池强化培育, 待到性成熟时向雌鱼的体腔注射促黄体释放激素-A2(宁波第二激素厂)进行人工催产。采用腹部挤压法分别收集雌鱼的卵子和雄鱼的精子, 收集的精子和卵子分别放入干燥的烧杯中备用。
1.2 三倍体诱导
采用干法授精, 将采集的精液滴入卵中, 轻轻摇动混匀, 然后加入少量海水进行受精。三倍体诱导方法参考黄姑鱼雌核发育二倍体诱导方法[8], 在受精2.5min后浸入3℃的海水进行冷休克处理, 处理时间为10min, 其后将冷休克处理的受精卵转移到1000 L养殖桶内充气培养。实验期间, 受精卵孵化温度为21—22℃, 仔鱼到幼鱼的培育温度为22—24℃。
1.3 DNA相对含量测定
分别取二倍体组和冷休克处理组的初孵仔鱼,蒸馏水冲洗后加入磷酸缓冲液捣碎, 过260目筛绢、DAPI染色后, 用流式细胞仪Partec cell counter analysis检测DNA相对含量[8]。
1.4 染色体核型分析
分别取5月龄的二倍体组和三倍体组的实验鱼,采用活体腹腔注射0.1%的植物凝集素, 注射剂量为0.5 mL/100 g, 注射12h后, 向鱼体腹腔中注射0.5%的秋水仙碱, 注射剂量为0.5 mL/100 g, 在注射3h后解剖取肾脏组织, 剪刀剪碎肾脏组织后用尼龙纱布过滤收集肾脏细胞, 于0.075 mol/L KCl室温下低渗30min, 用卡诺氏固定液(甲醇﹕乙酸=3﹕1)在4℃固定3次, 每次固定30min, 最后采用冷片法滴片, 室温干燥后置于15%吉姆萨染液中染色, 玻片干燥后经显微镜拍照计数。
1.5 性腺组织切片
分别在2、3、4、6、8、10和12月龄取冷休克处理组和二倍体组的黄姑鱼, 解剖取出性腺组织,每次取样在10尾以上, 称量记录体长、体重和性腺重。采用波恩固定液固定性腺, 然后脱水、包埋,制作组织切片, HE染色后经光学显微镜观察并拍照, 参考相关文献确定黄姑鱼性腺发育时期[9]。
1.6 基因表达分析
样品采集及cDNA获取采集的性腺组织置于RNA保存液中。采用总RNA提取试剂盒(Solarbio, 总RNA提取试剂盒)提取性腺组织的总RNA,然后采用PrimescriptMTRT试剂盒将提取的总RNA反转录成cDNA。
qPCR分析使用的荧光定量引物来自于本实验室设计的4对引物[10](表1)。反应体系为20 μL,内含2 μL的cDNA模板, 6.8 μL的无酶水, 0.4 μL的前引物, 0.4 μL的后引物, 0.4 μL的ROX Reference Dye Ⅰ, 10 μL的2×SYBY Premix ExTapTMⅡ。qPCR反应程序为: 95℃ 30s; 95℃ 5s, 60℃ 30s, 33个循环, 然后再 95℃ 15s; 60℃ 30s; 95℃ 15s。每组设置3个生物学重复, 基因相对表达量采用 2–∆∆Ct方法进行计算。

表1 qPCR分析的基因及其特异性引物Tab.1 qPCR Validation genes and their specific primers
1.7 数据分析
统计各组的受精率、孵化率和生殖腺指数GSI(gonadosomatic index), 各参数计算公如下:GSI=性腺重/体重×100, 受精率(%)=受精卵数/总卵数×100, 孵化率(%)=初孵仔鱼数/受精卵数×100。采用Graphpadprism9.0软件进行统计学分析。使用独立样本t检验比较对照组数据与处理组数据之间的差异时, 所有百分数都进行反正弦平方根转换。所有数据均采用平均值±标准差表示。
2.1 受精率和孵化率
对二倍体和冷休克处理组的受精率和孵化率进行统计分析(图1), 二倍体和冷休克处理组受精率分别为(88.59±2.51)%和(70.31±4.49)%(图1A), 孵化率分别为(75.68±6.94)%和(21.5±6.63)%(图1B),冷休克处理组的受精率和孵化率均显著低于二倍体(P<0.05)。

图1 黄姑鱼二倍体组和冷休克处理组的受精率与孵化率比较Fig.1 Comparisons of fertilization rate and hatching rate in the diploid and cold shock treatment groups of yellow drum
2.2 倍性鉴定
DNA相对含量冷休克处理组和二倍体组的DNA含量如图2, 二倍体组的峰值在1024, 冷休克处理组的峰值在1536, 冷休克处理组的DNA含量为二倍体的1.5倍。经流式细胞仪检测了30尾冷休克处理组的初孵仔鱼, 其DNA含量均为二倍体的1.5倍, 表明三倍体的比例为100%。
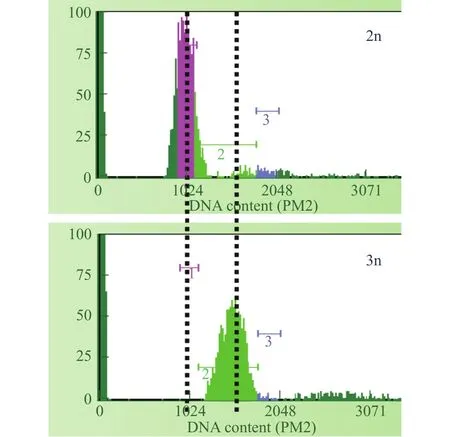
图2 黄姑鱼二倍体组和冷休克处理组的流式细胞仪分析结果Fig.2 The flow cytometer analysis of DNA content in the diploids and cold shock treatment groups of yellow drum
染色体的核型分析如图3所示, 二倍体染色体数目为48条(图3A), 三倍体的染色体数目为72条(图3B), 三倍体黄姑鱼的染色体数目为二倍体的1.5倍。

图3 黄姑鱼二倍体(A)和三倍体(B)的染色体核型分析Fig.3 Karyotype analysis of the diploid (A) and triploid (B)yellow drum
2.3 三倍体性腺发育
性腺外部形态及生殖腺指数如图4所示,在10月龄和12月龄时, 三倍体精巢和卵巢的GSI显著低于二倍体(图4B)。二倍体的精巢和卵巢较为饱满, 已经接近性成熟, 而三倍体的性腺外部形态明显不同于二倍体, 精巢和卵巢发育较二倍体缓慢(图4A)。
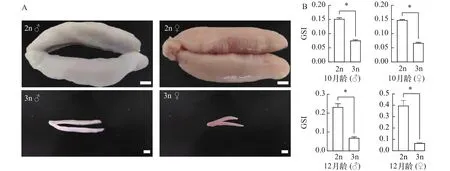
图4 黄姑鱼二倍体和三倍体的性腺外部形态及生殖腺指数比较Fig.4 External morphology of gonads and the gonadosomatic index of the diploid and triploid yellow drum
精巢发育如图5所示, 2月龄时, 二倍体和三倍体的精巢正处于Ⅰ期, 此时在二倍体和三倍体性腺组织切片中可见精小叶内充满大量的精原细胞(图5A、E)。6月龄时, 二倍体的精巢处于Ⅳ期,三倍体的精巢处于Ⅲ期, 此时在二倍体精巢组织切片中可见大量成熟的精子、精母细胞和少量的精原细胞(图5B), 在三倍体精巢组织切片中可见大量精母细胞和少量的精原细胞(图5F)。10月龄时, 二倍体的精巢已接近于Ⅴ期, 三倍体的精巢仍处于Ⅲ期, 此时在二倍体精巢组织切片中可见精小叶充满了精子(图5C)。在三倍体精巢组织切片中可见大量的精母细胞和少量的精原细胞(图5G)。12月龄时, 二倍体的精巢处于Ⅴ期, 精巢内可见大量游离的精子沿着精细小管准备汇入中央导管, 但是仍存在一些处于不同发育的生殖细胞(图5D); 三倍体的精巢则处于Ⅲ期, 精巢中可见大量精母细胞和少量精原细胞(图5H)。

图5 二倍体和三倍体精巢发育的组织学比较Fig.5 Histological comparison of testis development between diploids and triploids
卵巢发育如图6所示, 2月龄时, 二倍体和三倍体的卵巢处于Ⅰ期, 此时, 在二倍体卵巢组织切片中可见卵巢腔和大量的卵原细胞(图6A), 在三倍体卵巢组织切片中可见大量的卵原细胞(图6E)。6月龄时, 二倍体的卵巢处于Ⅱ期, 卵巢组织切片中可见大量的第Ⅱ时相卵母细胞(图6B); 三倍体的卵巢则处于Ⅰ期, 卵巢组织切片中可见大量的卵原细胞(图6F)。10月龄时, 二倍体的卵巢处于Ⅲ期, 卵巢组织切片可见第Ⅲ时相卵母细胞(图6C); 三倍体的卵巢仍处于Ⅰ期, 但在其卵巢组织切片中可见少量分散的第Ⅱ时相卵母细胞(图6G)。12月龄时, 二倍体的卵巢处于Ⅴ期, 卵巢组织切片中可见大量完成卵黄发生的卵母细胞(图6D), 三倍体的卵巢仍停滞在Ⅰ期, 其卵巢组织切片中仅可见少量分散的第Ⅱ期时相卵母细胞(图6H)。
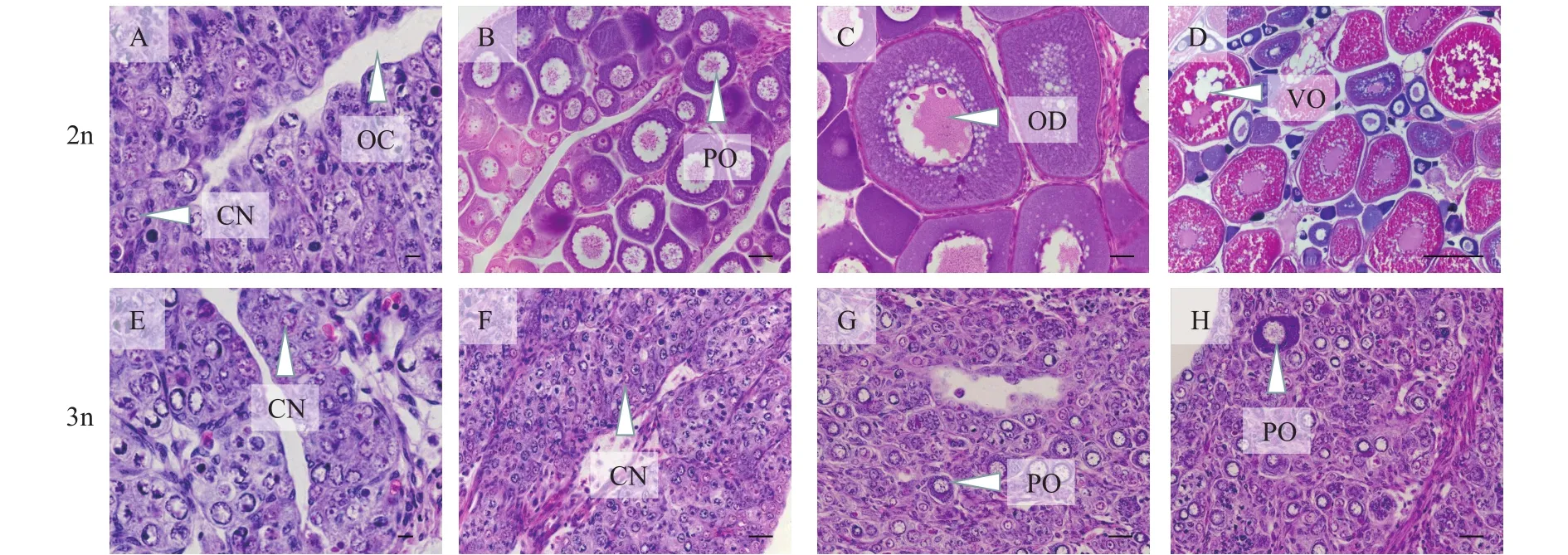
图6 二倍体和三倍体卵巢发育的组织学比较Fig.6 Histological comparison of ovary development between diploids and triploids
二倍体和三倍体生殖相关基因的表达比较如图7所示, 10和12月龄时, 三倍体精巢的dmrt1和vasa基因表达量均显著低于二倍体(图7A—D); 三倍体卵巢的cyp19a基因表达量也显著低于二倍体(图7E、G), 而二倍体卵巢中的vasa表达量高于三倍体, 但二者没有显著差异(图7F、H)。

图7 二倍体和三倍体黄姑鱼的dmrt1基因、vasa基因和cyp19a基因表达分析Fig.7 The expression analysis of dmrt1, vasa and cyp19a in the diploid and triploid yellow drum
在目前的研究中, 淡、海水鱼类常用冷休克或热休克处理的方法诱导三倍体, 这两种方法的选择与鱼种有关, 如冷水性鱼类虹鳟采用热休克处理获得了三倍体[1], 而暖温性鱼类如大黄鱼、箕作黄姑鱼等则采用冷休克诱导三倍体[2,7]。黄姑鱼隶属于暖温水性鱼类, 其雌核发育研究中采用了冷休克处理, 故而本研究也选择了冷休克处理诱导三倍体。
参考雌核发育的诱导参数[8], 黄姑鱼三倍体的诱导选择在受精后2.5min以3℃的海水进行10min的冷休克处理, 获得了较高的受精率(70.31±4.49)%和孵化率(21.5±6.63)%, 且三倍体比例达到100%。箕作黄姑鱼的诱导则采用在受精后5min以10℃处理15min,孵化率达到(16.4±10)%[7]。本研究所采用的冷休克诱导方法和参数与大黄鱼三倍体相似, 但孵化率高于大黄鱼三倍体[11]。鱼卵的质量及冷休克参数是影响诱导效果的主要因素。其中, 冷休克起始时间是三倍体能否诱导成功的关键[7], 而采用适宜的温度和持续时间则能减少对胚胎伤害[4]。
鱼类倍性鉴定常用细胞学、流式细胞仪和染色体核型分析等方法[2,7], 由于流式细胞仪和染色体核型分析的方法具有高效、简便等特点, 本研究采用这两种方法检测黄姑鱼的倍性。经过在初孵仔鱼和幼鱼阶段的检测, 其三倍体比例为100%, 表明本研究所采用的诱导参数能够成功诱导黄姑鱼三倍体。Takeuchi等[7]采用冷休克诱导箕作黄姑鱼三倍体, 其比例也可达到100%。人工诱导的多倍体的染色体基因组可能存在不稳定性, 在发育过程中部分个体可能出现染色体丢失导致倍性降低[6],因此对于人工诱导的黄姑鱼三倍体还需要持续的倍性监测, 以此确定三倍体基因组的稳定性。
三倍体的性腺发育是研究学者首先关注的问题, 性腺成熟指数GSI是用来评价鱼类性腺发育成熟度的指标之一。在本研究中, 10月龄和12月龄二倍体雄鱼和雌鱼的性腺成熟指数均是三倍体的2倍以上, 三倍体的性腺发育明显较二倍体缓慢。在箕作黄姑鱼[7]和鲫[11]等鱼类中也发现三倍体的性腺成熟指数明显低于二倍体。组织学分析发现三倍体黄姑鱼的精巢和卵巢发育较二倍体滞后, 三倍体的卵巢主要由卵原细胞组成, 而精巢主要由精母细胞组成。在大黄鱼中也发现三倍体精巢由少量的精母细胞组成和大量的性原细胞组成, 三倍体卵巢由少量的卵母细胞组成和大量的性原细胞组成[2]。
本研究进一步分析生殖相关基因表达, 从分子水平比较二倍体和三倍体的性腺发育差异。vasa基因是生殖细胞的标记基因, 主要在鱼类的生殖细胞中表达[13]。通过荧光定量PCR分析发现, 二倍体精巢中的vasa表达量约为三倍体的3倍, 而二倍体卵巢中的vasa表达量也高于三倍体。在湘云鲫中研究发现二倍体精巢中的vasa基因表达量显著高于三倍体红鲫, 而三倍体卵巢中的vasa基因表达量与二倍体红鲫无显著差异[14]。Cyp19a是雌鱼的体细胞标记基因, 主要在卵巢的颗粒细胞(Granulosa cells)等表达[18], 通过基因表达分析发现, 黄姑鱼三倍体卵巢中的cyp19a表达量约为二倍体的1/5。Dmrt1基因主要在鱼类的生殖细胞表达和支持细胞等表达[15—17], 通过基因表达分析发现, 黄姑鱼三倍体精巢中dmrt1的表达量则为二倍体的1/3倍。三倍体黄姑鱼的生殖相关基因表达较二倍体明显下降,表明其生殖细胞及支持细胞的发育受到三倍化的影响, 从而导致性腺发育滞后。
综上, 本研究通过冷休克处理成功诱导了黄姑鱼三倍体, 三倍体的性腺发育较二倍体滞后, 育性明显降低。在鱼类生殖细胞移植中, 不育受体的制备至关重要。通过染色体三倍化降低育性, 是制备生殖细胞移植受体的重要途径。因此, 黄姑鱼三倍体有望成为石首鱼类的生殖细胞移植的受体, 在石首鱼类性别控制育种、基因资源保存及濒危物种保护等方面极具应用价值。对于三倍体黄姑鱼的其他生物学性状, 如生长、出肉率和肌肉品质等还需要进一步研究, 为其在水产养殖中的应用提供参考依据。
猜你喜欢 精巢三倍体二倍体 王中柱东坡赤壁诗词(2022年4期)2022-10-30我国三倍体牡蛎育苗、养殖现状及发展对策科学养鱼(2021年11期)2022-01-11云南山地橡胶树三倍体育种回顾热带农业科技(2020年3期)2020-12-15草地贪夜蛾种群性诱测报方法研究植物保护(2019年4期)2019-09-04细数你吃的那些“不孕不育”食物食品与生活(2019年12期)2019-05-15染色体加倍对黄毛草莓叶片形态的影响江苏农业科学(2017年16期)2017-10-27二倍体太子参丛生芽诱导研究现代农业科技(2017年8期)2017-06-10红鳍笛鲷(Lutjanus erythopterus)精巢发育的组织学研究广东海洋大学学报(2016年1期)2016-04-06“寒富”苹果与其同源四倍体耐盐差异研究中国果业信息(2015年6期)2015-01-23角喙栓蚤蝇减数分裂行为观察江苏农业科学(2014年6期)2014-08-12推荐访问:性腺 诱导 发育