紫锥菊提取物对大鼠湿热泄泻的疗效及其机制
来源:优秀文章 发布时间:2023-03-23 点击:
池幸子,杨诗靖,杨泊文,孙 晗,姚丽丽,顾达星,郭世宁,2,石达友,2,武 力,2,刘 翠,2*
(1.华南农业大学兽医学院,广州 510642;
2.广东省兽用中药与天然药物工程技术研究中心,广州 510642)
随着现代养殖集约化、规模化及畜禽流动性的增加,内外湿热侵袭畜禽机体导致脾胃、肠道功能紊乱的湿热泄泻相关疾病时有发生,给养殖业带来巨大损失。湿热泄泻主要有“湿热气盛,是以温厉大行”的病理特点,湿热壅滞,损伤脾胃传化失常,导致肠道传导功能紊乱,临床表现为腹痛、腹泻、肛门灼热、里急后重、苔黄腻,大便黏腻、色黄且臭[1]。临床实践表明,采用化学药物控制炎症反应以治疗畜禽湿热泄泻,其疗效不佳,且药物不合理使用易致耐药性及药物残留,对人类健康构成潜在威胁[2]。
湿热泄泻的发展与饮食、环境、生物因素等密切相关,目前,湿热泄泻证常以“内湿+外湿+客邪”为原则建模,即喂养高脂高糖饲料以制造内湿,置于高温高湿环境以制造外湿,给予病原体以制造客邪[3]。本研究根据参考文献[4],在高温高湿环境下给予大鼠高糖高脂饮食后,腹腔注射大肠杆菌菌液建立大鼠湿热泄泻模型,通过对其临床体征、体重、采食、饮水量的监测进行模型评价,其中,临床体征主要为精神状态、粪便含水量与色泽等宏观证候指标的监测[5]。
紫锥菊(Echinaceapurpurea)属菊科紫锥花属植物,也称“松果菊”,味辛、苦,性凉,归肺、脾经,有清热解毒,益气扶正的功效[6]。紫锥菊含有菊苣酸、咖啡酸、多糖等多种活性物质,在抗感染和提高免疫力方面有显著作用[7]。此前已有研究发现,紫锥菊在结肠炎模型的治疗中具有抗炎作用[8],本研究通过建立大鼠湿热泄泻模型,探讨紫锥菊提取物对湿热泄泻大鼠的疗效,为紫锥菊提取物防治湿热泄泻疾病提供科学依据。
1.1 试剂和仪器
猪油购自顿蒿特食品有限公司;
营养琼脂购自青岛高科园海博生物技术有限公司;
大鼠 IL-6、IL-10、IL-17、IL-23 ELISA试剂盒购自江苏酶免生物科技有限公司;
大鼠TGF-β、IL-2 ELISA试剂盒购自上海酶联生物科技有限公司;
葡萄糖、甲醛、氯仿、无水乙醇购于天津市大茂化学试剂厂;
异丙醇购于天津市富宇精细化工有限公司;
RNALaterTM动物组织RNA稳定保存液购于上海碧云天生物科技有限公司。RNaze-free ddH2O、RNA isolater Total RNA Extraction Reagent、Hiscript Ⅲ RT SuperMix for qPCR(+gDNA wiper)购于南京诺唯赞生物科技股份有限公司。
全自动生化分析仪(BS-320,WS-49002086)、离心机(湖南湘仪,L420)、酶标仪(Thermo,357-701660)、恒温水浴锅(常州澳华)、电热恒温鼓风干燥箱(上海跃进)、台式高速冷冻离心机(艾本德,5425R)、PCR仪(美国伯乐,BIOT100)。
1.2 药物与菌种
紫锥菊提取物(EPE),由华南农业大学兽医学院中兽医实验室与广州华农高科生物科技有限公司研制,广州华农高科生物科技有限公司中试生产,批号:20191201,含单咖啡酰酒石酸和菊苣酸的总量≥2.0%,100 g·袋-1。
产肠毒素性大肠杆菌(O78)购自中国兽医药品监察所。
1.3 模型建立及其判断标准
广州南方医科大学实验动物管理中心购进40只SPF级Wistar大鼠,体重180~220 g,雌雄各半,动物生产许可证号:SYXK(粤)2019-0136。40只Wistar大鼠随机均分为5组:空白组、模型组、EPE低剂量组、EPE高剂量组及阳性药物组,雌雄各半。除空白组外,其余各组大鼠单日灌胃猪油(20 mL·kg-1),并给予充足饲料,双日禁食,且自由饮用30%的葡萄糖水,并放置于高温高湿环境中,维持室内温度33 ℃±2 ℃,湿度90%±5%,每日持续8 h,共10 d。10 d后,除空白组外,其余各组大鼠腹腔注射2 mL·kg-1剂量产毒性大肠杆菌菌液(1.8×109CFU·mL-1),间隔24 h后,再次注射1 mL·kg-1剂量大肠杆菌菌液,自然适应1 d,空白组大鼠腹腔注射等量生理盐水。造模后,EPE低、高剂量组每日分别灌胃1与3 g·kg-1EPE,阳性药物组每日灌胃0.1 g·kg-1柳氮磺吡啶,空白组与模型组大鼠给予等量生理盐水,持续6 d(图1)。
实施特深井(13 000 m以深)科学钻探工程之前,建立结晶岩钻探施工必要的理论基础和构建初步的技术体系是非常必要的,只有在具备较完备的理论基础和完善的施工技术体系的前提下,才能安全、高效地完成特深井科学钻探任务。
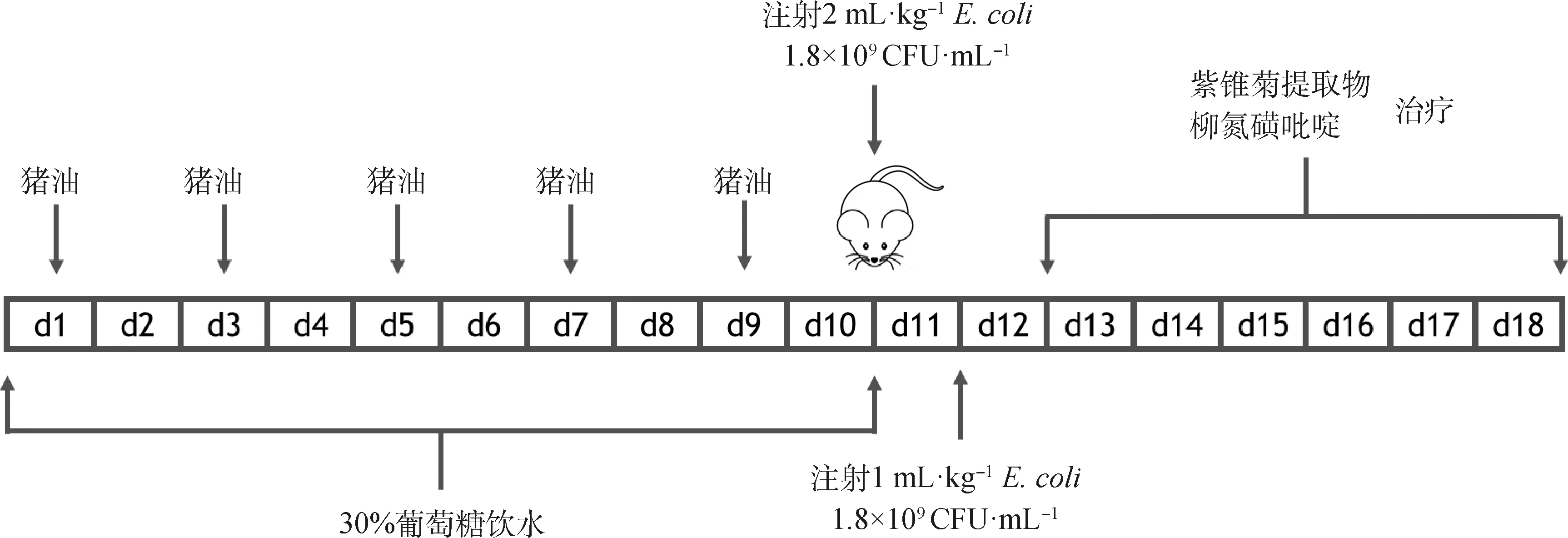
图1 模型建立与药物治疗Fig.1 Model establishment and drug therapy
根据临床症状评分评价各组大鼠湿热泄泻临床症状变化程度,评分标准参考王涛[4]方法,见表1。根据表1中粪便形状评分标准评价大鼠腹泻程度。
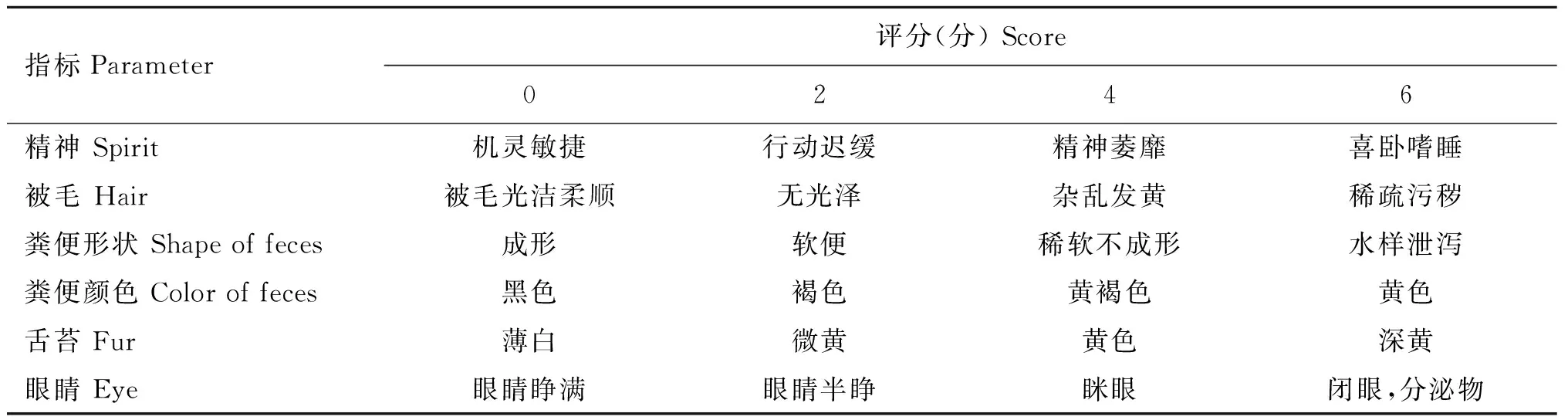
表1 大鼠临床症状评分标准Table 1 Scoring standard of clinical symptoms in rats
1.4 观察大鼠临床体征变化
观察各组大鼠临床体征,记录体重、饮水量与采食量。
1.5 大鼠血常规指标检测
各组大鼠进行腹主动脉采血,采抗凝血液约1 mL。进行血常规指标测定,主要检测白细胞数目(white blood cell count, WBC)、中性粒细胞数目(neutrophil count, NEU)、单核细胞数目(monocytes count, MON)、淋巴细胞数目(lymphocyte count, LYM)、红细胞压积(hematocrit, HCT)、红细胞数目(red blood cell count, RBC)、血红蛋白浓度(hemoglobin, HGB)和血小板数目(platelet count, PLT)。
1.6 大鼠主要血清生化指标检测
各组大鼠进行腹主动脉采全血4 mL,静置2~3 h,室温下3 500 r·min-1离心10 min,取上清备用。使用全自动生化分析仪,检测血清中总蛋白(total protein,TP)、白蛋白(albumin,ALB)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、葡萄糖(glucose,GLU)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、肌酐(creatinine,CREA)和尿素(urea,UREA)。
1.7 大鼠主要血清因子含量检测
ELISA法检测各组大鼠血清中TGF-β、IL-2、IL-6、IL-10、IL-17、IL-23含量。
1.8 大鼠主要脏器指数测定
剖取大鼠心、肝、脾、肺、肾、胸腺以及盲肠至肛门段肠道,剥除脏器表面被膜及脂肪后,称量各脏器质量,并计算大鼠脏器指数:
脏器指数=脏器质量/大鼠体质量(mg·g-1)
1.9 大鼠主要脏器的病理组织学观察
取各组大鼠心、肝、脾、肺、肾、胸腺置于10%中性甲醛溶液中固定后,双蒸水冲洗干净,然后乙醇脱水,二甲苯透明,石蜡包埋,切片并HE染色,显微镜下进行各组大鼠主要脏器的病理组织学观察。
1.10 大鼠结肠TGF-β1、Foxp3、RORγt mRNA表达水平测定
取各组大鼠结肠组织,采用实时荧光定量PCR扩增法检测大鼠结肠组织中转化生长因子β1(transforming growth factor β1,TGF-β1)、维甲酸相关孤儿受体γt(retinoid acid-related orphan receptor gammat,RORγt)、叉头框蛋白P3(forkhead box protein P3,Foxp3) mRNA相对表达量。
1.11 数据处理与分析

2.1 大鼠临床体征变化
试验期间空白组大鼠被毛光洁,精神状态良好,活泼好动,采食饮水,以及粪便、尿液、肛门情况均正常。与空白对照组相比,模型组大鼠精神沉郁,被毛粗糙泛黄(图2A),蜷缩懒动,食欲明显下降,粪便稀薄黏腻、色黄而臭(图2B),符合湿热泄泻证候的整体特征。采用紫锥菊提取物和柳氮磺吡啶治疗6 d后,与模型组相比,各治疗组的症状明显减轻,被毛恢复光泽(图2D),饮食与活动增加,粪便逐渐成形且颜色加深,肛门状态良好(图2 C),个别大鼠的粪便仍黏软呈黄褐色,提示紫锥菊提取物对湿热泄泻证具有缓解效果。

A、B. 治疗前湿热泄泻大鼠粪便情况与被毛状态;
C、D.紫锥菊提取物低剂量组治疗后大鼠的肛门与精神状态。扫描文章首页OSID码可查看彩图A, B. Hair state and the feces of rats with dampness-heat diarrhea before treatment; C, D. The anal and mental state of rats in the low-dose group of Echinacea purpurea extract after treatment. The color picture can be found by scanning the OSID code on the front page of the article图2 治疗前后湿热泄泻大鼠临床症状Fig.2 Clinical symptoms of rats with Intestine amp-heat syndrome before and after treatment
第12天造模结束时,与空白组相比,模型组大鼠临床症状评分显著升高(P<0.05),腹泻程度评分显著升高(P<0.05)。第13~18天评分持续降低且显著高于空白组(P<0.05)。与模型组相比,各治疗组临床症状评分在第13~17天无显著差异(P>0.05),第18天时紫锥菊提取物低剂量组大鼠临床症状评分与腹泻程度评分显著降低(P<0.05)(图3A、B)。

A.临床症状评分;
B.腹泻程度评分;
C.体重;
D.饮水量;
E.采食量。*.与空白组相比,模型组P<0.05, #. 与模型组相比,治疗组P<0.05。扫描文章首页OSID码可查看彩图A. Clinical symptom scores; B. Diarrhea scores; C. Body weight; D. Water consumption; E. Feed intake. * indicates that compared with the blank group, the model group P<0.05, # indicates that compared with the model group, the treatment group P<0.05. The color picture can be found by scanning the OSID code on the front page of the article图3 各组大鼠临床体征变化情况Fig.3 Changes of clinical signs of rats in each group
第12天造模结束时,与空白组相比,模型组大鼠体重显著降低(P<0.05)。第13~18 d治疗过程中模型组与各治疗组体重逐渐升高,第18天时紫锥菊提取物高剂量组与阳性药物组的大鼠体重高于模型组,但无显著差异(P>0.05)(图3C)。
第12 天造模结束时,与空白组相比,模型组大鼠饮水量升高但差异不显著(P>0.05),第13~18天模型组与各治疗组大鼠饮水量逐步恢复至正常水平(图3D)。
第12天造模结束时,与空白组相比,模型组大鼠采食量显著降低(P<0.05)。第13~18天模型组与各治疗组大鼠采食量逐步恢复至正常水平(图3E)。
2.2 大鼠血常规指标变化
与空白组相比,模型组大鼠血液中RBC、HGB、HCT含量均显著降低(P<0.05),WBC、NEU有增加的趋势但差异不显著(P>0.05)。与模型组相比,经紫锥菊提取物及阳性药物治疗后,各治疗组大鼠血液RBC、HGB、HCT含量均有升高趋势,其中,紫锥菊提取物高剂量组的HCT显著增加(P<0.05),紫锥菊提取物高、低剂量组与阳性药物组大鼠血液WBC、NEU的含量均有降低的趋势但差异不显著(P>0.05)(表2)。

表2 血常规检测结果Table 2 The results of blood routine test(n=8,
2.3 大鼠主要血清生化检指标变化
与空白组相比,模型组大鼠血清UREA、ALT水平均显著降低(P<0.05),AST、TC、TG、TP、ALB水平降低,但差异不显著(P>0.05)。与模型组相比,经紫锥菊提取物及阳性药物治疗后,紫锥菊提取物高、低剂量组与阳性药物组大鼠UREA、ALT、AST、TC、TG、TP、ALB水平均有升高趋势,其中,各治疗组的TP显著升高(P<0.05),紫锥菊提取物高、低剂量组的UREA、TC、TP、ALB水平显著升高(P<0.05),阳性药物组AST水平升高且差异显著(P<0.05)(表3)。

表3 血生化检测结果Table 3 The results of blood biochemical test(n=8,
2.4 大鼠主要血清炎性因子水平变化
与空白组相比,模型组大鼠血清IL-6、IL-17、IL-23水平均显著升高(P<0.05),血清TGF-β、IL-2、IL-10水平均显著降低(P<0.05)。与模型组相比,紫锥菊提取物高、低剂量组与阳性药物组大鼠血清IL-17、IL-23水平均显著降低(P<0.05),紫锥菊提取物高、低剂量组大鼠血清TGF-β水平升高,且显著高于模型组(P<0.05),其中,紫锥菊提取物低剂量组IL-2、IL-10、IL-17、IL-23效果优于紫锥菊提取物高剂量组与阳性药物组(图4)。
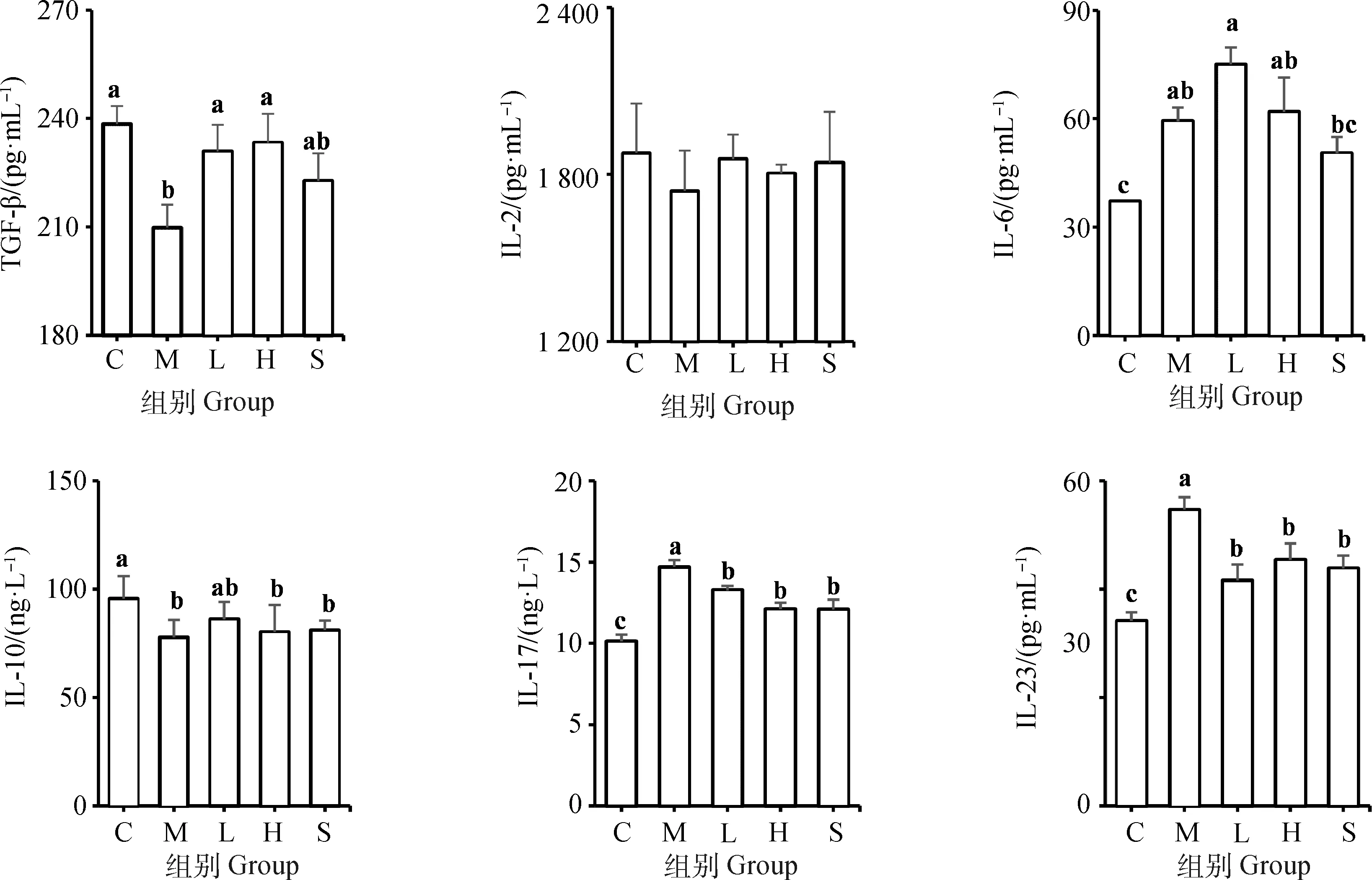
C.空白组;
M.模型组;
L.紫锥菊提取物低剂量组;
H.紫锥菊提取物高剂量组;
S.阳性药物组。图中字母不同表示各组间差异显著(P<0.05)C. Control group; M. Model group; L. Low-dose group of E. purpurea extract; H. High-dose group of E. purpurea extract; S. Positive medicine control group. The columns with different small letters mean significant difference (P<0.05), while with the same or no letter mean no significant difference (P>0.05)图4 大鼠血清炎性细胞因子水平的变化Fig.4 Changes of serum inflammatory cytokines in rats
2.5 大鼠主要脏器指数变化
与空白组相比,模型组大鼠心、脾与肺指数显著升高(P<0.05),胸腺指数升高但差异不显著(P>0.05)。与模型组相比,紫锥菊提取物高、低剂量组与阳性药物组大鼠心、脾、肺与胸腺指数均有降低的趋势,其中,紫锥菊提取物高剂量组大鼠的心指数显著降低(P<0.05),紫锥菊提取物低剂量组的肺、脾指数显著降低(P<0.05),阳性药物组的肺指数显著降低(P<0.05)。各治疗组大鼠胸腺指数降低但差异不显著(P>0.05)(表4)。

表4 大鼠脏器指数的变化Table 4 Changes of organ index in rats(n=8,
2.6 大鼠主要脏器的病理组织学变化
大鼠心、肝、脾、肺、肾、胸腺病理组织学检查结果如图5所示,空白组心肌纤维形态正常,无明显病理变化;
肝细胞均为正常形态,肝索排列整齐;
脾组织、细胞形态正常,红髓、白髓界限清晰;
肺的组织界限清晰,肺泡隔、肺泡腔、肺间质均显示形态正常,无异常细胞浸润;
肾小球、肾小囊、肾小管均形态正常;
胸腺组织结构正常,无明显病理变化。

C.空白组;
M.模型组;
L.紫锥菊提取物低剂量组;
H.紫锥菊提取物高剂量组;
S.阳性药物组。扫描文章首页OSID码可查看彩图C. Control group; M. Model group; L. Low-dose group of E. purpurea extract; H. High-dose group of E. purpurea extract; S. Positive medicine control group. The color picture can be found by scanning the OSID code on the front page of the article图5 大鼠心、肝、脾、肺、肾、胸腺病理组织切片图(HE,200×)Fig.5 Pathological sections of heart, liver, spleen, lung, kidney and thymus in rats(HE,200×)
模型组可见心组织出现出血瘀血现象(图5中箭头);
肝组织结构正常,部分肝细胞出现水肿现象,细胞界限不清;
脾出现红细胞沉积,显示脾陈旧性出血(图5中箭头);
肾小球上皮细胞变性坏死,可见炎性细胞增生浸润(图5中箭头);
肺与胸腺无明显病理变化。
紫锥菊提取物高、低剂量组可见心肌纤维结构正常,肝、肾组织形态正常;
脾出血情况有所好转,趋于正常。阳性药物组部分肝细胞出现变性坏死,可见组织水肿;
脾淋巴细胞稀疏,出现水肿现象;
肾组织间出现大面积蛋白尿的沉积(图5中箭头)。
2.7 大鼠结肠TGF-β1、Foxp3、RORγt mRNA相对表达量
与空白组相比,模型组的TGF-β1与Foxp3 mRNA表达量显著下降(P<0.05),而RORγt mRNA表达显著上升(P<0.05)。与模型组相比,紫锥菊提取物高、低剂量组的TGF-β1与Foxp3 mRNA表达显著上升(P<0.05),紫锥菊提取物高、低剂量组与阳性药物组的RORγt mRNA表达显著下降(P<0.05)(表5)。
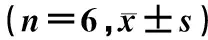
表5 各组大鼠结肠TGF-β1、Foxp3和RORγt mRNA表达水平Table 5 Colon TGF-β1, Foxp3 and RORγt mRNA expression level in each group (n=6,
畜禽湿热泄泻通常表现为机体津液黏腻,舌色赤黄且苔厚,小便短少,并伴随着剧烈泄泻,腹部肠鸣如雷,粪便质如稀粥且混有黏液,粪便味臭等。湿热泄泻动物模型的建立结合了现代兽医学的“病”与中兽医学的“证”,本研究中湿热泄泻模型大鼠不仅出现腹泻和黏液便等病理变化,同时还出现精神沉郁、舌苔黄厚、粪便黏腻等临床证候整体特征[5]。紫锥菊具有清热凉血、疏风散邪的功效,现代药理学研究证明,紫锥菊有免疫调节、抗炎、抗真菌、抗病毒和抗氧化等作用,并有研究表明,紫锥菊醇提取物有降血压、降血脂的作用[9-10]。本研究采用紫锥菊提取物治疗湿热泄泻大鼠,结果表明,紫锥菊提取物具有缓解湿热泄泻大鼠临床症状的效果,各治疗组在试验过程中其临床症状评分随时间出现明显下降的趋势,且治疗结束时各治疗组评分均低于模型组,其中,紫锥菊提取物低剂量组的评分显著低于模型组,且效果优于高剂量紫锥菊提取物与阳性药物。紫锥菊提取物高、低剂量组与阳性药物组大鼠体重在治疗过程中缓慢增长,接近正常水平,饮水量与采食量也处于正常范围内。提示大鼠经紫锥菊提取物治疗后,其湿热泄泻症状与体征得到明显改善,机体逐步恢复正常,且低剂量的紫锥菊提取物有更好的治疗效果。
脾是淋巴细胞接受抗原刺激和发生免疫应答的重要场所,也是T、B细胞发育的重要场所,脾和胸腺重量的异常可导致动物免疫功能的降低[11-12]。本研究中,经紫锥菊提取物治疗后,湿热泄泻大鼠心、肺、脾、胸腺指数回调,且紫锥菊提取物低剂量组的肺、脾指数显著低于空白组,说明紫锥菊提取物对湿热泄泻大鼠的免疫机能和心肺功能具有调节作用。
血常规指标检测中,主要参与机体防卫功能的WBC具有免疫反应和吞噬作用,其中,NEU数目的异常提示可能发生急性感染或炎症,RBC可以为机体输送氧气与二氧化碳,调节血液酸碱度,并起到免疫调节的作用[13-14]。有研究表明腹泻会导致白细胞病理性的升高或降低,并出现血小板降低的现象[15]。本研究中紫锥菊提取物可以改善湿热泄泻大鼠显著降低的RBC、HGB、HCT含量与降低的WBC、NEU含量,说明感染大肠杆菌的湿热泄泻模型大鼠机体引起炎症反应。而紫锥菊提取物具有改善自身细胞的炎性损伤和缓解应激作用。
血液生化学的一些指标能够对疾病的诊断起到辅助作用,其中,血清TP与ALB由肝合成,具有输送各种代谢产物、维持机体胶体渗透压等生理功能,从而对机体起到免疫调节作用[16]。ALT、AST、TG、TC等指标反映了肝功能情况,ALT是位于肝细胞胞质的胞质酶,而AST通常位于肝细胞线粒体中,当肝受损较轻时细胞膜通透性增加引起细胞质内ALT释放,肝细胞受损严重时才释放线粒体内AST[17]。UREA与CREA是反映肾功能的重要指标,当肾发生炎症或肾功能不全时,UREA与CREA由于无法排出体外而累积过多[18]。本研究中,紫锥菊提取物能够提高由于湿热泄泻造模过程造成的UREA、ALT、AST、TC、TG、TP、ALB水平的降低,说明造模过程中饮食过度肥甘厚腻损伤机体肝肾功能,引起血脂上升,而紫锥菊提取物能够回调紊乱的血生化指标,具有一定的抗损伤保肝作用。
Th17分泌的IL-17可以调控下游细胞因子和趋化因子,与炎症反应和自身免疫性疾病密切相关[19]。机体受到外源性抗原刺激时,树突状细胞以及巨噬细胞会被激活而产生IL-23[20]。TGF-β能上调Foxp3的表达,促进通过细胞接触依赖机制Treg细胞的分化,发挥免疫调节功能[21-23]。经过紫锥菊提取物与阳性药物的治疗,各治疗组血清IL-17、IL-23水平显著降低,TGF-β水平显著升高,说明紫锥菊提取物可抑制湿热泄泻大鼠分泌过多的炎性介质,减少炎性细胞因子的表达,使机体促炎与抑炎细胞因子逐步恢复平衡状态[24-25]。促进Th17细胞增殖分化的RORγt通过抑制效应T细胞诱导机体炎症,Foxp3通过诱导Treg细胞增殖分化调节机体的免疫系统,研究表明,Treg细胞能通过调控肠道T细胞的活化从而调节小鼠的肠道免疫反应[26-27]。本试验中紫锥菊提取物可显著上调湿热泄泻大鼠结肠TGF-β1、Foxp3 mRNA水平,降低RORγt mRNA水平,调节失衡的Th17/Treg,改善机体炎症反应,从而发挥对湿热泄泻的治疗效果[28-29]。
本研究中,湿热之邪主犯胃肠道,但对其他脏腑也有一定损害,湿热泄泻模型大鼠的心、肝、脾、肾等脏器均有不同程度的病理学变化,心出现大面积瘀血,肝水肿,脾水肿,肾出现炎性细胞浸润及蛋白尿的沉积。经紫锥菊提取物治疗后,受损脏器的病理变化减轻或消失,基本恢复正常。提示紫锥菊提取物对湿热泄泻大鼠脏器水肿、炎性细胞浸润及瘀血均有一定程度的缓解作用[30]。
紫锥菊提取物能够通过降低血脂、调节血清炎性因子水平及改善脏器功能,以改善湿热泄泻大鼠的临床症状,其中,低剂量的紫锥菊提取物在降低血清IL-17、IL-23水平与结肠TGF-β1 mRNA、RORγt mRNA表达方面对缓解大鼠湿热泄泻的效果更好。
猜你喜欢 低剂量提取物阳性 虫草素提取物在抗癌治疗中显示出巨大希望中老年保健(2022年2期)2022-08-24食品核酸阳性情况为何突然变多大众科学(2022年7期)2022-08-19中药提取物或可用于治疗肥胖中老年保健(2021年5期)2021-12-02抛开“阳性之笔”:《怕飞》身体叙事评析英美文学研究论丛(2018年2期)2018-08-27神奇的落叶松提取物现代营销(创富信息版)(2018年2期)2018-08-15紫地榆提取物的止血作用中成药(2017年10期)2017-11-1616排螺旋CT低剂量扫描技术在腹部中的应用中国医药指南(2017年3期)2017-11-13MALDI-TOF MS直接鉴定血培养阳性标本中的病原菌老年医学与保健(2017年6期)2017-02-06探讨甲状腺自身抗体阳性甲亢病的131I 治疗与甲减关系中国继续医学教育(2015年1期)2016-01-06自适应统计迭代重建算法在头部低剂量CT扫描中的应用天津医科大学学报(2015年2期)2015-12-22推荐访问:泄泻 湿热 提取物