FAM83H,及其天然反义转录本FAM83H-AS1在肺腺癌和卵巢癌发生发展中的作用
来源:优秀文章 发布时间:2023-03-10 点击:
刘梦真 孙蓉蓉 刘艳华 张有为
1.徐州医科大学临床学院,江苏徐州 221009;
2.江苏省徐州市中心医院肿瘤内科,江苏徐州 221009
恶性肿瘤已成为我国居民的主要死因,探索肿瘤发生发展中的关键基因具有重要意义[1]。FAM83H 位于染色体8q24.3,是FAM83 家族成员之一,最初因其在牙齿发育中的重要作用被关注,FAM83H 在肝细胞癌、肾癌、胃癌、胰腺癌和宫颈癌等肿瘤中高表达,并促进癌细胞的生长、侵袭和转移[2-6]。FAM83H-AS1 位于FAM83H 的对侧,是其天然反义转录本,二者以头对头(5’-5’)形式互补重叠。研究表明,FAM83H-AS1 是多种肿瘤潜在的诊断、预后标志物和治疗靶点[7-9]。本研究拟在泛癌种水平研究FAM83H 和FAM83H-AS1 在肿瘤发生发展中的生物学作用。
1.1 实验材料
CCK-8 购于Signalway Antibody(CP002);
Transwell小室购于Costar(3422);
Trizol 购于美国Invitrogen 公司(1596026);
逆转录试剂盒购于Fermentas(#K1622);
SYBR Green PCR 试剂盒(#K0223)、BCA 蛋白定量试剂盒(PICPI23223)、兔抗人FAM83H 多克隆抗体(PA5-55094)购于Thermo;
兔抗人GAPDH 单克隆抗体(#5174)购于CST;
羊抗兔HRP 标记二抗(A0208)、Annexin V-FITC 细胞凋亡检测试剂盒(C1036)购于上海碧云天生物技术有限公司。
1.2 生物信息学分析
在线分析FAM83H 基因在恶性肿瘤中的表达及预后,测试数据集来自基因表达谱动态分析(gene expression profiling interactive analysis,GEPIA)工具(http://gepia2.cancer-pku.cn)[10]。
1.3 细胞培养和转染
siFAM83H 与siFAM83H-AS1 干涉载体由上海基尔顿生物公司构建。A549、SKOV3 细胞均用含10%胎牛血清的RPMI-1640 培养基在37℃,5%CO2培养箱中培养。取对数生长期的细胞进行转染,分为空载对照组(siNC 组)和实验组(siFAM83H 组、siFAM83H-AS1组),同时设置空白对照组(control 组),细胞转染利用脂质体Lipofectamine 2000(美国Invitrogen 公司)介导的方法,转染48 h 后进行后续实验。本研究所有实验步骤均重复3 次。
1.4 Real-time PCR 实验
胰酶消化并收集各组细胞,Trizol 试剂盒提取总RNA,并对提取的RNA 进行浓度和纯度检测。在37℃60 min、85℃5 min、4℃5 min 的条件下,将RNA 逆转录合成cDNA。将合成的cDNA 按Real-time PCR 试剂盒说明书进行扩增,PCR 扩增:95℃10 min(95℃15 s,60℃45 s),40 个循环;
熔解曲线:95℃15 s,60℃1 min,95℃15 s,60℃15 s;
以GAPDH 作为内参,检测FAM83H、FAM83H-AS1 的表达。引物序列见表1。

表1 引物序列
1.5 Western blot 检测
RIPA 法提取细胞总蛋白,BCA 法检测蛋白浓度。上样后SDS-PAGE 凝胶电泳,转膜至PVDF 膜,5%脱脂奶粉室温封闭1 h,一抗室温孵育2 h,TBST 洗涤3 次,每次5 min,二抗(1∶1 000)37℃孵育1 h,TBST 洗涤3 次,每次5 min,ECL 系统显影(GAPDH 作内参)。
1.6 CCK-8 检测细胞增殖
胰酶消化细胞,镜下记数将细胞悬液浓度调整为3×104个/ml。按3×103个/孔,将细胞种至96 孔培养板,设置3 个复孔。在转染0、24、48、72 h 后,加入CCK-8 试剂,酶标仪检测细胞在450 nm 波长下的吸光度值。
1.7 流式细胞术检测细胞凋亡
转染后的细胞用胰酶消化,计数后制备成1×106个/ml的细胞悬液,取1 ml 悬液离心收集细胞,Annexin V-FITC 结合液重悬细胞,4℃避光孵育15 min后,加入碘化丙啶染色液,4℃避光孵育5 min 后,进行流式细胞仪检测。
1.8 Transwll 检测细胞迁移
胰酶消化细胞,用含1% FBS 的培养基制备3×105个/ml 的细胞悬液,每个Transwell 小室接种300 μl细胞悬液,下层加入700 μl 的含10% FBS 的培养基,每组细胞设置3 个复孔。培养24 h 后,取出小室,PBS 清洗2 次,甲醛固定10 min,PBS 洗涤2 次,0.5%结晶紫染色30 min,PBS 洗涤3 次,晾干后于显微镜下观察拍照(200×),计数不同视野下的细胞数取平均值。
1.9 统计学方法
采用SPSS 21.0 软件进行数据分析。计量资料用均数±标准差()表示,比较采用t 检验;
计数资料用百分率表示,比较采用χ2检验。以P<0.05 为差异有统计学意义。
2.1 FAM83H、FAM83H-AS1mRNA 在泛癌种水平的表达
GEPIA 在线工具分析结果显示,FAM83H mRNA在乳腺浸润癌、胸腺瘤、肺腺癌(lung adenocarcinoma,LUAD)、肺鳞癌、肝细胞癌、胃癌、胰腺癌、结肠癌、膀胱尿路上皮癌、直肠癌、宫颈鳞癌和腺癌、子宫内膜癌和子宫肉瘤、卵巢浆液性囊腺瘤(ovarian serous cystadenocarcinoma,OV)中表达上调;
在多形成性胶质细胞瘤、急性髓系白血病和皮肤黑色素瘤中表达下调。FAM83H-AS1 mRNA 在膀胱尿路上皮癌、乳腺浸润癌、宫颈鳞癌和腺癌、结肠癌、LUAD、肺鳞癌、OV、胰腺癌、前列腺癌、直肠癌、胃癌、子宫内膜癌和子宫肉瘤中表达上调,在急性髓系白血病、皮肤黑色素瘤和睾丸癌中表达下调。见图1。
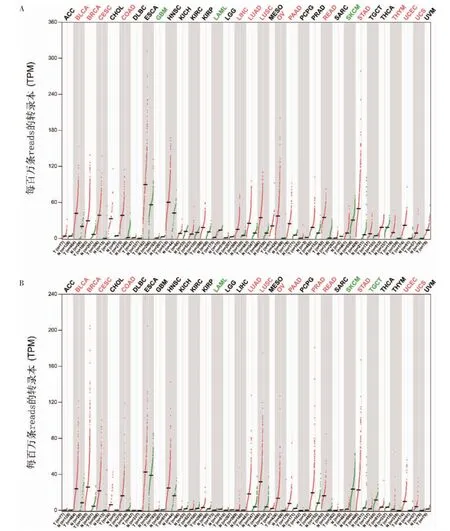
图1 FAM83H、FAM83H-AS1 mRNA 在泛癌种水平的表达
2.2 FAM83H、FAM83H-AS1 mRNA 表达与LUAD和OV 的预后
在LUAD 中,FAM83HmRNA 高表达组与低表达组生存曲线比较,差异有统计学意义(P<0.05)。见图2。

图2 FAM83H、FAM83H-AS1 mRNA 表达与LUAD 和OV 的预后
2.3 FAM83H、FAM83H-AS1 敲低后各组FAM83H、FAM83H-AS1 表达比较
A549 和SKOV3 细胞中,siFAM83H 组FAM83H mRNA 及蛋白表达低于siNC 组(P<0.05);
siFAM83HAS1 组FAM83H-AS1 mRNA 表达低于siNC 组(P<0.05)。见图3。

图3 FAM83H、FAM83H-AS1 敲低后各组FAM83H、FAM83H-AS1 表达比较(n=3)
2.4 FAM83H、FAM83H-AS1 敲低后各组细胞增殖能力比较
A549 和SKOV3 细胞中,siFAM83H 组转染24、48、72 h 后细胞增殖能力低于siNC 组(P<0.05)。siFAM83H-AS1 组转染24、48、72 h 后细胞增殖能力低于siNC 组(P<0.05)。见图4。

图4 FAM83H、FAM83H-AS1 敲低后细胞增殖能力比较(n=3)
2.5 FAM83H、FAM83H-AS1 敲低后各组细胞凋亡数量比较
A549 和SKOV3 细胞中,siFAM83H 组、siFAM83HAS1 组凋亡数量高于siNC 组(P<0.05)。见图5。

图5 FAM83H、FAM83H-AS1 敲低后各组流式结果
2.6 FAM83H、FAM83H-AS1 敲低后各组细胞迁移数比较
A549 和SKOV3 细胞中,siFAM83H 组、siFAM83HAS1 组细胞迁移数低于siNC 组(P<0.05)。见图6。

图6 FAM83H、FAM83H-AS1 敲低后各组Transwll 检测结果(结晶紫染色,200×)
2.7 FAM83H、FAM83H-AS1 表达的关联性
FAM83H 与FAM83H-AS1 以头对头(5’-5’)形式互补重叠,推测二者存在相互调控关系。A549 和SKOV3细胞中,FAM83H 后敲低,siFAM83H 组 与siNC 组siFAM83H-AS1 mRNA 比较,差异无统计学意义(P>0.05);
FAM83H-AS1 敲低后,siFAM83H-AS1 组 与siNC 组siFAM83HmRNA 和蛋白比较,差异无统计学意义(P>0.05)。见图7。尚不能认为FAM83H 与FAM83HAS1 之间存在调控关系。

图7 FAM83H、FAM83H-AS1 表达的关联性(n=3)
本研究结果显示,FAM83H 和FAM83H-AS1 在多种肿瘤中上调,敲低FAM83H 或FAM83H-AS1 后,可抑制A549、SKOV3 细胞增殖和迁移,诱导细胞凋亡。提示二者在LUAD 和卵巢癌中具有癌基因的作用。
既往研究证实,FAM83H 基因在人类多种肿瘤中表达上调,且与不良预后相关,其机制涉及不同信号通路[11-13]。肝细胞癌中FAM83H 诱导细胞周期蛋白和基质金属蛋白酶-2 表达,癌基因MYC 结合到FAM83H 启动子区,促进其转录[2];
胃癌中FAM83H 与Scrib 表达密切相关,FAM83H 和Scrib 可能通过稳定β-catenin 参与胃癌的进展[4];
胰腺癌中FAM83H 过表达与CD8+T 细胞浸润减少及Ras-PI3K-mTOR 信号通路有关[5];
FAM83H 在非小细胞肺癌组织中的表达增加,与患者的临床分期密切相关[14]。但FAM83H在卵巢癌中的表达尚未见报道,而本研究首次明确FAM83H 在LUAD 和卵巢中的生物学功能。
FAM83H-AS1 作为FAM83H 的天然反义转录本,其表达升高促进肿瘤发生发展[15-17]。FAM83H-AS1是LUAD 组织明显上调的长链非编码RNA 之一,FAM83H-AS1 通过调控Met/EGFR 信号,促进肺癌细胞增殖、侵袭和转移[18];
FAM83H-AS1 还可以结合hnRNP K 以增强抗凋亡基因RAB8B 和RAB14 的翻译,从而抑制LUAD 凋亡[19]。FAM83H-AS1 在卵巢癌组织中高表达,其表达水平与巨噬细胞、中性粒细胞、树突状细胞等免疫细胞浸润程度相关,下调其表达可明显抑制卵巢癌细胞的增殖和侵袭[20-21];
此外,FAM83HAS1 通过稳定HUR 蛋白参与卵巢癌的辐射抵抗和细胞转移[22]。本研究进一步证实FAM83H-AS1 在LUAD和卵巢癌中的生物学功能。
有研究报道,内源性反义长链非编码RNA 参与人类细胞基因表达的表观遗传调控[23],其表达水平与宿主基因的表达水平呈正相关或负相关,提示编码和非编码转录本在特定的生物学途径中存在协同调节[24]。在食管癌中,FAM83H-AS1 与其正义链FAM83H在转录和翻译水平上存在一致性调节,FAM83H-AS1可能通过调控FAM83H 的表达而发挥癌基因作用[25]。尽管FAM83H 与FAM83H-AS1 在泛癌种水平的表达趋向一致,但是本研究未在细胞水平证实二者对彼此表达的影响,FAM83H 与FAM83H-AS1 可能独立发挥作用,具体机制仍待进一步研究。
猜你喜欢 悬液卵巢癌试剂盒 miR-181a在卵巢癌细胞中对顺铂的耐药作用昆明医科大学学报(2022年1期)2022-02-28农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-30穴位贴敷联合布洛芬混悬液治疗小儿外感发热健康之家(2021年19期)2021-05-23试剂盒法制备细胞块的效果及其技术要点天津医科大学学报(2019年6期)2019-08-13薯蓣皂苷元纳米混悬液的制备中成药(2017年9期)2017-12-19基于CLSI-M43国际标准改良的Mycoview-AST试剂盒检测性能评估现代检验医学杂志(2016年2期)2016-11-14CXXC指蛋白5在上皮性卵巢癌中的表达及其临床意义中国癌症杂志(2015年4期)2015-12-09卵巢癌脾转移的临床研究进展肿瘤预防与治疗(2015年2期)2015-09-26microRNA与卵巢癌转移的研究进展医学研究杂志(2015年4期)2015-06-10雾化吸入布地奈德混悬液治疗COPD急性加重期的效果观察中国当代医药(2015年20期)2015-03-01推荐访问:转录 腺癌 作用