纳米银在水产养殖中潜在生态毒性的研究进展
来源:优秀文章 发布时间:2023-03-01 点击:
李 婧 ,朱小燕,何俊毅,孔庆玲,宋阳平,陈菲菲,钱梦雨,王士岩,刘 培,金诗语,李相前
(淮阴工学院生命科学与食品工程学院,江苏省益生制剂重点建设实验室,江苏淮安 223003)
AgNPs是广泛应用的纳米材料之一,它能附着在细胞壁和细胞膜上,使其形态异常,通过物理作用,破坏其完整性,并与有氧代谢酶结合,使细胞死亡,因此具有广谱抗菌性能,通常用于水处理和生物医学领域,包括抗菌剂和抗炎剂[1-2]。此外,AgNPs进入水环境后,周围会产生活性氧(ROS)并溶解出银离子进一步增强毒性,这引起了水产养殖业的广泛关注,在水产养殖业中可以用于水处理、池塘杀菌和水生疾病防治等方面,例如杀灭南美白对虾体内的白斑综合征病毒和弧菌属细菌[3-6]。然而,有研究表明AgNPs在水生生态系统中会对鱼类、微生物以及浮游动植物的生长产生抑制作用[7-8],同时通过各种途径(如呼吸、进食等)在不同生物体内迁移,对长期暴露在其中的生物体有复杂且持久的毒性影响[9]。文章综述了AgNPs在水环境中的毒性效应以及影响因素,对微生物、浮游动植物、鱼、虾、蟹等水生生物的毒性影响,并对未来的研究方向提出了对策。
1.1 AgNPs毒性的影响因素
在进入水环境后AgNPs毒性的影响因素主要由多方面构成,包括粒径、pH、光照、氧化溶解、温度、团聚、晶体状态和产生活性氧自由基的能力等。
首先,细胞对AgNPs的摄取率与粒径大小具有较大关系,Zhao[10]研究表明大型溞(Daphniamagna)对AgNPs的吸收速率展现出20nm>50nm>100nm的特点,15nm的AgNPs所造成的毒性明显大于50nm和100nm。研究表明,小粒径的AgNPs具有更大的比表面积和反应活性,具有更强的毒性[11-12]。
其次,AgNPs在水环境中的溶解度和团聚状态会发生改变,包括氧化溶解、团聚、氧化还原(硫化和氯化)、吸附等。其中,氧化溶解是AgNPs转化的主要途径。AgNPs在水环境中的前6hrs毒性占59%,之后42hrs银离子毒性占57%。由于银离子浓度的增加伴随着AgNPs浓度降低,在持续暴露时,银离子毒性占主导地位[13]。Yin等[14]研究了相同浓度的AgNPs与硝酸银溶液对植物体所产生的毒理学影响,结果表明除了AgNPs本身的毒性外,溶解出来的银离子释放所产生的生物毒性分显著。AgNPs在不同环境下形态、溶解状态、聚集状态、抗氧化性均会改变,导致毒性差异。碱性物质会使部分银离子转化为AgNPs,因此pH同样影响AgNPs的稳定性和银离子浓度,当pH=6的时候,AgNPs的毒性相对较高;
当pH=9的时候,毒性明显下降[15]。氧气浓度或温度高时,AgNPs更易溶解,毒性增强[16-17]。此外,光照使AgNPs其氧化,表面形成氧化层增强银的释放,同时产生活性氧自由基,进一步增强毒性[18-21]。团聚会改变水环境中AgNPs和银离子的浓度,从而导致暴露剂量和吸收速率的变化[22-24]。AgNPs的团聚效应受纳米银粒径、形貌、类型及在水体吸附中的pH等影响,小粒径AgNPs比表面积大,容易产生团聚效应,高pH会降低AgNPs表面上的ζ电势,也容易产生团聚效应[25-26]。
1.2 AgNPs对生态毒性的影响
在水环境中,AgNPs会和环境因素或生物因素相互耦合,并间接产生一系列复杂的环境生态毒理效应。由于AgNPs结构性质不同,进入水环境后又会产生不同形式的迁移和代谢转化,并且其衍生物、生物代谢物以及释放出的银离子同样对生态系统产生毒理效应。银离子在生物体中有很大的生物富集倾向,因为银离子的化学性质使它们能够通过类似于钠离子通道的细胞膜离子转运体吸收。Jiang等[27]研究发现,在水环境中,AgNPs主要沉积在表层底泥中,并在微生物和浮游动植物中大量积累,因此会通过食物链在不同营养级上传递。
2.1 AgNPs对病原微生物的毒性效应
AgNPs具有广谱抗菌性,可杀灭数百种病原微生物。其在与病原体的细胞壁、细胞膜结合后,可直接进入细胞,迅速与氧代谢酶结合,使酶失活,阻断病原体的呼吸代谢,最终导致病原体窒息死亡[28]。即使低浓度的AgNPs也能抑制大多数病原微生物的生长[29]。表1列举了AgNPs对多种微生物的毒性效应。
Gogoi等发现[30]小于20nm的AgNPs可与细胞膜发生反应,使细胞膜失去正常功能直至死亡。高于25mg/L的AgNPs可以完全抑制大肠杆菌(Escherichiacoli)和金黄色葡萄球菌(Staphylococcusaureus)的生长[31]。Yilma 等[32]发现沙眼衣原体(Chlamydiatrachomatis)感染的巨噬细胞中诱导出的10nm的AgNPs降低了肿瘤坏死因子和白细胞介素的水平。Manikandan等[33]研究发现20nm的AgNPs随着浓度的增加,链球菌(Streptococcus),乳酸球菌(Enterococcusfaecalis),大肠杆菌,肺炎克雷伯菌(Klebsiellapneumoniae)以及一些耐药菌株细胞活力下降。Akter等[34]发现6nm~24nm 的AgNPs对病原体表现出很强的抗菌活性。对大肠杆菌和铜绿假单胞菌(Paenarthrobacternicotinovoran)的最低抑菌/杀菌浓度分别为6.25mg/L/50mg/L和612.5mg/L/50mg/L。AgNPs对抗生素耐药菌也具有杀菌效果,避免了细菌耐药性的形成。此外,AgNPs粒径小,可渗透入深层组织灭杀病原微生物,同时还具有加速伤口愈合、促进损伤细胞再生与修复、加速组织生长、减少疤痕形成等作用[35]。

表1 AgNPs对病原微生物的毒性效应
2.2 AgNPs对浮游动植物的毒理效应
AgNPs对浮游植物光合作用产生了负面影响,这是因为AgNPs破坏了放氧复合体(OEC)和类囊体膜,促进了ROS的清除能力。Coll等[39]验证了淡水中的各类生物在AgNPs加入早期阶段,受到AgNPs的毒性影响较大,并运用概率物种敏感度分布法(pSSDs),得出不同物种对AgNPs敏感程度不同的结论。Huang等[40]发现蓝藻暴露于1mg/L AgNPs下生长受到抑制。AgNPs对浮游动物的毒理学作用主要表现为对水生浮游动物器官的神经毒性[41]。Yan 等[42]发现AgNPs可以通过大型蚤母体(Daphniamagna),繁殖转移到下一代,并会抑制F0代和F1代幼体的体外繁殖能力。An等[43]研究了70nm~92nm AgNPs在卤虫(Artemiasalina)中的急性暴露实验,发现100mg/L AgNPs暴露72 hrs的虾的死亡率为100%(表2)。

表2 AgNPs对浮游动植物的毒理效应

续表2
2.3 AgNPs对鱼类的毒性效应
水生环境包含由生产者(微生物与浮游植物)和初级消费者(浮游动物)和次级消费者(鱼类)组成的食物链。AgNPs作为抑菌剂,通过各种渠道释放到水环境中,最终在鱼类体内富集。鳃是呼吸和渗透调节的器官,其结构和功能特点使鳃容易受到AgNPs的破坏[57]。一些研究表明,AgNPs可以通过鳃的呼吸作用进入鱼体内,破坏鳃内组织和鳃膜,导致呼吸应激,基因表达受损身体畸形以及其他问题[58-62]。Li等[63]发现AgNPs会导致鳃片层排列不规则、毛细血管扩张,并显著调节鱼鳃中96种差异表达的代谢物。Mohsenopur 等[64]研究发现AgNPs照射96hrs后,孔雀鱼鳃部出现增生、肥厚、充血、出血、坏死等现象。AgNPs被动扩散到鱼的胚胎中,影响胚胎发育,产生眼尾畸形、卵黄囊水肿、脊柱弯曲和心脏畸形等病变,此外还会破坏鱼鳃神经结构,引起鱼胚胎呼吸障碍和神经毒性疾病[65-67]。斑马鱼(Daniorerio)胚胎是一种常见的体内毒性分析模型,常用于观察化学物质和纳米颗粒对生物体的毒性。进入斑马鱼的AgNPs通常富集在斑马鱼的肝脏、鳃和头部,这往往导致呼吸频率增加以及过度鳃盖运动和黏液分泌。Griffitt等[68]对斑马鱼胚胎进行了多项毒理学试验,发现当暴露于平均粒径约26.6nm的AgNPs时,受精后48hrs的斑马鱼胚胎的半致死浓度(LC50)为7.20mg/L。Bilberg等[69]研究证实斑马鱼胚胎暴露于PVP包裹的81nm AgNPs,受精后48hrs的LC50为84μg/L,毒性高于Griffitt等[68]的研究结果。Yen等[70]研究发现暴露于10nm的AgNPs,受精后96hrs斑马鱼胚胎的LC50为6.1mg/L。斑马鱼胚胎在受精后48hrs的LC50差异较大,可能主要是由于颗粒大小、表面涂层、被测生物种类的差异,以及暴露环境介质甚至环境条件的变化造成的。Cambier等[61]将斑马鱼胚胎暴露于AgNPs和硝酸银溶液中,比较急性和慢性暴露实验对胚胎的毒理学影响,发现AgNPs不能在细胞内积累并造成明显的毒性,AgNPs对斑马鱼胚胎发育的主要毒理作用是由溶解的银离子引起的。在鱼暴露于不同粒径的AgNPs后,AgNPs在不同的组织中积累[71],这种生物积累可能与氧化应激和组织学改变有关。不同的因素可以影响AgNPs对鱼类的毒性,如尺寸、形状、表面积、结构和释放的银离子等[72]。Bao等[73]研究发现AgNPs对斑马鱼肠道的毒性比对肝脏的毒性更大,雄性比雌性更容易受到AgNPs的影响。目前,AgNPs对鱼类的毒理学效应研究主要集中在鱼类急性暴露的研究上。随着AgNPs浓度的增加和暴露时间的延长,AgNPs在不同组织中的积累增加。Chae等[74]发现,在硝酸银和50nm AgNPs处理下,50nm AgNPs的LC50为25μg/L, 95%致死浓度(LC95)为50μg/L,高浓度AgNPs比硝酸银的毒性更大。Ali等[75]将虹鳟(Oncorhynchusmykiss)暴露于35nm~70nm AgNPs中,3d的LC50为1.48mg/L,在0.04mg/L和0.06mg/L浓度下25d后观察到鳃片表面坏死、变性、黏液物质分泌、细胞裂解和鳃片萎缩。非洲鲇鱼(Silurusasotus)暴露于100μg/L的40nm AgNPs中15d后产生严重的肝损伤[76](见表3)。

表3 AgNPs对鱼类的毒性效应
2.4 AgNPs对虾蟹类的毒性效应
虾蟹是底栖生物,易吸收污染物,常用于毒理学研究。AgNPs对虾和蟹的毒性机制包括外膜完整性的不稳定、膜电位的破坏、细胞毒性、遗传毒性、能量传导的中断和活性氧的形成[79]。在蟹和虾中,重金属污染物被隔离在肝胰脏、鳃和其他组织中[80],可以直接显示其毒性和积累水平 ,Maribel 等[81]对凡纳滨对虾进行了AgNPs急性暴露实验,发现肝胰脏中AgNPs的积累与AgNPs的添加量成正比,在角质层中也观察到AgNPs的少量积累,而在肌肉中积累不显著。克氏原螯虾(ProcambarusClarkii)暴露于250mg/L AgNPs溶液,死亡率为43.3%,高死亡率可能是由于AgNPs对鳃上皮的直接毒性作用,使克氏原螯虾出现缺氧、渗透调节压力变化等情况,抑制生命活动和免疫系统导致死亡[82](见表4)。
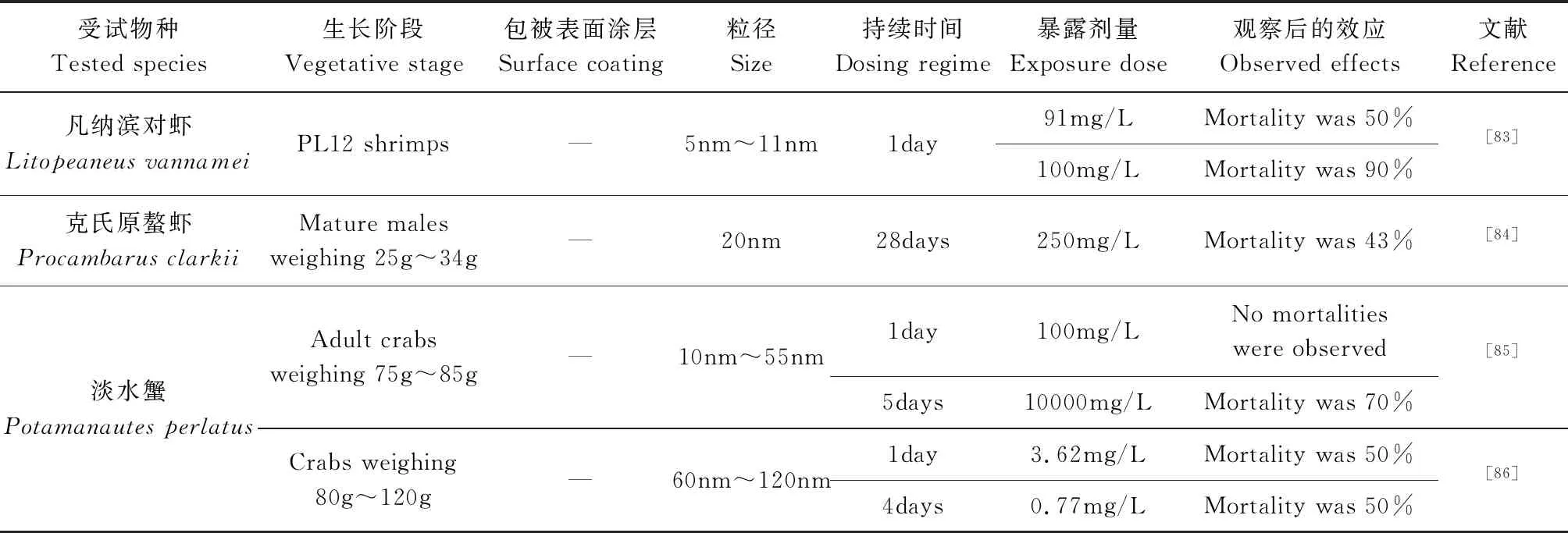
表4 AgNPs对虾蟹类的毒性效应
介于AgNPs拥有广谱抗菌、强效渗入杀菌和不产生耐药性的特点,同时还会结合其他物质增加毒性产生的作用时间和强度,现在被人们作为一种新型抗菌剂而广泛研究,未来可应用于水体环境治理和水生生物饲养的优化方面,在生态修复和经济生产等领域拥有良好的前景。但是,在抑菌作用同时,会在生物体内富集、迁移和代谢转化,有可能会引发复杂的生态毒性。目前,人们对此领域还亟待研究,需要大量的AgNPs对水生生物毒性作用的数据信息,在汇总编排后,建立数学模型以此系统的充分利用AgNPs的抗菌作用。今后在开展AgNPs毒性效应的研究工作中,应更偏向于一些细致性的工作。在未来的研究中,可以考虑改进的3个方向,即可通过AgNPs的浓度的降低,提高水生生物的生存率;
通过研究AgNPs对单个水生生物的影响了解对某个特定生物的毒理影响;
最终建立完整的实验模型,完善AgNPs在水环境中迁移转化规律的研究。