符合中药特点的安全性相关质量研究及质量控制
来源:优秀文章 发布时间:2023-03-01 点击:
郑天骄,韩 炜
符合中药特点的安全性相关质量研究及质量控制
郑天骄,韩 炜*
国家药品监督管理局 药品审评中心,北京 100022
“安全、有效、质量可控”是药物研发和评价的基本准则,保证药品安全更是前提和基础。中药作为药品的一种类型在安全性质量控制方面与其他药品具有共性要求,但也因其在中医药理论指导下使用且来源于植物、动物、矿物等原因,使其在降低不良反应、有害成分质量控制等方面存在自身特点。通过总结影响中药质量安全的因素及相关质量控制措施,提出重视人用经验对于中药安全性质量控制的重要作用,加强中药安全性风险识别、管理和控制等建议,以期为中药研发提供参考。
中药安全性质量控制;
内源性毒性成分;
外源性污染物;
炮制;
人用经验;
风险防控
《国务院办公厅关于全面加强药品监管能力建设的实施意见》(国办发[2021]16号)[1]中指出“药品安全事关人民群众身体健康和生命安全”,并提出“坚决守住药品安全底线,更好满足人民群众对药品安全的需求”“强化对药品中危害物质的识别与控制”的要求。因此,加强中药安全性质量研究和质量控制对于中药研发至关重要。
古往今来,通过对人用经验的总结及对现代中药的研究,逐渐发现了毒性药材、毒性成分及其作用机制,从而建立了针对内源性毒性成分的质量控制方法。同时,随着对药品全生命周期管理、源头控制、生产过程控制认识的逐渐深入,建立了针对重金属、农药残留、溶剂残留等外源性污染物的预防和控制措施。中药是在中医药理论指导下使用的药用物质,因此,其在安全性质量控制方面有自身特点。传统中药可通过配伍、炮制等方式减毒,并且中医理论认为有些毒性成分同时也是中药发挥药效的成分,因此对于该类成分的质量控制也有特殊要求。本文基于中药特点对研发过程中影响中药质量安全的因素以及中药安全性质量控制措施进行了探讨,并提出了相关思考和建议,以期为中药安全性质量研究和质量控制提供思路。
中药的质量涵盖从药材、饮片到最终制成制剂过程中的多个环节,包括药材种植或养殖、采收加工、炮制、制剂生产等,根据不同研究阶段的特点,对影响中药质量安全的主要因素进行了梳理。
1.1 基原混用
在中药的长期使用过程中,由于不同地区的用药习惯不同,存在同名异物、同物异名的现象,名称相似的药材互相代替的情况也时有发生,从而导致误用某种毒性药材。以木通为例,其有多种来源,如木通为木通科的木通(Thunb.) Decne.、三叶木通(Thunb.) Koidz.或白木通(Thunb.) Koidz. var.(Diels) Rehd.的干燥藤茎,川木通为毛莨科植物小木通Franch.的干燥藤茎及关木通为马兜铃科植物东北马兜铃Kom.的干燥藤茎等。其中,关木通含有毒性成分马兜铃酸,具有肾毒性,若误以关木通代替木通、川木通入药,则可能引起毒性反应。2003年4月1日,国家药品监督管理局发布了《国家药品监督管理局关于取消关木通药用标准的通知(国药监注[2003]121号)》[2],取消了关木通(马兜铃科)的药用标准,并要求将国家标准处方中的关木通替换为“木通(木通科)”,《中国药典》也自2005年版起未再收录关木通。除此以外,山豆根et与北豆根、五加皮与香加皮、何首乌与黄药子也易发生混用,可能带来安全性问题。来源于天然的中药存在物种多样性、近缘性等复杂因素,因此制备中药所用药材基原的准确性对于预防、减少不良反应的发生至关重要。
1.2 内源性毒性成分
古人在用药过程中逐渐发现了中药的毒性并对其进行分类,《神农本草经》按照“三品分类法”将收录的365种中药分为上、中、下三品:上品无毒,久服不伤人;
中品无毒有毒,斟酌其宜;
下品多毒,不可久服。《中国药典》沿用历代本草记载,将毒性药味分为“有大毒”“有毒”“有小毒”3类,作为临床用药的警示性参考,如川乌、马钱子、天仙子等按照药典毒性分类属于“有大毒”的药味。随着科技的进步和研究的深入,通过不良反应事件溯源和现代毒理研究总结,发现了毒性药味中的毒性成分,常见的毒性药味及毒性成分见表1。对内源性毒性成分的控制是保证中药安全性的关键,考虑到传统中医理论认为中药的“毒性”也是其发挥药效作用的“偏性”,因此内源性毒性成分的质量控制有其自身特点。
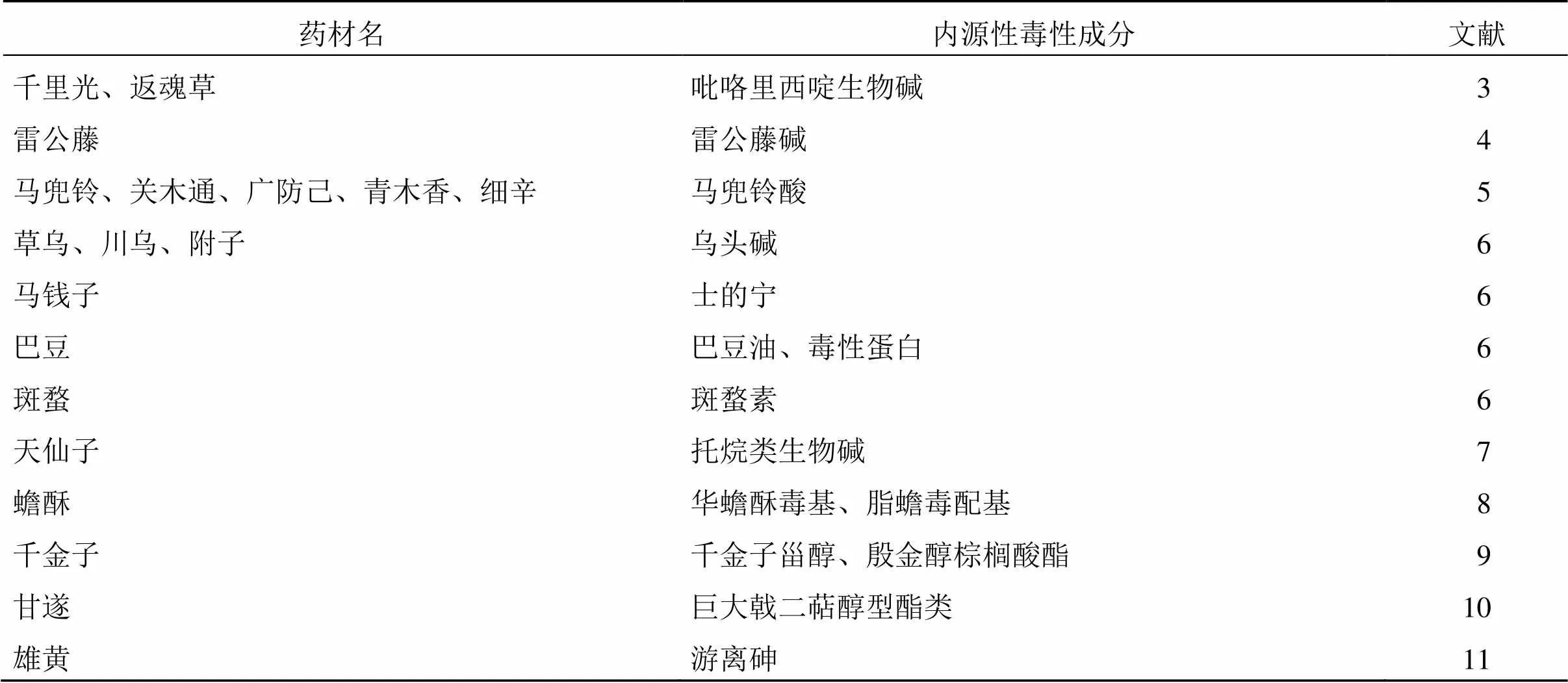
表1 常见毒性药材及其内源性毒性成分
1.3 外源性污染物
中药毒性并不都源自药材本身,由于中药是由天然的植物、动物、矿物加工制备而成,因此可能引入重金属、农药残留、真菌毒素、树脂残留、溶剂残留、微生物等外源性污染物。其来源主要有2种途径,一是在药材种植过程中使用的农药和植物生长调节剂、受土壤等自然因素影响而蓄积的重金属、放置过程中因储存不当而产生的微生物和真菌毒素及贮藏养护过程中使用的熏蒸剂和杀虫剂[12]等。二是药材在制成制剂的过程中,经提取、纯化等一系列制备工艺处理后残留的有机溶剂、树脂等有害物质。因此,在中药研发过程中应重视药材源头控制和生产过程控制,使制剂中所含外源性污染物的量最小化,从而降低中药的安全性风险。
药材、饮片、制剂的全过程质量控制是目前中药研发所倡导的理念,源头控制[13]、生产过程控制等针对不同阶段的质量控制措施贯穿始终,目的是为了保障制剂安全、有效、质量可控。因此,中药安全性相关质量控制措施的建立也需要依托全链条质量控制的思路,针对不同研发阶段可能涉及的影响中药安全性的因素建立相应的质控手段。
2.1 正本清源,保证药材基原准确
《中药新药研究各阶段药学研究技术指导原则(试行)》[14]中提出,在申请临床试验时药材基原应“明确”,III期临床试验前、申请上市时基原应“固定”,明确了中药新药用药材的基原是通过研究逐渐固定下来的,从而实现正本清源的目的,为保证不同研究阶段样品与申请上市制剂的质量一致提供了基础。因此,在中药新药的研发过程中应关注所用药材基原的准确性,避免出现因基原有误或不同基原混用而引发安全性问题。同时,应重视基原鉴定工作,对于基原易混淆品种,注册申报时需提供药材基原鉴定报告,并提供基原选用的依据,建议研究建立区别易混淆品种的专属性检测方法。
新疆、西藏地处我国边境,与多国为邻,地理位置具有特殊性,因此从国外进口药材的情况较为普遍,部分进口药材品种来源复杂、基原混乱、基础研究薄弱,对于此类药材毒性的认识尚不全面[15-16]。2019年5月16日,国家市场监管总局发布了《进口药材管理办法》[17],法规中明确规定了首次进口药材的备案资料要求,其中包括进口药材的基原鉴定资料:需提供由中国境内具有动、植物基原鉴定资质的机构出具的载有鉴定依据、鉴定结论、样品图片、鉴定人、鉴定机构及其公章等信息的药材基原鉴定证明原件。因此,研发过程中如需使用进口药材的,应加强对进口药材的溯源、管理和研究,关注基原的准确性和药材的不良反应。
2.2 根据内源性毒性成分类型,建立有针对性的质控措施
对于含有毒性成分的药材,部分法定药材标准中针对毒性成分明确的药材建立了相应的质量控制方法,并根据毒性成分是否同时为药效成分质控要求有所不同,如乌头碱类成分既是附子的毒性成分又是其药效成分,《中国药典》2020年版附子药材标准中建立了毒性成分双酯型生物碱的限量检查方法,规定“本品含双酯型生物碱以新乌头碱、次乌头碱和乌头碱的总量计,不得过0.020%”,另外还建立了3种单酯型生物碱的含量测定方法,规定“本品按干燥品计算,含苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱的总量,不得少于0.010%”[18]。矿物药雄黄中有效成分为二硫化二砷,毒性成分为三价砷和五价砷,《中国药典》2020年版雄黄药材标准中建立了三价砷和五价砷的限量检查项,规定“本品含三价砷和五价砷的总量以砷计,不得过7.0%”,建立了二硫化二砷含量测定项,规定“本品含砷量以二硫化二砷计不得少于90.0%”[18]。
对于处方中含有毒性药味的中药复方制剂新药,已发布的相关指导原则[19-20]中明确了针对内源性毒性成分的质量研究要求,提出了对于含毒性成分明确的药味,若为毒性成分而非药效成分,应建立毒性成分的限量检查方法,明确安全限量或规定不得检出,其限度可根据相应的毒理学或文献研究资料合理制定;
既是毒性成分又是药效成分时,则应根据文献报道和安全性、有效性研究结果制定毒性成分的含量范围(上下限)。对于含毒性明确但毒性成分尚不明确的药味时,应根据中医药理论和临床传统使用方法,研究确定其安全剂量范围,或开展毒性成分的确定性研究和药用物质毒理的深入研究,加强质量控制。中药新药质量标准研究是一个动态的过程,随着新药研究的不断推进而逐步完善。因此,在临床试验前应着重研究建立包括毒性成分在内的主要指标的检测方法,质量标准涉及安全性的指标应尽可能全面。由于中药成分复杂,不良反应有时并非由药物中的原型物质产生,而是某个成分的代谢产物导致,或某个成分进入人体后影响人体正常代谢等[21],建议加强代谢、毒理等多学科交叉研究,明确毒性反应的作用机制,从而有针对性地建立相关质量控制方法。
对于已上市多年的品种,由于上市时间较早,质量标准中可能缺少针对内源性毒性成分的质量控制方法,因此需逐步完善安全性相关检测项目,健全质量标准。对于毒性成分明确且检测方法成熟的,可在质量标准中增订相应的质控项目。以“九味羌活丸”为例,该品种自1977年开始收载于《中国药典》,其处方中含有马兜铃科的细辛且制备工艺为全粉入药,但至《中国药典》2015版均未建立马兜铃酸的限量检查方法。直到《中国药典》2020年版发布,九味羌活丸质量标准项下新增了马兜铃酸I的液相质谱联用限量检查方法,对马兜铃酸碎片离子的特征峰进行测定,规定:“应不得同时出现与对照品色谱保留时间一致的色谱峰;
若同时出现,则供试品中/359.0→298.0的色谱峰应小于对照品色谱峰(20 ng/mL)”[18]。自此,九味羌活丸质量标准中安全性相关检测项目得以完善。
另外,已上市中药在进行变更研究时同样应关注处方中含毒性药味的情况,以及变更对药品安全性的影响,有针对性地开展研究,具体要求可参考《已上市中药药学变更研究技术指导原则(试行)》[22]。
2.3 落实源头控制和生产过程控制,降低外源性污染物的安全性风险
药材作为中药生产的源头对于中药的质量和安全至关重要,正所谓“药材好,药才好”。曾经,为预防病虫害、增大产量而滥用农药、植物生产调节剂、熏蒸剂、杀虫剂等,未考虑不合理使用对药材质量以及制剂安全性的影响。随着时代的进步和观念的更新,药材外源性有害残留物的安全性问题逐渐受到了关注。农业部于2002年发布公告,明确了停止使用的农药种类,以及不得用于中药材的农药[23]。2022年发布的新版《中药材生产质量管理规范》第五十条规定:“禁止使用国务院农业农村行政主管部门禁止使用的剧毒、高毒、高残留农药,以及限制在中药材上使用的其他农药;
禁止使用壮根灵、膨大素等生长调节剂调节中药材收获器官生长”。第一百零六条规定:“明确贮存的避光、遮光、通风、防潮、防虫、防鼠等养护管理措施;
使用的熏蒸剂不能带来质量和安全风险,不得使用国家禁用的高毒性熏蒸剂;
禁止贮存过程使用硫磺熏蒸”[24]。《中国药典》自2000年版在甘草、黄芪药材标准中增加了9种有机氯农药的限量检查项,并在附录中增加了“有机氯类农药残留量测定法”;
《中国药典》自2015年版起“药材和饮片检定通则”增加了针对二氧化硫残留量的规定:药材及饮片(矿物类除外)的二氧化硫残留量不得过150 mg/kg。随着药典版本的更新,更多的农药种类和先进方法被收载,《中国药典》中关于有害残留物的质量控制体系正处于逐步建立完善的过程中[25]。因此,中药新药的研发应加强药材源头控制,参照《中药材生产质量管理规范》的要求进行药材种植养殖,加强对药材外源性污染物的研究。根据农业投入品的使用情况以及药材的自身特点进行风险评估,对农药、真菌毒素、养护用熏蒸剂和杀虫剂等有害残留物进行限量检测,制定合理的限度要求,从源头降低中药潜在的安全隐患。对于是否需要在制剂质量标准中建立针对药材所用农业投入品及可能含有的真菌毒素的检测项目,还需结合药材、饮片、制剂生产过程中的量质传递情况,对指标成分的影响、制剂自身特点以及残留物可能引发的安全性风险等综合评估判断。原粉入药的制剂由于药材粉末未经提取等溶剂、高温的处理而直接制成制剂,药材或饮片在贮藏过程中产生的微生物负载过高可能会转移到制剂中而导致制剂微生物超标,因此,在原料前处理时应结合药材中成分类型采用合理的方法、设备、条件等降低微生物污染水平[26]。
另外,中药生产过程中使用的溶媒、树脂等材料的残留也会影响中药的安全性。《中国药典》制剂通则“0861残留溶剂检测方法”中规定了药品常见的残留溶剂种类及限度要求,将溶剂分为3类,第1类为应该避免使用的溶剂,第2类为应该限制使用的溶剂,第3类为《药品生产质量管理规范》或其他质量要求限制使用的溶剂。基于此,在中药新药的研发过程中应合理选择溶媒,根据具体品种的工艺步骤对生产过程中溶剂残留情况进行研究,尽量降低溶剂残留量。另外,由于中药组成及成分复杂,存在为富集某一类成分而进行必要的纯化处理的情况,树脂则是最常见的纯化材料。树脂中含有未聚合的单体、交联剂、致孔剂等,且树脂种类、型号较多,骨架结构存在差异,因此一般应根据所使用树脂的类型在制剂质量标准中建立针对其残留物及裂解产物的限量检查方法。
2.4 规范毒性药味的炮制研究
“炮制”是中药区别于国外植物药的一大特色,对于降低药材的不良反应具有重要意义。在中药的长期使用过程中,通过总结用药经验,针对一些毒性药材形成了特定的减毒炮制工艺,如雄黄、朱砂水飞,巴豆、千金子制霜,半夏姜炙,斑蝥、红娘子米炒,马钱子砂炒等。有的毒性饮片具有多种炮制规格,如附子的炮制品包括黑顺片、白顺片、淡附片、炮附子等,炮制工艺不同,炮制用辅料也有区别,但均通过炮制降低药材的毒性。《中国药典》2020年版四部“0213炮制通则”中规定了常用的炮炙方法和要求,包括炒(清炒、麸炒、砂炒、蛤粉炒、滑石粉炒)、炙法(酒炙、醋制、盐炙、姜炙、蜜炙、油炙)、制炭(炒炭、煅炭)、煅(明煅、煅淬)、蒸、煮、炖、煨,除此以外还有燀法、制霜(去油成霜)、水飞、发芽、发酵。除药典规定的常用炮炙工艺,藏药、维药等民族药在用药过程中形成了一些特殊的炮制减毒方法,如维药中采用牛奶浸渍的方法将马钱子炮制成“奶制马钱子”[27],蒙药中使用诃子汤对乌头进行炮制[28]。毒性饮片的炮制工艺一般较为复杂,炮制不到位、不规范可能会影响药效的保留和毒性的降低,因此炮制工艺的合理性和规范性显得尤为重要。《中国药典》和地方炮制规范对于炮制火候、炒制程度等工艺步骤的描述往往相对简单,因此研究中应进一步细化炮制工艺参数,如炮制辅料的用量、炮制终点的判断等,不应仅凭经验确定炮制工艺。对于尚无国家标准和地方炮制规范收载的炮制品,应通过炮制工艺研究确定炮制工艺路线及关键工艺参数、炮制用辅料等,并采用合理的指标对炮制程度、饮片质量等进行评价,建立饮片质量标准。炮制过程中应平衡好毒性和药效的关系,确保炮制工艺的规范性和合理性。
另外,硫熏作为一种传统的加工方法常用于对药材、饮片的处理,尤其是对于淀粉、多糖含量较高的药材,可以提高干燥效率,降低因干燥时间过长而产生具有毒性的真菌毒素的风险[29]。由于二氧化硫同时也是一种毒性物质,因此需结合其对制剂质量、药效等的影响规定二氧化硫的合理残留限量。《中国药典》2020年版四部通则规定了药材及饮片的二氧化硫残留限量不得过150 mg/kg,对于毛山药、光山药、天冬、天花粉、天麻、牛膝、白及、白术、白芍、党参、粉葛的二氧化硫残留量相应的质量标准中规定不得过400 mg/kg,山药片不得过10 mg/kg。
3.1 重视人用经验对中药安全性质量控制的重要作用
为加强对古典医籍精华的梳理和挖掘,改革完善中药的审评审批机制,促进中药新药研发和产业发展,2020年9月28日国家药品监督管理局发布了《中药注册分类及申报资料要求》[30]将古代经典名方中药复方制剂单独分类,并细分为“3.1按古代经典名方目录管理的中药复方制剂”及“3.2其他来源于古代经典名方的中药复方制剂”,3.1和3.2类均需进行药学及非临床安全性研究,3.2类还需对中药人用经验进行系统总结,并对药物临床价值进行评估。古代经典名方中药复方制剂是尊重中药研发规律的重要体现,也是构建符合中药特点的“三结合”审评证据体系[31]的关键所在。
古籍关键信息考证以及临床实践所用制剂相关信息收集、整理的准确性,对于保证含有毒性药味的古代经典名方中药复方制剂的安全性和有效性具有重要意义。已发布的《古代经典名方目录(第一批)》[32]的部分处方中含有毒性药味附子、半夏,关于炮制有如下表述:“附子一枚(炮,去皮,破八片)”“附子(炮)”“附子(炮、去皮脐)”“半夏(汤洗)”等。目录中未明确具体的炮制方法,因此建议参考已发布的《古代经典名方关键信息考证原则》开展考证工作[33],保证考证信息准确。处方来源于临床经验方、医疗机构制剂的,如拟按“基于古代经典名方加减化裁的中药复方制剂”申报,应保证处方组成(如基原、炮制、剂量)、制备工艺等与临床实践所用制剂一致。考虑到临床医生开具处方时可能存在处方写生品付炮制品的情况,因此,在对临床实践所用制剂信息收集、整理时应关注“处方应付”问题。
人用经验对于中药新药注册申请的支持作用是以注册申报的处方、工艺等与临床实践基本一致为基础,如临床实践所用制剂为传统水煎工艺,申报注册时工艺变化较大,则可能对制剂安全性产生不利影响。以某一含补骨脂的中药复方制剂新药为例,原临床经验方为水煎工艺,注册申报时补骨脂改为醇提,导致具有肝毒性的香豆素类成分富集,增加了药物的安全性风险[34]。
3.2 重视毒理研究用样品的研究
非临床安全性评价对于中药毒性的发现及安全性相关质量控制措施的建立具有重要作用,毒理研究用样品更是保证试验结果科学、可靠的关键所在。因此,应在前期药学研究确定处方、工艺等的基础上制备毒理研究用受试物,受试物应能充分代表临床试验用样品和申请上市样品的质量属性和安全性,为满足试验需要而特殊制备受试物的,其改变不应引起药用物质基础和吸收利用的明显变化。应研究建立受试物的质量标准,其中安全性相关的检测项目应尽可能全面,检测指标应能反映受试物的质量属性和安全性,并应重点考察对药物安全性、有效性有较大影响的指标。另外,应加强研究过程的质量控制和过程管理,建立毒理研究用样品档案,保证样品的可溯源性。由于中药组成及成分复杂,剂型及给药途径多样,为满足试验需求应具体问题具体分析,有针对性地开展研究。可结合毒理试验结果查找影响产品安全性的因素,从而制定相应的质量控制措施。
3.3 加强中药安全性风险识别、管理和控制
中药安全性风险识别贯穿中药研发的整个过程,应通过全局观的质量设计查找影响中药安全性的风险因素,加强药材种植和采收、饮片炮制、工艺研究、制剂生产等多个环节的安全性风险管理和防控。
药材研究阶段应保证药材基原准确,避免出现易混淆品;
加强对农药等有害污染物的跟踪监测,包括药材种植过程中农药、化肥等投入品的使用情况,产地加工过程可能引入的二次污染,可能发生的重金属及有害元素、真菌毒素等污染风险;
根据具体情况制定外源性污染物的风险控制策略。饮片炮制过程中应关注炮制工艺的规范性、炮制评价指标选择的合理性,按照确定的炮制工艺标准化操作规程进行炮制,避免因过度炮制或炮制不到位影响药效和安全性。在工艺研究阶段应根据品种特点合理选择溶媒、生产过程中材料,对于具有人用经验的品种可结合临床实践所用制剂情况研究确定注册申报制剂的工艺。对于影响中药安全性的内源性毒性成分,应考察毒性成分在药材-饮片-制剂中的量质传递规律,综合评估毒-效关系,制定质量控制方法并规定合理的含量限度或限度范围[35]。对于处方中含有毒性药味,但质量标准中尚缺乏相关质控项目的已上市品种,建议根据所含毒性药味的情况建立合理的质控方法并视情况修订质量标准,如发生工艺、辅料等变更,应考虑变更对药品安全性的影响。
3.4 加强基础研究,科学制定质控策略
中药来源多样,组成及成分复杂,对于中药毒性的认识还处于不断探索和发现的过程。因此,加强基础研究对于中药安全性质量控制至关重要。近年来,科技带动产学研发展,越来越多的新技术、新研究模式被用于中药毒性成分的发现以及作用机制的研究。崔鹤蓉等[36]创建了临床“有毒”中药数智融合研究模式以及药物联用风险智能预测方法,辨识“有毒”中药的临床特征及潜在风险;
陈颖等[37]采用斑马鱼模型考察了26种常见骨伤科相关药味的安全性,发现其中续断、知母、补骨脂、制何首乌等13种药味水煎液有一定或潜在毒性,致斑马幼鱼脏器形态明显改变;
Li等[38]采用基因芯片技术研究黄秦艽对雪上一枝蒿小鼠肝毒性的作用机制,结果表明,黄秦艽可通过调节氧化应激、炎症损伤和细胞凋亡/坏死途径减轻雪上一枝蒿诱导的小鼠肝损伤。另外,类器官芯片技术也开始被用于药物毒性的研究[39]。通过基础研究的开展可以促进中药安全性(毒性)数据库的构建,从而进一步探索将研究成果转化为安全性质量控制方法的可行性,科学制定相关质量控制策略,为保障中药用药安全提供基础。
中药的全生命周期包括研发、注册、上市、上市后等多个阶段,符合中药特点的安全性相关质量研究和质量控制应贯穿始终。药品上市许可持有人作为药品安全的第一责任人,一方面应提高质量意识和安全意识,重视安全性风险识别,强化风险意识和风险评估,建立科学的管理体系;
另一方面应落实药品全生命周期管理,加强源头控制、生产过程控制,建立全过程质量控制体系。通过具有前瞻性的质量设计以及全局观的质量控制,使中药安全性得到有力保障,确保患者用药安全。
利益冲突 所有作者均声明不存在利益冲突
[1] 国务院办公厅. 国务院办公厅关于全面加强药品监管能力建设的实施意见(国办发[2021]16号) [EB/OL]. [2021-05-10]. http://www.gov.cn/zhengce/content/2021-05/10/content_5605628.htm.
[2] 国家药品监督管理局. 关于取消关木通药用标准的通知(国药监注[2003]121号) [EB/OL]. [2003-04-01]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20030401010101717.html.
[3] 熊芬, 谷丽华, 杨莉, 等. 含吡咯里西啶生物碱中成药潜在风险评估 [J]. 中草药, 2021, 52(17): 5389-5400.
[4] 董世芬, 宁一博, 靳洪涛. 中药不良反应与中药毒性研究进展 [J]. 医药导报, 2019, 38(11): 1419-1424.
[5] 李耀磊, 张冰, 张晓朦, 等. 基于毒害成分的中药临床安全性评价与思考 [J]. 中国药物警戒, 2021, 18(6): 520-524.
[6] 李宁, 苗明三, 白莉. 大毒中药临床毒性机制与解救措施 [J]. 中华中医药杂志, 2022, 37(2): 659-664.
[7] 蒋一帆, 高建超, 田春华, 等. 毒性药材天仙子的文献研究及风险探讨 [J]. 中国药物警戒, 2016, 13(3): 165-168, 172.
[8] 马家宝, 杨正腾. 全蝎、蜈蚣、蟾酥和土鳖虫抗肿瘤作用研究进展 [J]. 中医药导报, 2021, 27(5): 65-67.
[9] 刘玉婷, 杨洋, 弓佩含, 等. 千金子化学成分研究进展 [J]. 中国实验方剂学杂志, 2017, 23(13): 220-225.
[10] 杨晶凡, 徐璐, 陈随清. 有毒中药甘遂的本草考证 [J]. 中国药物警戒, 2022, 19(4): 372-375.
[11] 田婧卓, 张宇实, 梁爱华. 论雄黄的安全性以及对其监管的建议[J]. 中国食品药品监管, 2021(1): 58-64.
[12] 程茂高, 乔卿梅, 魏志华, 等. 中药材仓储害虫及其绿色防控技术研究进展 [J]. 中药材, 2016, 39(8): 1917-1921.
[13] 阳长明, 陈霞, 赵巍, 等. 基于源头控制的中药制剂质量研究 [J]. 中草药, 2021, 52(2): 321-326.
[14] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《中药新药研究各阶段药学研究技术指导原则(试行) 》的通告(2020年第37号) [EB/OL]. [2020-11-02]. https://www.cde.org.cn/main/news/viewInfo Common/49fef22537610d8d46f8c5b63c9b335e.
[15] 买买提依力·努尔买提, 阿里亚·阿不都拉, 阿布都热衣木·阿不都克日木, 等. 维吾尔药材资源存在的问题及其整治对策 [J]. 中药材, 2017, 40(7): 1567-1569.
[16] 陈小雪, 黄晓汕, 杨晓琴. 维吾尔药材的质量问题 [J]. 中国药事, 2015, 29(5): 479-481.
[17] 国家市场监督管理总局. 《进口药材管理办法》(国家市场监督管理总局令第9号) [EB/OL]. [2019-05-16]. https://gkml.samr.gov.cn/nsjg/fgs/201905/t20190517_293819.html.
[18] 中国药典[S]. 一部. 2020: 200, 351, 501.
[19] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《中药新药质量研究技术指导原则(试行)》的通告(2021年第3号) [EB/OL]. [2021-01-04]. https://www.cde.org.cn/main/news/viewInfoCommon/eda07852d89f6fa7a6da7db6577d5695.
[20] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《中药新药用药材质量控制研究技术指导原则(试行) 》等3个指导原则的通告(2020年第31号) [EB/OL]. [2020-10-12]. https://www.cde.org.cn/ main/news/viewInfoCommon/4f9393f8e9e02a253f7649ec28941ac0.
[21] 张凯, 董晓敏, 王琦, 等. 常用中药肝毒性成分代谢与毒理研究进展 [J]. 中草药, 2018, 49(22): 5435-5447.
[22] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《已上市中药药学变更研究技术指导原则(试行) 》的通告(2021年第26号) [EB/OL]. [2021-04-02]. https://www.cde.org.cn/main/news/viewInfoCommon/ 67cf09282a5159c6b7a78429983ea6b1.
[23] 中华人民共和国农业农村部. 中华人民共和国农业部公告第199号[EB/OL]. [2002-06-25]. http://www. moa. gov.cn/ztzl/ncpzxzz/flfg/200709/t20070919_893058.htm.
[24] 国家药监局农业农村部国家林草局国家中医药局. 关于发布《中药材生产质量管理规范》的公告(2022年第22号) [EB/OL]. [2022-03-17]. https://www.nmpa. gov. cn/xxgk/ggtg/qtggtg/20220317110344133.html.
[25] 王莹, 申明睿, 李纯, 等. 中药农药残留检测标准发展情况及监管思路 [J]. 中国食品药品监管, 2021(10): 76-85.
[26] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《中药新药用药材质量控制研究技术指导原则(试行) 》等3个指导原则的通告(2020年第31号) [EB/OL]. [2020-10-10]. https://www.nmpa.gov. cn/xxgk/ggtg/qtggtg/20201016144518188.html.
[27] 新疆维吾尔自治区中药维吾尔药饮片炮制规范(2020年版) [S]. 2021: 14.
[28] 刘帅, 李飞, 侯跃飞, 等. 诃子中的鞣质成分对诃子汤制草乌的影响: 诃子制草乌炮制原理探讨I [J]. 中国实验方剂学杂志, 2013, 19(5): 158-160.
[29] 康传志, 杨婉珍, 莫歌, 等. 中药材二氧化硫限量标准及残留现状探讨 [J]. 中国中药杂志, 2018, 43(2): 242-247.
[30] 国家药品监督管理局. 国家药监局关于发布《中药注册分类及申报资料要求》的通告(2020年第68号) [EB/OL]. [2020-09-28]. https://www.nmpa.gov.cn/xxgk/ ggtg/qtggtg/20200928164311143.html.
[31] 新华社. 中共中央国务院《关于促进中医药传承创新发展的意见》[EB/OL]. [2019-10-26]. http://www.gov.cn/ zhengce/2019-10/26/content_5445336. htm
[32] 国家中医药管理局. 关于发布《古代经典名方目录(第一批)》的通知 [EB/OL]. [2018-04-16]. http://www. satcm.gov.cn/kejisi/zhengcewenjian/2018-04-16/7107.html.
[33] 国家中医药管理局. 关于发布《古代经典名方关键信息考证原则》《古代经典名方关键信息表(7首方剂) 》的通知 [EB/OL]. [2020-11-10]. http://www.satcm.gov.cn/ kejisi/zhengcewenjian/2020-11-10/18132.html.
[34] 王停, 董润生. 一起中药临床试验严重不良事件带给我们的思考 [J]. 中国新药杂志, 2008, 17(14): 1185-1187.
[35] 李强, 程诚, 何平, 等. 基于临床中药安全认知的“毒”-“效”药物研究及实践: 以《本草图经》为例 [J]. 中草药, 2022, 53(1): 270-277.
[36] 崔鹤蓉, 张晓雨, 尤良震, 等. 临床“有毒”中药多元整合证据评价与预测方法的建立 [J]. 中国中药杂志, 2022, 47(8): 2266-2272.
[37] 陈颖, 汪晶, 陈书芹, 等. 基于斑马鱼模型的26种常见骨伤科中药材的毒性筛选 [J]. 南京中医药大学学报, 2016, 32(5): 465-469.
[38] Li J, Liu G, Ihsan A,. Effects ofextract on hepatic gene expression profiles in response to-induced liver toxicity in mice [J]., 2019, 10: 568.
[39] Xiao R R, Lv T, Tu X,. An integrated biomimetic array chip for establishment of collagen-based 3D primary human hepatocyte model for prediction of clinical drug-induced liver injury [J]., 2021, 118(12): 4687-4698.
Safety-related quality research and quality control according to characteristics of traditional Chinese medicine
ZHENG Tian-jiao, HAN Wei
Center for Drug Evaluation, National Medical Products Administration, Beijing 100022, China
“Safety, effectiveness and quality controllability” is the basic criterion for drug development and evaluation, and ensuring drug safety is the premise and foundation. As a type of medicine, traditional Chinese medicine (TCM) has common requirements with other medicines in terms of safety and quality control. However, because it is used under the guidance of TCM theory and is derived from plants, animals, and minerals, it has its own characteristics in other aspects, such as adverse reaction and quality control of harmful ingredients. By summarizing the factors affecting the quality and safety of TCM and relevant quality control measures, some suggestions, such as paying attention to the important role of human experience in the safety and quality control of TCM, and strengthening the identification, management and control of the safety risks of TCM were put forward in this paper, in order to provide reference for research and development of TCM.
safety and quality control of traditional Chinese medicine; endogenous toxic components; exogenous pollutants; processing; human experience; risk prevention and control
R285.53
A
0253 - 2670(2023)01 - 0008 - 07
10.7501/j.issn.0253-2670.2023.01.002
2022-08-23
郑天骄,助理研究员,审评员,主要从事药品技术审评工作。E-mail: zhengtj@cde.org.cn
通信作者:韩 炜,博士,主任药师,高级审评员,主要从事药品技术审评工作。E-mail: hanw@cde.org.cn
[责任编辑 崔艳丽]
猜你喜欢 炮制制剂药材 道地药材变成致富“金叶子”今日农业(2022年2期)2022-11-16春季种什么药材好?今日农业(2021年6期)2021-06-09药材价格表特种经济动植物(2021年4期)2021-04-19中草药制剂育肥猪今日农业(2020年18期)2020-12-14炮制专家王琦论现代中药炮制研究的“2个时期3个阶段”中成药(2018年12期)2018-12-293种姜汁炮制后厚朴对大鼠胃黏膜损伤的抑制作用中成药(2018年9期)2018-10-09清半夏炮制工艺的优化中成药(2018年9期)2018-10-09元胡止痛系列制剂4种工艺比较中成药(2017年4期)2017-05-17固体制剂常用设备清洁验证研究中国中医药现代远程教育(2014年11期)2014-08-08希特勒炮制的『罗姆事件』军事历史(1993年2期)1993-08-21推荐访问:质量控制 安全性 中药