氧合指标及呼吸机参数对机械通气治疗儿童ARDS的预后评价
来源:优秀文章 发布时间:2023-02-27 点击:
张琴,顾伟,陈俊,缪红军
南京医科大学附属儿童医院重症医学科,江苏 南京 210008
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是呼吸系统常见危重症,以肺泡毛细血管内皮细胞和肺泡上皮细胞损伤造成弥漫性肺间质及肺泡水肿为主要表现,临床特征为进行性呼吸窘迫与难治性低氧血症。该疾病病死率高达18%~63%,是重症监护病房患者高病死率的主要原因之一,对患者的生命健康造成严重危害[1]。当前ARDS的治疗方式多样,但疗效不甚理想,发病率和病死率居高不下。鉴于ARDS 的高病死率,早期准确判断ARDS 患者病情严重程度,及时评估预后,从而制定全面有效的治疗方案降低患者病死率显得尤为重要。目前对于ARDS的危险分层研究大多只是将特定时间的单一数据与患者预后相比较,缺乏连续的多时间段的数据采集,没有动态观察相应指标的长程变化与ARDS 患者病情转归的关联性。因此,本研究拟探讨相关氧合指标及呼吸机参数在不同时间对ARDS 预后转归的预测价值,以期为临床筛选出早期动态预警ARDS转归的代表性指标。
1.1 对象
本研究将给予机械通气治疗的ARDS患儿作为研究对象。根据纳排标准选取2017年1 月—2021 年6 月南京医科大学附属儿童医院重症监护病房(PICU)收治的ARDS患儿65例。依据治疗28 d后的存活状况,将65例ARDS患儿分为存活组(37例)和死亡组(28例)。给予机械通气的ARDS患儿均接受肺保护性通气策略。研究经南京医科大学附属儿童医院伦理委员会批准,并知情同意。
纳入标准:①符合儿童ARDS 诊断标准且给予机械通气治疗;
②年龄>28 d且<18岁;
③机械通气达72 h及以上。排除标准:符合下列任一标准的患者被排除在外:①年龄≤28 d 或≥18 岁;
②无创机械通气;
③临床资料不完整的患者;
④机械通气不足72 h。儿童ARDS(pediatric ARDS,PARDS)诊断标准参照2015 年儿童急性肺损伤共识会议(pediatric acute lung injury consensus conference,PALICC)所提出的诊断标准[2]。
1.2 方法
通过南京医科大学附属儿童医院病案系统查询并收集以下资料:①患者的一般情况,包括入院年龄、性别、ARDS 病因、基础疾病及免疫功能等情况;
②患者给予机械通气时、机械通气后1、3 d的氧合指标及呼吸机参数如动脉血氧分压与吸入氧浓度比值(PaO2/FiO2)、脉氧饱和度与吸入氧浓度比值(SpO2/FiO2)、氧合指数(oxygenation index,OI)、氧饱和度指数(oxygen saturation index,OSI)、呼气末正压(positive end expiratory pressure,PEEP)、平均气道压(mean airway pressure,MAP)等;
③PICU 时长、机械通气时长、住院时长及临床结局等信息。第0 天定义为给予气管插管并开始机械通气日。OI=(FiO2×MAP×100)/PaO2,OSI=(FiO2×MAP×100)/SpO2。
1.3 统计学方法
采用SPSS 26.0 软件进行统计分析。正态分布计量资料以均数依标准差()表示,非正态分布计量资料以中位数(四分位数)[M(P25,P75)]表示,计数资料使用(%)表示。满足正态性的计量资料组间比较采用t检验,不满足正态性的计量资料采用非参数检验(Mann-Whitney 检验);
计数资料组间比较采用卡方检验。死亡危险因素分析采用Logistic 回归分析;
绘制受试者操作特征(receiver operating characteristics,ROC)曲线,以ROC 曲线下面积(area under curve,AUC)评价各指标预测价值。P<0.05为差异有统计学意义。
2.1 ARDS患儿临床特征分析
纳入本研究的65 例患儿中位年龄是2.1岁,最小0.1岁,最大13.8岁。死亡组中位年龄为2.6岁,存活组中位年龄1.5岁,两组差异无统计学意义。男49例,女16 例。小儿死亡风险(pediatric risk of mortality,PRISM)Ⅲ评分显示死亡组与存活组之间无显著性差异。肺炎、脓毒症是引起ARDS 的主要病因,其中肺炎占60%,脓毒症占24.6%。对纳入研究的患儿基础疾病状态进行分析显示,有基础疾病患儿占60.0%,其中神经系统疾病占21.5%,血液病占16.9%,慢性肺疾病占6.2%,免疫缺陷病占7.7%。死亡组和存活组基础疾病比较显示两组间差异无统计学意义。患儿中位住院时长、PICU时长和机械通气(mechanical ventilation,MV)时长分别是18.0、13.0、7.0 d。死亡组PICU 时长、MV 时长、住院时长均显著短于存活组(P<0.001,表1)。
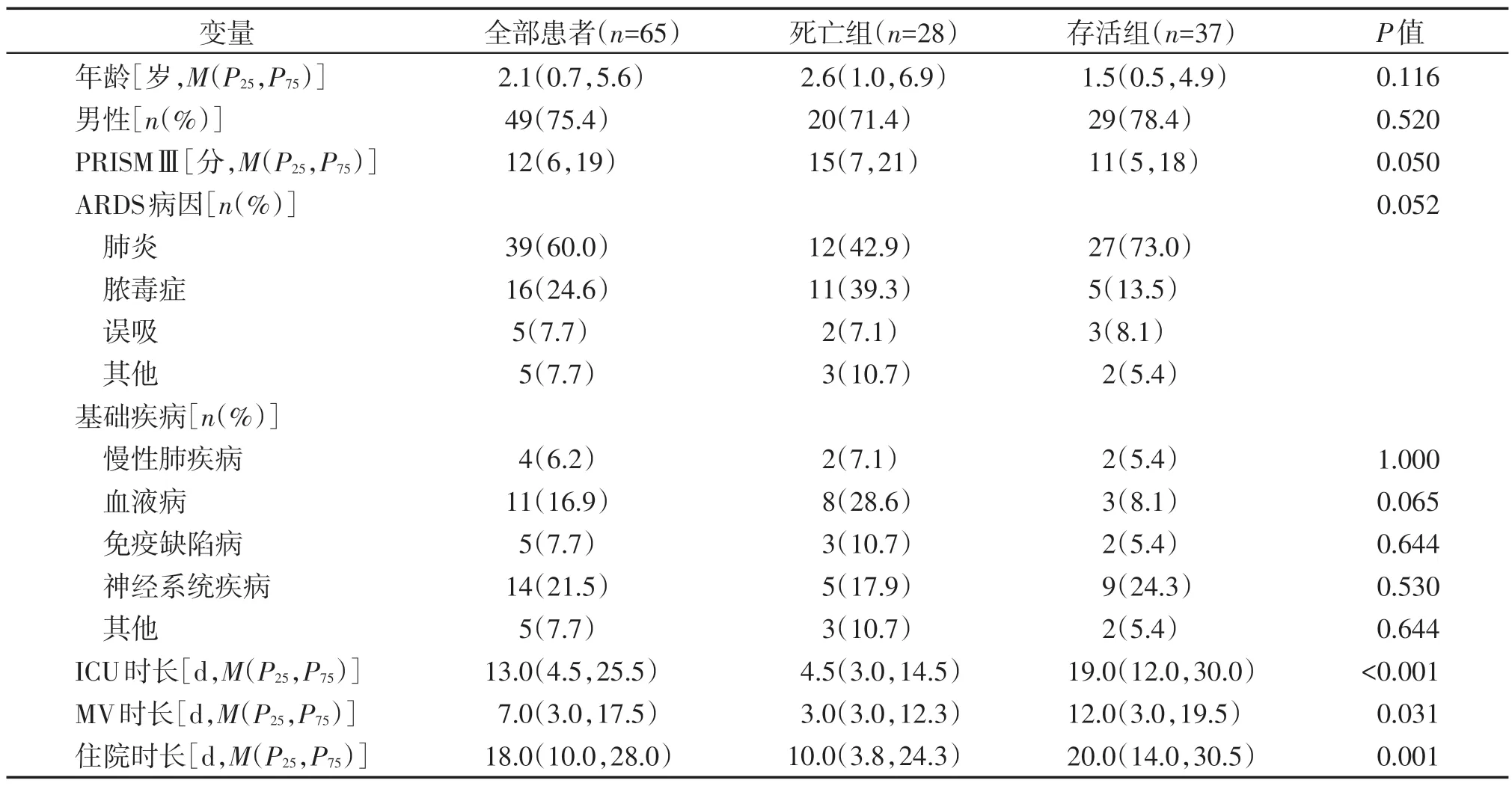
表1 ARDS患儿临床特征分析Table 1 Analysis of clinical characteristics of children with ARDS
2.2 机械通气后呼吸系统指标变化
对死亡组和存活组所有呼吸指标比较发现,除MAP在机械通气当天无显著差异外,其余呼吸指标在不同时间点两组间比较差异均有统计学意义,且第3天组间差异显著大于第0天。死亡组PaO2/FiO2从机械通气第0天至第3天呈下降趋[(103.4依41.5)vs.(91.0依47.2)];
而存活组PaO2/FiO2则呈现显著升高[(131.1依44.1)vs.(245.3依87.1),P<0.05]。死亡组SpO2/FiO2从机械通气第0天至通气后第3天显著下降[144.7(113.2,183.5)vs.100.0(92.5,119.4),P<0.05),而存活组SpO2/FiO2无明显变化。死亡组OI和OSI 从第0 天到第3 天均呈现上升趋势,存活组OI和OSI随着机械通气天数呈下降改变或无显著变化。死亡组MAP 和PEEP 从第0 天到第3 天同样呈现上升趋势,而存活组无明显变化(表2)。
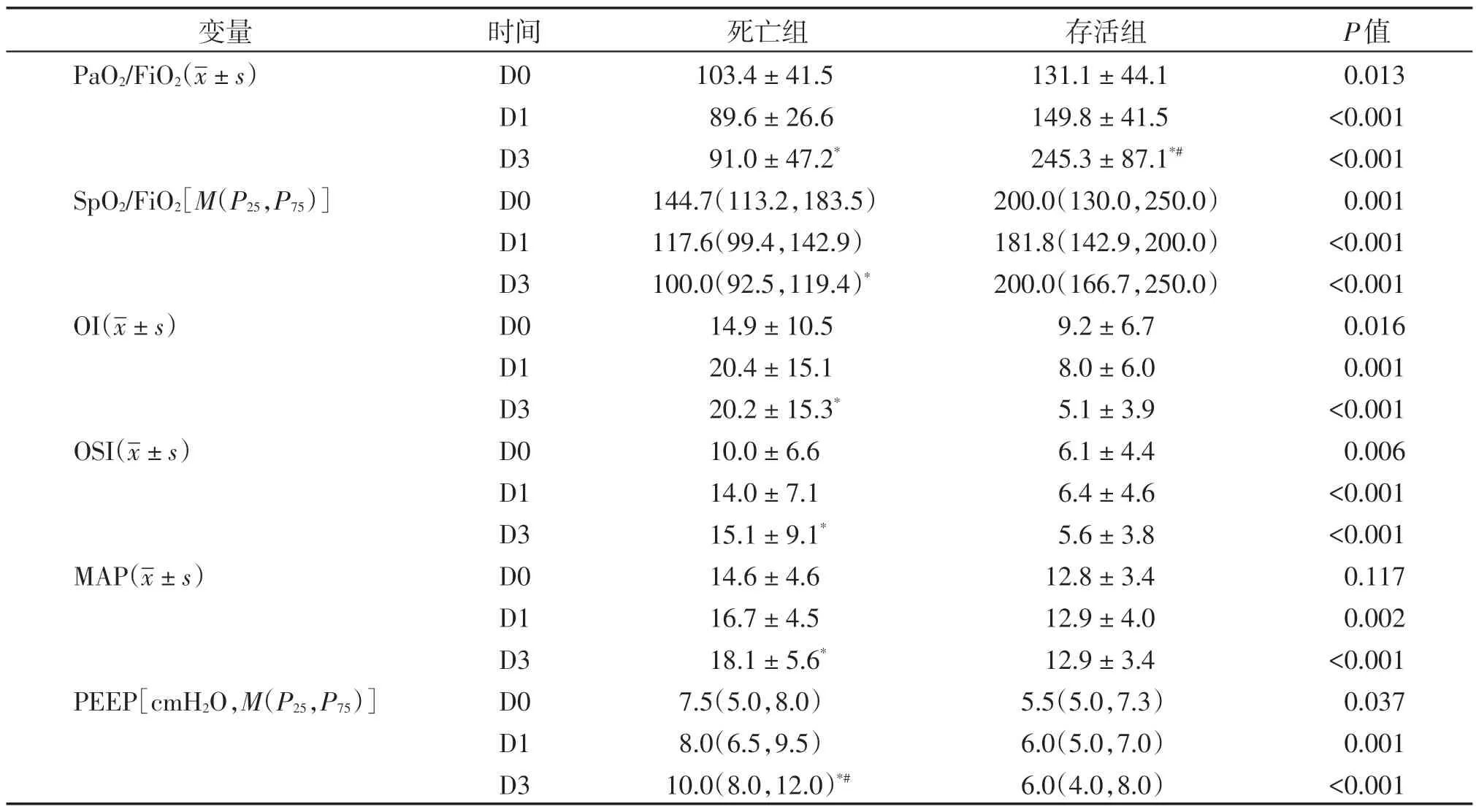
表2 机械通气后ARDS患者氧合指标及呼吸机参数变化比较Table 2 Comparison of oxygenation indexes and ventilator parameters in ARDS patients after mechanical ventilation
2.3 机械通气后ARDS患者死亡危险因素分析
通过Logistic 回归方法分析发现机械通气的第0、1、3 天随着PaO2/FiO2、SpO2/FiO2、OI、OSI、PEEP的变化,ARDS 患儿的死亡风险相应增加。进行性别和年龄校正后进行Logistic回归分析,结果显示在机械通气的第0、1、3天PaO2/FiO2、SpO2/FiO2、OI、OSI和PEEP 均是ARDS 患儿死亡的独立危险因素。而MAP除在机械通气第0天外,在第1天和第3天也是ARDS患儿死亡的独立危险因素(表3)。
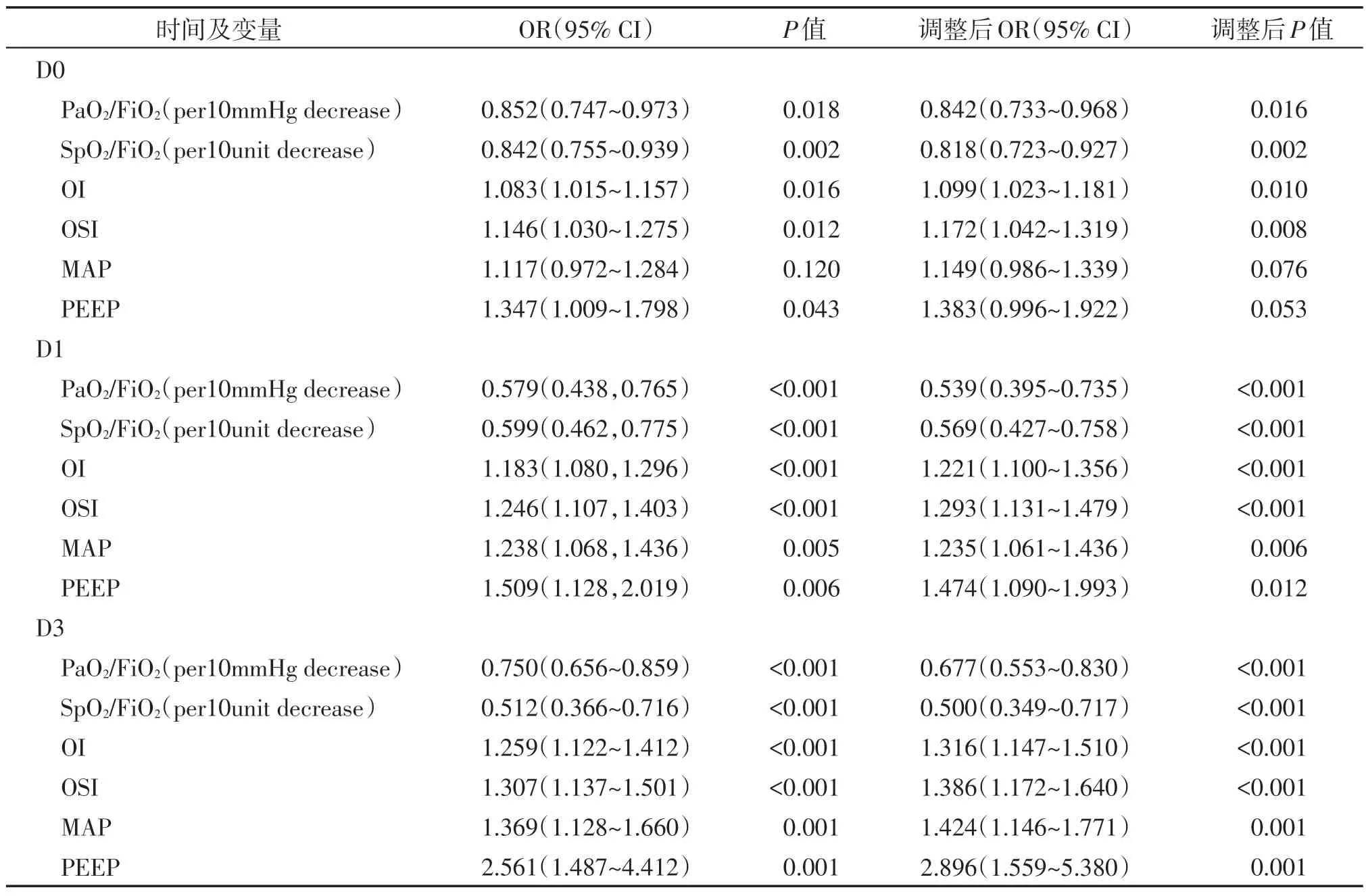
表3 ARDS死亡危险因素的Logistic回归分析Table 3 Logistic regression analysis of ARDS death risk factors
2.4 各项危险因素对ARDS 患者死亡风险的预测价值
通过计算ARDS 患儿机械通气第0、1、3 天的PaO2/FiO2、SpO2/FiO2、OI、OSI、MAP 及PEEP 的AUC发现在机械通气第0天,各指标具有中等预测价值(AUC:0.626~0.739),而在机械通气第1、3天,各指标AUC显著增长。机械通气第3天各指标显示更好的预测价值(AUC:0.806~0.961,图1,表4)。
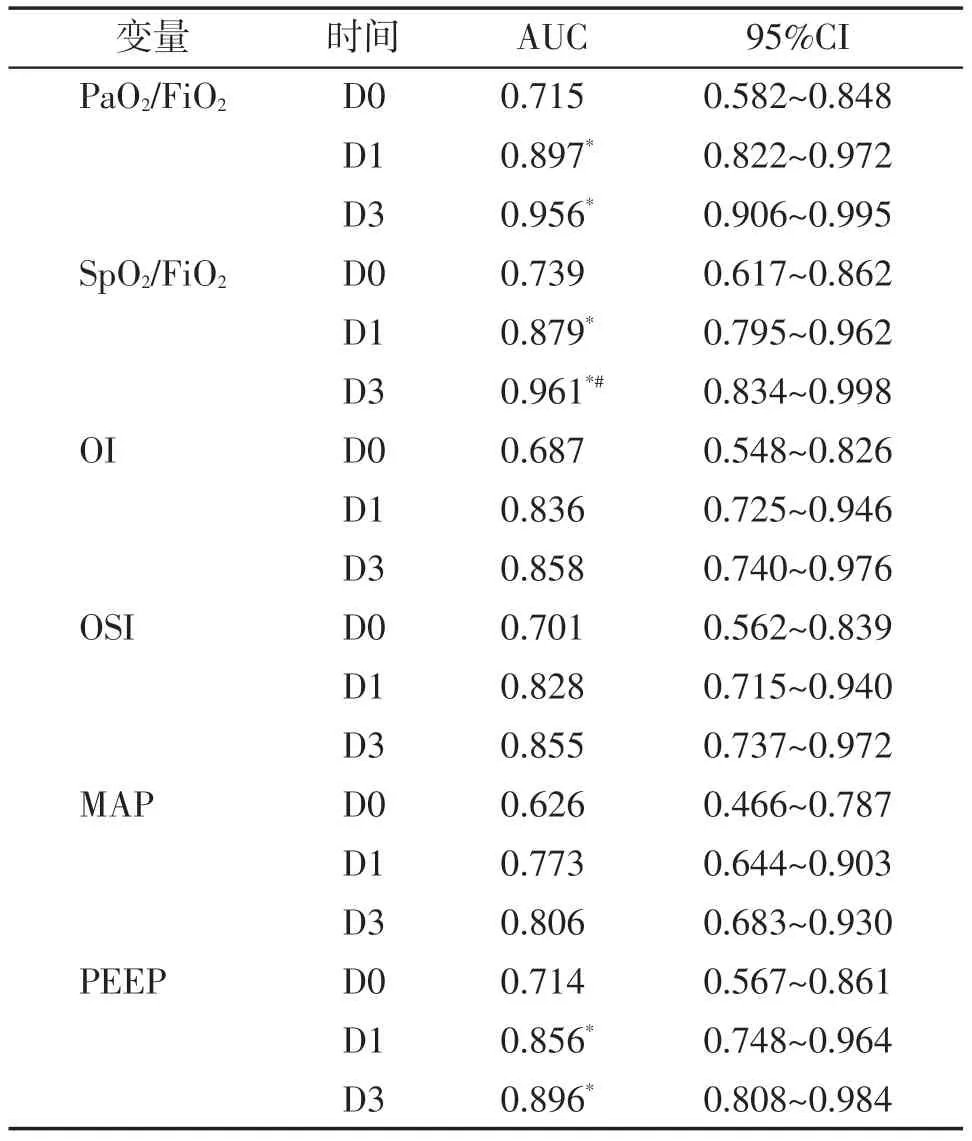
表4 各指标对死亡风险的预测价值分析Table 4 Analysis of the predictive value of each indicator on the risk of death
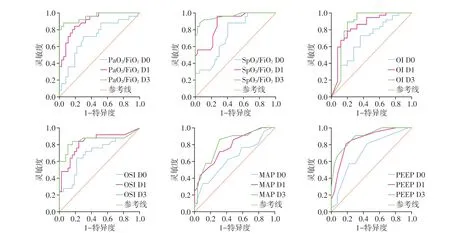
图1 氧合指标和呼吸机参数预测ARDS患儿死亡风险的ROC曲线Figure 1 ROC curve of oxygenation indexes and ventilator parameters predicting the risk of death in children with ARDS
ARDS 是肺泡毛细血管膜损伤所致的肺急性炎症过程,其病因繁多,发病机制复杂。ARDS 可导致患者迅速出现呼吸衰竭并加重原有疾病,病情进展迅速,晚期干预措施有限,如不能及时有效地进行治疗,可引起严重的并发症。因此,ARDS的早期准确识别和分级至关重要,治疗措施的有效性取决于其及时启动,特别是体外膜肺氧合的实施。本研究发现:①氧合指标PaO2/FiO2、SpO2/FiO2、OI、OSI 及呼吸机参数MAP、PEEP与机械通气的ARDS患儿死亡相关,可作为预后预测指标;
②机械通气第0~3天,以上指标均具有预测价值,但第3天预测价值更高。
本研究中ARDS 患儿的临床特征分析显示,肺炎和脓毒症是引起ARDS 的主要病因,这与既往研究是一致的。ARDS病因分析显示肺炎或下呼吸道感染占63%,脓毒症占19%[3]。本研究对ARDS 的相关病因病死率分析显示肺炎(30.1%)低于脓毒症(68.8%),与以往研究一致[3-4]。在多变量模型中肺炎作为危险因素与病死率降低有独立相关性[3]。脓毒症致ARDS高病死率考虑与多器官功能障碍有关。
成人ARDS 的多项研究表明PaO2/FiO2不是良好的死亡预测因子[5-6]。呼吸机设置如潮气量和PEEP 均可影响PaO2/FiO2比值。本研究结果与其不同。本研究显示死亡组PaO2/FiO2在机械通气第0天至第3天呈下降趋势,而存活组呈上升趋势,回归分析显示其是ARDS 的独立危险因素,具有死亡预测价值,与吴峤微等[7]的研究结果相似。Wong等[8]研究结果证实低PaO2/FiO2和低SpO2/FiO2与ARDS 患儿预后不良有关。儿童与成人结果不同的原因可能在于ARDS 患儿患有复杂的基础疾病或其他器官受累少于成人。ARDS 最常见的原因是肺炎,故死亡率主要取决于肺损伤的严重程度。肺损伤的严重程度由氧合不足而不是合并症来衡量。因此,PaO2/FiO2是ARDS患儿死亡风险有力的独立预测因子。
与PaO2/FiO2比较,SpO2/FiO2具有易获得,无需有创抽血,可以持续监测的优势,因此SpO2/FiO2用于诊断和评估ARDS更有意义,特别是在婴幼儿采血困难时。研究显示SpO2/FiO2和PaO2/FiO2之间存在较好的相关性(r=0.688;
P=0.001)[9]。采用SpO2/FiO2诊断的ARDS 患者与PaO2/FiO2诊断的患者具有非常相似的临床特征和结果[10]。因此SpO2/FiO2可以作为PaO2/FiO2的替代。本研究结果显示SpO2/FiO2是ARDS的独立危险因素,在机械通气的第0、1、3天均具有良好的死亡预测价值,SpO2/FiO2可以用于ARDS预后预测。由于可以持续监测SpO2/FiO2,最近一项研究则采用SpO2/FiO2处于特定阈值下的持续时间来预测ARDS预后,取得较好效果[11]。
OI 和OSI 作为2015 版ARDS 严重程度分级标准,反映肺气体交换和顺应性特征的综合指数,其较PaO2/FiO2和SpO2/FiO2更能反映肺损伤程度。Shen等[12]研究显示OI 较PaO2/FiO2能更准确地对ARDS 特别是轻中度患儿进行危险分层。Desprez等[5]研究证实OSI 和OI 高度相关(r=0.862,P<0.001),OSI 可替代OI,以无创方式提供预后信息和评估ARDS 严重程度。Huber等[13]研究显示ARDS诊断后6 h 通过OI 或OSI 确定的严重程度改善了死亡风险的分级。本研究结果相似,OI 和OSI 在ARDS 患儿进行机械通气的第0、1、3 天均具有良好的死亡预测价值,特别是第3天。
MAP作为ARDS重要的呼吸力学指标,其受气道峰压、通气时间、PEEP、吸气流量、压力波形等影响。本研究显示在机械通气当天,MAP在存活组和死亡组间无显著差异,在通气第1天和第3天,两组间有显著差异,死亡组MAP显著高于存活组。死亡组患者由于存在严重低氧血症,升高PEEP 可以改善氧合,MAP随之升高。但升高的MAP同时会带来气压伤和血流动力学影响,一定程度会影响患者预后。Chen等[14]的研究显示在ARDS 的第1天,死亡组MAP[21.5(20.0~24.0)]高于存活组[21.0(18.0~22.0),且存在显著差异(P=0.012)。该研究的MAP高于本研究,考虑与其机械通气过程中PEEP 设置[10(10~12)cm H2O]显著高于本研究PEEP 设置有关。本研究同时显示MAP 与ARDS 死亡有相关性,具有预测价值。但Luhr等[15]的研究结果则显示MAP与ARDS的90 d死亡率无相关性,与非ARDS的呼吸衰竭患者死亡率有较弱的相关性。研究结果的差异性考虑与研究样本量有关,还需大样本研究给予证实。
PEEP 通过调节肺泡内压促进萎陷的肺泡复张,改善肺内气体分布的不均一性,增加弥散面积,是治疗肺换气功能障碍的有效措施。本研究显示死亡组PEEP 水平显著高于存活组,PEEP 是ARDS患儿的死亡预测因素,持续高PEEP 提示患者的死亡风险增高。可以解释为较高的PEEP 和较高的FiO2反映了ARDS 的严重程度,与死亡率单独相关。而Khemani等[16]研究结果提示,低于ARDSNet建议的PEEP设定与高病死率相关。本研究中同样存在PEEP 设定过低现象,纳入的患儿均为中重度ARDS 患者,但本研究的PEEP 设置为6~9 cmH2O 范围。严重的ARDS 患儿接受的PEEP 可能低于推荐值,这导致低于推荐的PEEP 与更高的肺损伤严重程度之间存在关联,因此与更高的病死率相关。尽管建议在重度ARDS 患儿中使用中等水平的PEEP(10~15 cmH2O),但儿科领域中使用的PEEP水平仍然相对较低(6~10 cm H2O)。最近发表在JAMA 上的研究则提出肺复张联合高PEEP带来了病死率的增加[17],因此PEEP与ARDS患者的预后关系还有待进一步研究。
本研究同时对预测指标时效性进行研究。结果显示第3天的氧合指标和呼吸机参数的预后预测价值高于第0天和第1天。本研究结果与Balzer等[18]的研究相似。最近一项研究证实在ARDS 发病48 h后(即第3 天)对疾病严重程度的重新分类有助于预测病死率[19]。既往研究也证实在机械通气的第0天预测预后价值不高[20]。分析原因则考虑在给予机械通气一定时间后,氧合改善不佳、呼吸参数不能及时下调更能反映患者ARDS 的病情变化,对预后的预测更准确。
综上所述,ARDS 仍然是目前PICU 主要危重病之一,病死率极高。肺炎和脓毒症是主要病因。氧合指标PaO2/FiO2、SpO2/FiO2、OI、OSI 及呼吸机参数MAP、PEEP 可作为ARDS 患儿的预后预测指标,而第3 天的以上指标能够更准确预测预后。因本研究样本量有限,今后还需大样本多中心研究进一步证实。
猜你喜欢 存活病死率呼吸机 全髋翻修术后的病死率临床骨科杂志(2022年3期)2022-11-24PB840呼吸机维修技巧与实例现代仪器与医疗(2022年2期)2022-08-11全生命周期下呼吸机质量控制现代仪器与医疗(2022年2期)2022-08-11呼吸机日常养护结合护理干预对降低呼吸机相关性肺炎的作用现代仪器与医疗(2021年5期)2021-12-02降低犊牛病死率的饲养与管理措施现代畜牧科技(2021年4期)2021-07-21探讨风险管理在呼吸机维护与维修中的应用世界最新医学信息文摘(2021年12期)2021-06-09病毒在体外能活多久爱你(2018年24期)2018-08-16病毒在体外能活多久爱你·阳光少年(2018年8期)2018-05-14飞利浦在二战中如何存活中国照明(2016年4期)2016-05-17131I-zaptuzumab对体外培养肿瘤细胞存活的影响医学研究杂志(2015年9期)2015-07-01推荐访问:预后 通气 指标