METTL3介导IGF2BP3,m6A修饰对儿童肝母细胞瘤细胞增殖、迁移的影响
来源:优秀文章 发布时间:2023-02-17 点击:
魏慧珍 允文晶 崔西春
郑州大学第一附属医院1儿童重症监护室,2综合重症监护室,3小儿外科(郑州 450000)
肝母细胞瘤是目前临床中较为常见的在胚胎时期已经发生的祖细胞肿瘤,也是目前主要儿童肿瘤之一[1]。现阶段虽然采用化疗方案和手术技术对肝母细胞瘤患者进行干预可有效改善患者生存率,但患者的临床预后质量仍相对较差[2]。因此,积极寻找和探寻导致肝母细胞瘤发生和发展的分子机制,为选择合理有效的临床治疗靶标和预后评价标志物具有十分重要的意义[3]。有学者指出,表观遗传修饰与肿瘤的识别高度相关,并可与多种分子生物学机制研究密切相关[4]。研究结果表明,在肿瘤的发生和发展过程中核糖核酸(RNA)靶向修饰具重要生物学意义[5]。N6-腺苷酸甲基化(m6A)在多种信使RNA(mRNA)内部修饰和信号转导过程中扮演重要角色,并与肿瘤发生和演进高度相关。此外,在不同肿瘤基因组亚型或背景中m6A修饰扮演不同角色[6]。m6A甲基转移酶复合物中METTL3起到重要的调控作用,并可有效调节mRNA降解和翻译以及RNA稳定性[7]。但在儿童肝母细胞瘤中METTL3介导IGF2BP3 m6A修饰的作用仍鲜有报道,因此,笔者通过分析METTL3介导IGF2BP3 m6A修饰对儿童肝母细胞瘤细胞增殖、迁移的影响,为临床治疗应用提供依据。
1.1 方法采用qRT-PCR检测小儿肝母细胞瘤HuH-6(购买自ATCC公司)中METTL3和IGF2BP3 mRNA的表达;
Western blot检测METTL3和IGF2BP3蛋白表达(抗体购买自CST公司)。通过慢病毒转染,在HuH-6细胞中敲低METTL3,并通过免疫印迹验证METTL3蛋白表达,采用qRT-PCR与Western blot检测IGF2BP3的表达,m6A甲基化RNA免疫沉淀技术分析IGF2BP3 mRNA m6A修饰的情况;
CCK-8和Transwell小室实验检测细胞增殖及迁移能力。
1.1.1 sgMETTL3载体构建利用CRISPR-sgRNA设计网站设计METTL3基因外显子sgRNA序列,合成上游(5"-CACCGCACTGGGCTGTCACTACGGA-3")和下游(5"-AAACTCCGTAGTGACAGCCCAGTGC-3")基因序列,制备双链DNA,通过BsmB I对lenti-CRISPR V2载体行后续的酶切、回收操作,并进行连接。通过测序获得正确的lenti-CRISPR V2-sgMETTL3质粒。质粒交由通用生物科技有限公司合成和测序。
1.1.2 METTL3低表达细胞系建立参照文献方法进行慢病毒包装,后曝光293FT细胞,病毒包装质粒ps PAX2、病毒膜蛋白质粒pMD2.G,lentiCRISPR v2-sgMETTL3质粒或lentiCRISPR v2质粒混合均匀,后采用磷酸钙转染法进行处理,转染后收集加入HuH-6细胞培养基,后加入嘌呤霉素2 μg/mL行抗性筛选,筛选1周后的lentiCRISPR v2-sgMETTL3和lentiCRISPR v2稳定细胞系。后将所有细胞分为空载体组和sgRNA组进行处理。
1.1.3 m6A甲基化RNA免疫沉淀采用TRIzol抽提细胞RNA后打断RNA,RNA片段与m6A抗体复4℃孵育4 h,室温与磁珠孵育2 h,漂洗4次,洗脱m6A抗体并富集RNA。
1.1.4 免疫沉淀利用RIPA Buffer裂解液裂解细胞,后超声破碎,4℃下采用IGF2BP2抗体、磁珠、IgG抗体孵育30 min,磁珠抗体孵育2 h,漂洗6次,洗脱IGF2BP3结合复合物,抽提RNA。
1.1.5 qPCR检测逆转录制备cDNA,采用qPCR MIX试剂盒(THUNDER BIRD)检测目的基因。利用CFX96 Touch实时荧光定量PCR仪检测,预变性60 s、95℃,变性10 s、95℃,退火延伸30 s、60℃,共持续40个循环。METTL3基因、IGF2BP3基因、GAPDH基因、IGF2BP3 m6A甲基化基因和GAPDH m6A甲基化基因引物均由南京金斯瑞生物科技有限公司合成提供。
1.1.6 Western blot检测RIPA细胞裂解液抽提总蛋白,采用SDS-PAGE法分离总蛋白,后电转至PCDF膜,后采用5% BSA封闭1 h,后在4℃条件下一抗孵育过夜,TBST洗涤4次,每次10 min,后室温条件下使用二抗孵育1 h,采用ECL显影液采集数据。
1.1.7 免疫荧光染色培养细胞爬片24 h,室温4%多聚甲醛固定15 min,室温通透10 min(0.5% Triton X-100),室温下5% BSA封闭1 h,室温一抗孵育2 h,加入二抗稀释液室温孵育1 h,DPAI室温下孵育5 min,后封片采集数据。
1.1.8 细胞划痕检测6孔板接种细胞后在底部画横线4条,采用PBS洗涤每孔3次并将漂浮细胞去除后加入无血清培养基2 mL,并置于细胞培养箱中培养,0、24、48 h时使用显微镜拍照并计算。
1.1.9 Transwell实验12孔板置入Transwell小室,采用基础培养基制备细胞悬液,后在Transwell小室上室中进行接种,在下室加入完全培养基,并置于培养箱中24 h,后甲醛固定,甲醇通透,结晶紫染色,使用显微镜拍照并计算。
1.1.10 细胞增殖检测使用无血清培养基制备细胞悬液,后接种在96孔板中并置于细胞培养箱中培养48 h和72 h,后利用CCK-8试剂盒检测细胞增殖情况,采用酶标仪在450 nm处检测光密度值。
1.2 统计学方法本研究使用Graphpad和SPSS 20.0统计学软件包行统计学分析,采用百分率表示计数资料并行χ2检验分析数据资料差异,计量资料利用均值±标准差表示并行LSD-t检验和方差检验分析,P<0.05差异有统计学意义。
2.1 METTL3敲低细胞系检测本组研究结果显示,采用METTL3 sgRNA干预后会显著降低细胞METTL3表达水平,且差异有统计学意义(P<0.05),见图1及图2。
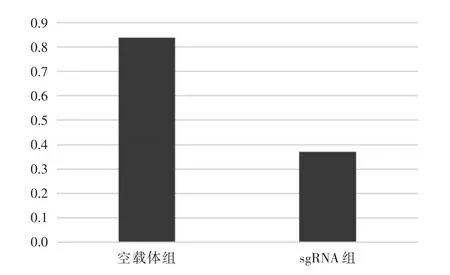
图1 METTL3蛋白表达水平检测结果Fig.1 Detection Results of METTL3 Protein Expression Level

图2 免疫荧光染色检测结果Fig.2 Results of immunofluorescence staining
2.2 各组细胞增殖结果本组研究结果显示,sgRNA组细胞48 h和72 h时细胞增殖水平明显低于空载体组,且差异有统计学意义(P<0.05),见表1。
表1 各组细胞增殖结果Tab.1 Investigation results of cell proliferation in each group ±s,%

表1 各组细胞增殖结果Tab.1 Investigation results of cell proliferation in each group ±s,%
组别空载体组sgRNA组复孔数3 3 48 h 65.84±4.43 43.95±5.02 72 h 73.29±4.19 48.91±3.23
2.3 各组细胞迁移与侵袭检测结果本组研究结果显示,sgRNA组细胞24 h和48 h时细胞迁移明显低于空载体组,sgRNA组细胞侵袭水平明显低于空载体组,见图3及图4。

图3 各组细胞迁移检测结果Fig.3 Cell Migration Test Results of Each Group

图4 各组细胞Transwell检测结果Fig.4 Transwell Test Results of Cells in Each Group
2.4 各组IGF2BP3蛋白及mRNA检测结果本组研究结果显示,sgRNA组细胞中IGF2BP3蛋白及mRNA表达水平明显低于空载体组,且差异均有统计学意义(P<0.05),见表2。
表2 各组IGF2BP3蛋白及mRNA检测结果Tab.2 Detection Results of IGF2BP3 Protein and mRNA in Each Group ±s

表2 各组IGF2BP3蛋白及mRNA检测结果Tab.2 Detection Results of IGF2BP3 Protein and mRNA in Each Group ±s
组别空载体组sgRNA组复孔数3 3蛋白0.64±0.08 0.21±0.04 mRNA 0.71±0.12 0.34±0.08
2.5 IGF2BP3 m6A修饰水平检测结果本组研究结果显示,sgRNA组细胞中m6A-IP及IGF2BP3 m6A相对表达量明显低于空载体组,且差异均有统计学意义(P<0.05),见表3。
表3 IGF2BP3 m6A修饰水平检测结果Tab.3 IGF2BP3 m6A Modification Level Test Results ±s

表3 IGF2BP3 m6A修饰水平检测结果Tab.3 IGF2BP3 m6A Modification Level Test Results ±s
组别空载体组sgRNA组复孔数3 3 m6A-IP/Input(%)1.02±0.14 0.63±0.08 IGF2BP3 m6A相对表达量1.03±0.09 0.57±0.08
小儿肝母细胞瘤是现阶段临床中较为常见的严重恶性肝脏肿瘤之一,通常情况下该病患者多在出生后2年时发病,且临床发病率约为百万分之1.5左右,在全部儿童癌症患者中约占1%左右,且近年来每年均呈现明显的快速、持续增长状态[8]。有学者指出,小儿肝母细胞瘤的组织学类型主要包括混合型、上皮型两种[9]。研究发现,作为常见的散发性肿瘤,小儿肝母细胞瘤患者的三分之一患者可能存在家族性腺瘤性息肉病、贝克威斯。韦德曼综合征、唐氏综合征、Edward综合征、肾母细胞瘤等均高度相关[10]。近年来,研究指出体质量较轻婴儿临床中罹患肝母细胞瘤的风险较高[11]。现阶段临床中小儿肝母细胞瘤患儿的临床分期是对患者预后质量进行评估和判断的关键因素,且5年低风险生存率约为80%,且复发或高风险后5年生存率降低30%左右[12]。因此临床中寻找和探寻新的治疗儿童肝母细胞瘤的生物标志物,具有十分重要的意义。
m6A修饰是现阶段受到人们广泛关注的重要转录后修饰方法,其中约60%左右RNA修饰通过m6A形式完成,该修饰方法也是最为主要和丰富的RNA修饰方案,且其序列中多存在高度保守的RRACH序列[13]。目前临床中m6A修饰已成为主要和受到人们广泛关注的表观遗传修饰新热点。有研究指出RNA甲基转移酶和去甲基化酶是调控m6A的主要方式,甲基转移酶作为核心甲基化调节的关键蛋白,METTL3有效催化m6A形成。去甲基化酶包括FTO、ALKBH5等,其中还有包括HNRNPA2B1、YTHDC1、YTHDF1、YTHDF2、YTHDF3、IGF2BP1、IGF2BP2、IGF2BP3等负责识别m6A修饰蛋白[14-15]。
METTL3目前公认的可有效催化m6A功能蛋白的重要生物活性物质,有研究指出,METTL3在细胞内可有效催化RRACH出现m6A修饰[16-17]。METTL3广泛分布在真核生物中并具高度保守性,METTL3具多种调控生物学功能的作用,早期胚胎会由于出现METTL3基因敲除而出现致死[18]。研究结果显示,在哺乳动物胚胎发育中METTL3扮演十分重要的作用,并属于生物调剂过程中扮演不可或缺角色[19]。有研究结果显示,氧诱导视网膜病变模型中可通过将METTL3敲除后有效抑制角膜新生血管形成,结果显示血管生成与METTL3紧密相关,许多生理和病理过程均与血管生存高度相关,包括伤口愈合、胚胎发育、肿瘤生长、组织再生[20]。在多种肿瘤的发生和发展过程中METTL3扮演十分重要作用,并可有效调节肿瘤细胞迁移和侵袭。
自首次发现m6A修饰依赖作用,相关研究也逐渐受到人们的广泛关注,且在正常的生物发育过程中扮演十分重要角色,m6A修饰起到动态平衡的调节作用。RNA m6A修饰可有效通过m6A甲基转移酶复合物执行,通过依赖Fe(Ⅱ)和αKG去甲基化酶有效去除后实现生理和病理条件m6A甲基化动态调节。作为m6A甲基转移酶复合物催化中心,METTL3以YTHDF2依赖促进细胞信号因子抑制子2 mRNA降解,并在多种肿瘤发生和发展过程中起到重要作用[21]。但METTL3是否可介导m6A修饰影响儿童肝母细胞瘤的发生发展仍鲜有报道。本组研究结果显示,采用METTL3 sgRNA干预后会显著降低细胞METTL3表达水平,sgRNA组细胞48 h和72 h时细胞增殖水平明显低于空载体组。进一步分析细胞迁移和侵袭显示,sgRNA组细胞24 h和48 h时细胞迁移和侵袭水平明显低于空载体组。通过分析METTL3与IGF2BP3关系分析显示,sgRNA组细胞中IGF2BP3蛋白及mRNA表达水平明显低于空载体组。对m6A甲基化水平进行检测显示,sgRNA组细胞中m6A-IP及IGF2BP3 m6A相对表达量明显低于空载体组。在METTL3敲低后会有效介导IGF2BP3 m6A修饰途径,METTL3缺失后持续调节mRNA甲基化。分析认为,通过有效调节METTL3可有效调节细胞增殖、迁移,进一步分析其作用机制认为,METTL3会有效调节IGF2BP3 m6A修饰而发挥其生理学活性和作用。通过降低METTL3水平会有效抑制和调控细胞周期信号通路,激活细胞凋亡相关信号通路,且其可促进肝细胞凋亡,具有十分重要的作用。
综上所述,METTL3可有效调节IGF2BP3 m6A修饰并对儿童肝母细胞瘤细胞增殖、迁移进行调控。但METTL3是否可作为临床治疗儿童肝母瘤细胞的潜在靶点,还有待深入研究和分析。
猜你喜欢 母细胞甲基化孵育 成人幕上髓母细胞瘤1例误诊分析中国临床医学影像杂志(2022年6期)2022-07-26LINC00612靶向结合Bcl-2抑制Aβ1-42孵育的神经元凋亡中风与神经疾病杂志(2021年9期)2021-11-08顶骨炎性肌纤维母细胞瘤一例国际放射医学核医学杂志(2021年10期)2021-02-28髓外硬膜内软骨母细胞瘤1例中国临床医学影像杂志(2019年1期)2019-04-25预防小儿母细胞瘤,10个细节别忽视中国生殖健康(2019年9期)2019-01-07三物黄芩汤组分(群)配伍在大鼠肝微粒体孵育模型中的相互作用中成药(2017年9期)2017-12-19大鼠肝微粒体孵育体系中2种成分的测定及其代谢中成药(2017年5期)2017-06-13应用快速孵育法优化酶联免疫吸附实验过程探讨——以乙型肝炎病毒表面抗原检测为例标记免疫分析与临床(2016年9期)2016-11-21肝癌组织hSulf-1基因表达与其甲基化状态的关系医学研究杂志(2015年12期)2015-06-10应用磁珠法检测并提取尿液游离甲基化DNA中国医科大学学报(2015年10期)2015-03-01推荐访问:细胞 增殖 迁移