黄芪多糖与丹酚酸,B,配伍对,TGF-β1,诱导的肺上皮细胞间质转化的影响
来源:优秀文章 发布时间:2023-02-17 点击:
李晗 宋玲 高云航 陈腾飞 侯红平 叶祖光 张广平
肺纤维化是由多种因素所致严重的肺间质慢性疾病,为众多肺部疾病的最终表现结果。
该病早期以下呼吸道急性炎症反应为主,后期发展为成纤维细胞过度增殖与细胞外基质(extracellular matrixc,ECM)过量沉积,最终导致呼吸衰竭。
肺纤维化成因复杂,具体发病机制尚未完全阐明,因此该疾病也成为呼吸系统最严重疾病之一[1]。
当前研究发现肺泡上皮—间质转化( epithelialmesenchymal transition,EMT)是纤维化形成中的关键,因此有学者认为抑制EMT 是预防纤维化的有效手段[2-3]。
转化生长因子-β1(transforming growth factor-β1,TGF-β1)是 EMT 过程的总开关,其可促进间质细胞的增殖和分化,促进ECM 的沉积,因此其被认为是最重要的致纤维化因子[4]。
迄今,临床治疗肺纤维化多选用吡非尼酮、尼达尼布和糖皮质激,该药物虽能改善肺部炎症的发生与延缓纤维化进展,但均伴有严重的胃肠道副作用[5]。
如何利用传统中医理论和中药来治疗肺纤维化,已经成为科研人员关注的热点。
在中医古籍中并无“肺纤维化”的记载,但根据其临床症状,多将其归属于“肺痿”与“肺痹”的范畴,且病机主要为“气虚血瘀”,基本治疗方法则多采用益气活血法,选用黄芪丹参相伍,益气活血,补而不滞。
同时,本课题组前期发现,黄芪多糖(astragalus polysaccharides, APS) 与 丹 酚 酸 B(salvianolic acid B,Sal B)配伍具有改善博来霉素致大鼠肺纤维化的作用,且丹酚酸对TGF-β1 诱导的EMT 具有抑制作用[6]。
因此本研究在前期已确定黄芪多糖与丹酚酸B 具有抗PF 药效作用基础上,以人肺泡上皮细胞株A549 为研究对象,进一步揭示黄芪多糖与丹酚酸B 配伍对TGF-β1 诱导的肺上皮细胞间质转化的影响。
1.1 细胞株
人肺泡上皮细胞A549 细胞株,购于北京协和医院研究所细胞库。
1.2 药物与试剂
黄芪多糖(上海赫澎科技生物公司,批号:HPBIO-B549);丹酚酸B(成都曼思特科技生物公司,批号:MUST-18070503);TGF-β1 人重组蛋白(美国Peprotech 公司,批号:081735);二甲基亚砜(美国Sigma 公司);1640 培养基(美国 Gibco 公司,批号:8119258);FBS 胎牛血清(美国 Gibco 公司,批号:2019-05-07);胰蛋白酶(上海Sangon Biotech 公司,批号:T1350);MTS 细胞存活率试剂盒(美国Promega 公司,批号:0000352619);人源纤连蛋白和人I 型胶原蛋白酶联免疫吸附测定(ELISA)试剂盒(武汉华美生物科技有限公司,批号:J05037340、J23037588);RNA 提取试剂盒(北京天根生物有限公司,批号:U9019);反转录与real time PCR 试剂盒(北京全式金公司,批号:51219);Western blot 凝胶电泳配制试剂盒与BCA 蛋白定量试剂盒(北京康为世纪公司,批号:40415);一抗E-Cadherin 抗体(美国 Cell Signaling Technology 公司,批号:14472S),一抗α-SMA 抗体和Vimentin 抗体(英国Abcam 公司,批号: GR282976-35、 GR3186827-26); 二 抗 HRP-labeled Goat Anti-Rabbit IgG 抗体(上海碧云天生物技术有限公司,批号:A2016);其他化学与生物试剂均为国产分析纯。
1.3 主要实验仪器
二氧化碳培养箱(美国 Thermo 公司);Eppendorf5810R 型台式高速离心机(德国Eppendorf公司);CKX53 型倒置显微镜(日本Olympus 公司);SpectraMax i3x 型多标记酶标仪(美国 Molecular Devices 公司);Western blot 垂直电泳槽(美国 Bio-Rad);Western blot 转膜仪(美国 Bio-Rad 公司);SCILOGEX 180-E 水平摇床(杭州奥盛仪器有限公司);凝胶成像仪(美国GE 公司)。
1.4 实验方法
1.4.1 细胞培养 取冻存于-80℃低温冰箱的人肺泡上皮A549 细胞,快速转移至37℃水浴锅中进行解冻,生长在含有10%胎牛血清、100 μg/mL 青霉素—链霉素、1%非必需氨基酸的1640 培养基中,于37℃,5% CO2饱和湿度的条件下贴壁培养,待细胞汇合至80%时,按1 ∶3 的比例传代,取对数生长期的细胞用于实验。
1.4.2 细胞活力测定(MTS)法筛选出黄芪多糖与丹酚酸B 单用的安全浓度 待A549 细胞培养至对数期时,将该细胞以2×104个/孔细胞的密度接种于透明96 孔板,常规培养24 小时后,显微镜下观察,待细胞融合至80%时,换成无血清培养基,饥饿处理12 小时。
实验分为空白组、黄芪多糖组(10、20、40、60、80 mg/L)、丹酚酸 B 组(10、20、40、60、80 mg/L),每组设3 个复孔。
确定安全浓度后培养24、48 小时后,向 96 孔板中加入 20 μL/孔的 MTS,放置37℃,5% CO2 培养箱中避光孵育2 小时,孵育完毕后,利用酶标仪测定波长为490 nm 处的吸光度OD 值。
1.4.3 MTS 法筛选出黄芪多糖与丹酚酸B 配伍的安全浓度 待A549 细胞培养至对数期时,将该细胞以2×104个/孔细胞的密度接种于透明96 孔板,常规培养24 小时后,显微镜下观察,待细胞融合至80%时,换成无血清培养基,饥饿处理12 小时。
实验分为空白组、黄芪多糖组(60 mg/L APS)、丹酚酸B 组(60 mg/L Sal B)、配伍组(60 mg/L APS + 60 mg/L Sal B),每组设 3 个复孔。
培养 24、48 小时后,向96 孔板中加入20 μL/孔的 MTS,放置37℃,5% CO2培养箱中避光孵育2 小时,孵育完毕后,利用酶标仪测定波长为490 nm 处的吸光度OD 值。
1.5 检测指标
1.5.1 MTS 法检测芪多糖与丹酚酸B 配伍对TGF-β1诱导的肺上皮细胞增殖的影响 取对数生长期的A549 细胞,以 2×104个/孔细胞密度接种于 96 孔板,培养24 小时后于光镜下观察,细胞状态稳定、贴壁生长及增殖状态正常。
在前期实验筛选出对A549 细胞无增殖抑制的浓度范围下,将细胞分为空白组、模型组(5 μg/mL TGF-β1)[7]、丹酚酸 B 组(5 μg/mL TGF-β1+60 mg/L Sal B)、黄芪多糖组(5 μg/mL TGF-β1+60 mg/L APS)、配伍组(5 μg/mL TGF-β1+60 mg/L Sal B+60 mg/L APS)每组设3个复孔。
培养 24、48 小时后,向 96 孔板中加入20 μL/孔的MTS,放置37℃,5% CO2培养箱中避光孵育2 小时,酶标仪测定波长为490 nm 处的吸光度OD 值。
1.5.2 实时荧光定量PCR 法(real-time PCR,RTPCR)检测 E-钙黏蛋白(E-Cadherin,E-Cad)、α-平滑肌肌动蛋白(α-Smooth muscle actin,α-SMA)和波形蛋白(vimentin,Vim)的转录水平 将对数生长期的A549 细胞以细胞数3×105/孔接种于6 孔板中,将细胞分为空白组、模型组(5 μg/mL TGF-β1)、丹酚酸 B 组(5 μg/mL TGF-β1+60 mg/L Sal B)、黄芪多糖组(5 μg/mL TGF-β1+60 mg/L APS)、配伍组(5 μg/mL TGF-β1+60 mg/L Sal B+60 mg/L APS),药物处理24 小时后,消化离心得到细胞,每个EP管中加入Trizol 提取细胞总RNA,用紫外分光光度计检测RNA 浓度和纯度(OD260/OD280 的值为1.8 ~2.0)。
取总 RNA 1 000 ng,按照说明书将总RNA 逆转录成cDNA 后进行RT-PCR 检测,检测采用Syber Green 法,PCR 反应条件为预变性94℃ 20秒,循环时94℃ 5 秒,60℃ 15 秒,72℃ 10 秒,共40个循环,最终所得数据以 2-(ΔCt实验对照组-ΔCt空白对照组)值表示各目标基因mRNA 相对表达水平,引物序列见表1。

表1 引物序列
1.5.3 蛋白免疫印迹法(Western blot)检测E-Cad、α-SMA 和Vim 的蛋白表达 将对数生长期的A549细胞以3×105个/孔的密度接种于6 孔板中,待细胞融合至80%时,分组及加药同“1.5.2”项。
培养24小时后,胰酶消化离心法收集细胞,每个EP 管中加入含蛋白酶抑制剂的裂解液100 μL 提取全蛋白。加入裂解液后,将EP 管置于冰浴中裂解30 分钟,反复吹打,12 000 r/分钟、4℃条件下离心10 分钟,即得到蛋白。
BCA 法测定蛋白浓度,将蛋白加入loading buffer 后,于 100℃、10 分钟条件下变性,50 μg蛋白经8%SDS-PAGE 电泳后分离,切胶后,将蛋白电转移至PVDF 膜,室温下用5%脱脂牛奶封闭1 小时,并孵育 E-Cad(1 ∶1 000)、Vim(1 ∶1 000)、α-SMA(1 ∶1 000)与 GAPDH(1 ∶1 000)的一抗,4℃封闭过夜,TBST 洗膜3 次,孵育二抗(1 ∶1 000),置于摇床上室温孵育1 小时,TBST 洗膜3 次,加入ECL避光显色,显影后利用凝胶成像系统拍照记录,并用Image J 软件计算灰度值,以目的蛋白与GAPDH 蛋白灰度值的比值作为各组蛋白表达的相对含量。
1.5.4 酶联免疫吸附法检测纤连蛋白(fibronectin,FN)和I 型胶原蛋白(collagen-I,Col-I)的含量 将对数生长期的A549 细胞以3×105个/孔接种于6 孔板,待细胞融合至80%时,分组及加药同“1.5.2”项。
加药后细胞放置于37℃,5% CO2培养箱中培养24 小时后,收集细胞培养液,并于4℃,3 000 r/分钟离心15 分钟以去除培养液中的细胞碎片及杂质,取上清。
采用BCA 法测定蛋白总浓度,按照试剂盒说明书,按照FN 和Col-I 酶联免疫检测试剂盒说明书进行检测。
1.6 统计学处理
实验所得数据为计量资料,采用SPSS 20.0 统计软件进行分析,经检验所有数据符合正态分布且方差齐,以均数±标准差()表示。
组间比较采用单因素方差分析(one way-ANOVA),两两比较采用LSD 法,P<0.05 为差异具有统计学意义。
2.1 MTS 法筛选黄芪多糖与丹酚酸B 单用对A549细胞活性无影响的药物浓度
与空白组比较,培养48 小时后,黄芪多糖80 mg/L与丹酚酸B 80 mg/L 对A549 细胞的增殖抑制作用显著(P<0.01),见表2、3。
因此本实验选择丹酚酸B 60 mg/L 与黄芪多糖60 mg/L 进行后续实验。
表2 不同浓度黄芪多糖对A549 细胞增殖的影响(,n=3)

表2 不同浓度黄芪多糖对A549 细胞增殖的影响(,n=3)
注: 与空白组比较,aP<0.05。
- 0.67±0.02 1.09±0.02黄芪多糖组 80 0.70±0.03 0.37±0.02a 60 0.60±0.01 1.05±0.02 40 0.70±0.02 1.17±0.05 20 0.67±0.02 1.25±0.02小时空白组组别 浓度(mg/L) 24 小时 48 10 0.68±0.02 1.24±0.03
2.2 MTS 法筛选黄芪多糖、丹酚酸 B 及配伍对A549 细胞活性无影响的药物浓度
与空白组比较,黄芪多糖60 mg/L、丹酚酸 B 60 mg/L及其配伍组的细胞活性无显著性差异。
见表4。
表3 不同浓度丹酚酸B 对A549 细胞增殖的影响(,n=3)

表3 不同浓度丹酚酸B 对A549 细胞增殖的影响(,n=3)
注: 与空白组比较,aP<0.05。
组别 浓度(mg/L) 24 小时 48- 0.68±0.02 1.19±0.02丹酚酸 B 组 80 0.63±0.01 0.60±0.01a 60 0.88±0.02 1.50±0.10 40 0.88±0.06 1.48±0.12 20 0.80±0.05 1.40±0.09小时空白组10 0.67±0.04 1.29±0.02
表4 黄芪多糖、丹酚酸B 及配伍对A549 细胞增殖的影响(,n=3)

表4 黄芪多糖、丹酚酸B 及配伍对A549 细胞增殖的影响(,n=3)
1.04±0.03 2.02±0.07黄芪多糖组 1.06±0.04 2.18±0.16丹酚酸 B 组 1.09±0.04 2.03±0.07配伍组小时空白组组别 24 小时 48 1.10±0.11 2.13±0.02
2.3 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞增殖的影响
与空白组比较,模型组在培养24、48 小时后细胞增殖出现抑制现象(P<0.01);与模型组比,培养24、48 小时后丹酚酸B 组和配伍组对细胞增殖抑制作用明显(P<0.05)。
见表5。
表5 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞增殖抑制作用(,n=3)

表5 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞增殖抑制作用(,n=3)
注: 与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05。
1.06±0.02 2.16±0.03模型组 0.88±0.02b 1.61±0.04a黄芪多糖组 0.89±0.03 1.69±0.04丹酚酸 B 组 0.61±0.03c 1.39±0.04c配伍组 0.68±0.03c 1.20±0.17小时空白组组别 24 小时 48 c
2.4 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞 E-Cad、Vim 和 α-SMA 的 mRNA 转录水平的影响
与空白组比较,模型组E-Cad mRNA 转录水平显著性下调(P<0.01),Vim mRNA 转录水平显著性上调(P<0.05)。
与模型组比较,黄芪多糖组、丹酚酸B 组和配伍组细胞E-Cad 的mRNA 转录水平显著性上调(P<0.01),同时三组均下调了Vim 和α-SMA mRNA 转录水平(P<0.05)。
见表 6。
表6 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞 E-Cad、Vim 及 α-SMA mRNA 转录水平的影响(,n=3)

表6 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞 E-Cad、Vim 及 α-SMA mRNA 转录水平的影响(,n=3)
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01。
1.00±0.14 1.00±0.13 1.00±0.13模型组 0.35±0.08a 2.24±0.11a 1.12±0.01黄芪多糖组 0.43±0.07c 1.57±0.03b 0.95±0.03b丹酚酸 B 组 0.52±0.03c 2.08±0.05b 0.39±0.01b配伍组 0.74±0.06c 1.31±0.05b 0.52±0.06-SMA/GAPDH空白组组别 E-Cad/GAPDH Vim/GAPDH α b
2.5 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞 E-Cad、Vim 和 α-SMA 蛋白表达量的影响
与空白组比较,模型组E-Cad 蛋白表达量显著性降低(P<0.01),Vim 和α-SMA 蛋白表达量显著性增加(P<0.01)。
与模型组比较,丹酚酸B 组和配伍组E-Cad 的表达量显著性增加(P<0.01),Vim的表达量显著性降低(P<0.01),且配伍组α-SMA表达量显著性降低(P<0.01),见图1 和表7。

图1 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞 E-Cad、Vim 及 α-SMA 表达的影响
表7 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞 E-Cad、Vim 及 α-SMA 蛋白表达的影响(,n=3)
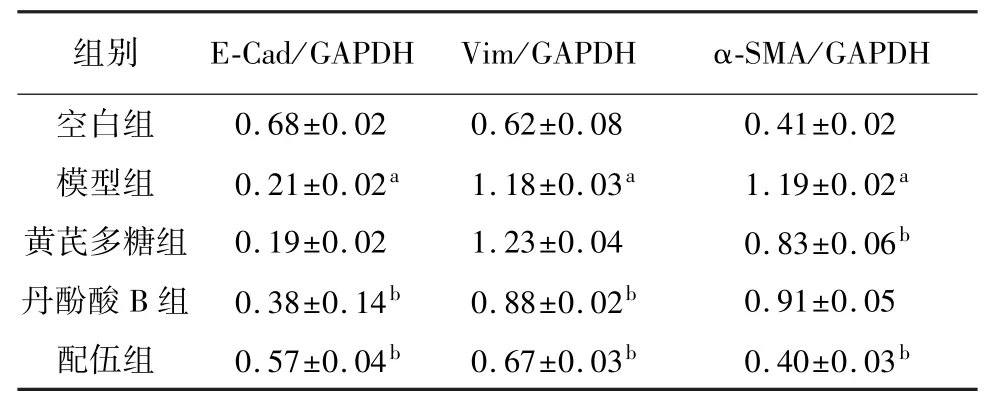
表7 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞 E-Cad、Vim 及 α-SMA 蛋白表达的影响(,n=3)
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.01。
0.68±0.02 0.62±0.08 0.41±0.02模型组 0.21±0.02a 1.18±0.03a 1.19±0.02a黄芪多糖组 0.19±0.02 1.23±0.04 0.83±0.06b丹酚酸 B 组 0.38±0.14b 0.88±0.02b 0.91±0.05配伍组 0.57±0.04b 0.67±0.03b 0.40±0.03空白组b-SMA/GAPDH组别 E-Cad/GAPDH Vim/GAPDH α
2.6 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞FN 和Col-I 表达量的影响
与空白组比,模型组FN 和Col-I 的表达量明显增加(P<0.05);与模型组比较,配伍组细胞FN 和Col-I 的表达量明显降低(P<0.05)。
同时,配伍组FN 和Col-I 的表达量低于黄芪多糖组(P<0.05)。见表8。
表8 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞FN 和Col-I 表达的影响(,n=3)

表8 黄芪多糖、丹酚酸B 及配伍对TGF-β1 诱导的A549 细胞FN 和Col-I 表达的影响(,n=3)
注: 与空白组比较,aP<0.05;与模型组比较,b P<0.05;与黄芪多糖组比较,cP<0.05。
组别 FN(pg/mL) Col-I(pg/mL)0.04±0.00 0.21±0.01模型组 0.09±0.00a 0.33±0.01a黄芪多糖组 0.11±0.00b 0.37±0.01丹酚酸 B 组 0.05±0.00b 0.24±0.01b配伍组 0.05±0.00bc 0.28±0.01空白组bc
在现代医学概念中,肺纤维化为一种慢性、进行性、病因尚未明确的致死性肺部疾病。
中医学将肺纤维化多归属于“肺痹”与“肺痿”等病证范畴,主要病机为气滞血瘀。
众多医家均认为,益气与活血需贯穿整个治疗过程,同时在治疗肺纤维化的高频药物分析中也显示,黄芪与丹参已经成为中医临床治疗肺纤维化的首选药对[8-10]。
黄芪味甘,性微温,归肺、脾经,具有补气升阳、固表止汗、利水消肿、托毒排脓等功效。
其中黄芪多糖抗氧化能力显著,其能明显减少自由基,抑制脂质过氧化物反应,减弱气道重塑及肺泡损伤发生的可能性[11],并能通过调控与肺纤维化凋亡相关通路例如Bax 及Bcl-2 信号途径蛋白表达量和抑制非Smad/TGF-β1 信号通路来干预肺纤维化的发生[12-13]。
丹参因具有活血祛瘀、通经止痛、清心除烦和凉血消痈的作用,被《神农本草经》列为上品[14]。
相关研究显示,丹参有效成分都可以延缓大鼠肺泡炎与肺纤维化的进程,并能下调大鼠肺组织TGF-β1 的蛋白表达水平与羟脯氨酸的含量,同时还可进一步通过调控Smad/TGF-β1 信号转导通路,影响机体氧化/抗氧化的平衡,起到防治肺纤维化的作用[15-20]。
与此同时,本课题组前期研究发现,与黄芪和丹参的有效成分单用组相比,黄芪多糖与丹酚酸B 配伍组对博来霉素所致大鼠肺纤维化模型的改善效果更优,且在细胞水平进行的丹酚酸A、丹参酮ⅡA 和丹参素进行比较研究中,也发现丹酚酸B 通过调节TGF-β1 诱导的A549细胞的存活率、FN、Col-I 和E-Cad 等代表性指标,产生抑制EMT 的作用[6]。
因此本实验基于前期基础上选择黄芪多糖配伍丹酚酸B,从益气活血角度进行体外实验。
肺纤维化是一个复杂的病理过程,特征主要为肺上皮细胞严重损伤,(肌)成纤维化细胞增殖和异常的胶原沉积所导致的损伤过度修复。
其中,肺上皮细胞的损伤和功能障碍是启动肺纤维化的核心。当肺上皮细胞持续损伤时,精疲力竭的Ⅱ型肺泡上皮细胞无法向Ⅰ型肺泡上皮细胞转化,有可能引起EMT 的上游信号通路的激活,进而导致(肌)成纤维细胞的积累以及细胞外基质的沉积,产生纤维化灶[21]。
同时,ECM 作为由分泌蛋白相互连接而形成的动态支架,始终在进行重塑,以此来维持组织损伤修复与稳态[22]。
α-SMA 作为平滑肌细胞收缩结构的基础,主要分布于血管平滑肌与肌上皮细胞中,其可反映平滑肌的数量与收缩能力。
Vim 则为一种重要的细胞骨架蛋白,在发生肺纤维化时表达量增加[23]。
上皮细胞特异性表型的跨膜粘附受体E-Cad 可作为EMT 过程中上皮细胞的标志物。
在肺纤维化过程中,纤维化程度越高,E-Cad 表达量越低[24]。
FN 为一种二聚糖蛋白,是成纤维细胞主要的趋化因子与活化因子,当FN 表达量增加时,会引发趋化细胞迁移,并使纤维化细胞发生聚集[25]。
胶原作为ECM 的重要成分之一,当EMT 发生时,胶原合成和降解的平衡遭到破坏,COL-I 表达增加导致ECM 沉积,因此COL-I 对维持肺的扩张性程度起着决定性的作用[26]。
在氧化应激、炎性因子和细胞因子尤其是TGF-β1 的刺激下,肺泡上皮细胞逐渐失去紧密连接以及上皮E-Cad,获得α-SMA 和Vim 等(肌)成纤维细胞特异性蛋白,并沿着新分泌的ECM的代表性组成成分 FN 与 COL-I 迁移。
因此,α-SMA、Vim、E-Cad、FN、COL-I 的表达异常是畸形激活EMT 的关键指标[27]。
本研究结果显示,实验药物能下调α-SMA、Vim基因与蛋白的表达,上调E-Cad 的表达,且黄芪多糖与丹酚酸B 配伍组效果优于单用组。
同时,黄芪多糖与丹酚酸B 配伍后可抑制ECM 成分FN、COL-I的表达,结果表明黄芪—丹参组分配伍能一定程度抑制TGF-β1 的刺激下肺泡上皮细胞的EMT 进程,从而削弱肺纤维化程度,这些作用机制的揭示为指导临床用药提供了可靠的药理学依据,但其作用与机制仍有待进一步深入探讨。
猜你喜欢 肺纤维化酚酸批号 我国研究人员探索肺纤维化治疗新策略中老年保健(2022年2期)2022-11-25一种JTIDS 信号批号的离线合批方法航天电子对抗(2022年4期)2022-10-24遗传性T淋巴细胞免疫缺陷在百草枯所致肺纤维化中的作用昆明医科大学学报(2022年4期)2022-05-23滇龙胆草对肺纤维化小鼠肺组织NF-κB和CTGF表达的影响昆明医科大学学报(2021年4期)2021-07-23双咖酚酸在小鼠体内的药物代谢动力学与组织分布烟台大学学报(自然科学与工程版)(2021年1期)2021-03-19医学科技期刊中药品生产批号标注探析中国科技纵横(2018年2期)2018-11-29丹参中丹酚酸A转化方法中成药(2018年9期)2018-10-09中药材批号划分与质量管理中成药(2018年7期)2018-08-04川芎总酚酸提取工艺的优化中成药(2018年7期)2018-08-04注射用丹参多酚酸与12种常用注射剂的配伍稳定性中成药(2018年2期)2018-05-09推荐访问:配伍 黄芪 多糖推荐文章
- 大学生违规检讨书范文【三篇】:学生通用检讨书10000字
- 2018年农村青年入党申请书 2018农村青年入党申请书【五篇】
- 【小学二年级描写春天的作文500字】 小学二年级描写夏天的作文
- 安徽省宿州市埇桥区天气 安徽省宿州市埇桥区兴农供销集团有限责任公司招聘公告
- [河北省2018上半年教师资格考试面试成绩查询入口【已公布】]2018中级会计成绩查询
- 【2018上半年广东教师资格面试成绩查询入口【已公布】】2018中级会计成绩查询
- [上班早退检讨书]员工早退检讨书怎么写
- 江苏省中国科学院植物研究所2018专业技术岗招聘启事:中国科学院植物研究所
- 【2018年9月山东全国计算机等级考试网报时间:6月19日】2018年9月全国计算机等级考试
- [澳洲188C投资移民政策]投资移民加拿大条件