补充维生素D对非酒精性脂肪肝病患者肠道菌群的影响
来源:优秀文章 发布时间:2023-02-17 点击:
韩源平 徐思雅† 蒋希乐
(1.四川大学生命科学学院,四川 成都 610065;
2.四川大学华西医院,四川 成都 610041)
非酒精性脂肪肝病(Nonalcoholic Fatty Liver Disease,NAFLD)是目前最为常见的一种慢性肝病,它是一种与胰岛素抵抗、遗传易感密切相关的代谢应激性肝损伤,疾病谱包括非酒精性脂肪肝(Nonalcoholic Fatty Liver,NAFL)、非酒精性脂肪性肝炎(Nonalcoholic Steatohepatitis,NASH)、肝硬化(Cirrhosis)和肝细胞癌(Hepatocellular Carcinoma,HCC)[1-2]。NAFLD近年来在全球的患病率不断上升,约占全球人口的25.2%[3]。目前我国已有超过2.4亿NAFLD患者[4],有预测分析认为,中国将成为全球NAFLD患病率增长最快的国家,到2030年患病人数将突破3.1亿[5]。目前对于NAFLD的治疗主要从降脂、保肝及抗氧化切入,尚无针对NAFLD的特效药物,可以预见未来NAFLD将成为全球公共卫生的一个重大挑战[6-7]。
代谢综合征(Metabolic Syndrome,MetS)被认为是NAFLD最重要的风险因素,包括胰岛素抵抗、肥胖、血脂异常和高血压等,与NAFLD发病密切相关,同时NAFLD也会促进MetS进一步发展,从而引发心血管疾病[1,6]。NAFLD发病机制复杂,传统观点认为NAFLD发病主要来源于“二次打击”,“首次打击”为胰岛素抵抗,导致甘油三酯代谢异常,引发肝脏脂肪堆积,肝脏代谢功能受损,从而导致肝脏脂肪变性,同时增加了肝脏对外界刺激的易感性;
“第二次打击”则为氧化应激,进一步加剧肝损伤,伴随肝脏炎症与肝纤维化[8]。随着研究的深入,NAFLD被认为是由多种致病因素共同作用而引发,包括脂质过氧化、线粒体功能障碍、内质网应激、肠道菌群失调等[9]。
近年来,越来越多的研究表明肠道菌群通过“肠-肝轴”参与了NAFLD的发生发展[10]。长期高脂饮食会引起肠道通透性增加,肠道菌群组成改变,导致血清内毒素、内源性乙醇水平升高,促炎因子水平上升,进而促进肝脏炎症及纤维化进程[11]。借助于动物模型,研究发现肠道菌群能通过影响代谢进程、免疫功能参与NAFLD的进展[10],包括肝脏炎症、内毒素血症、肥胖症、胆碱代谢紊乱等[12]。此外,已有临床研究揭示了NAFLD患者相比健康人群肠道菌群的异常表现,如菌群多样性降低,特定菌相对丰度水平显著变化等[13-15]。
维生素D(VD)缺乏已被证实与NAFLD密切相关[16-17],NAFLD患者的血清25(OH)D水平显著低于健康人群[18],VD缺乏现象在NAFLD患者中相比健康人群多26%[19]。笔者所在课题组通过前期动物实验,证明了VD缺乏会加重高脂饮食引起的肝脂肪变性和代谢紊乱[20],并且VD缺乏会促进炎症反应,导致肠道菌群的紊乱,在临床试验中也得到了印证[21]。此外,已有研究报道,补充VD能调节肠道菌群[22-23],提高健康人体肠道菌群的多样性[24]。然而目前关于补充VD对于NAFLD患者肠道菌群的临床作用研究较少。本研究借助高通量测序及生物信息学分析方法,开展随机对照临床试验,评估补充VD对于NAFLD患者肠道菌群的影响,从而为今后探索通过补充VD调节肠道菌群,进而缓解NAFLD提供参考。
1.1 研究对象
本研究为随机对照临床试验,于2018年8月至2020年1月在成都市公共卫生临床医疗中心,共入组29例NAFLD患者。本次临床试验已在中国临床试验注册中心进行注册,注册号为ChiCTR1800017-879。本次研究方案已获成都市公共卫生与临床中心医学伦理委员会批准(#2018Y001)。
纳入标准:(1)年龄介于18到60岁之间;
(2)符合中国《非酒精性脂肪性肝病诊疗指南》(2018版),通过腹部彩超检查或CT、MRI检查显示为脂肪肝;
(3)丙氨酸氨基转移酶(ALT)≥正常上限的2倍(80 U/L)或谷氨酰转肽酶(GGT)≥正常上限的1.5倍(75 U/L);
(4)过往没有饮酒史或饮酒折合乙醇量小于140 g/周(女性小于70 g/周);
(5)HBsAg(+)或者HCV-RNA(+);
(6)血清钙、磷正常;
(7)签署知情同意书,自愿参加本研究者。
排除标准:(1)患有其它严重疾病;
(2)抗HIV阳性者;
(3)哺乳或妊娠期妇女;
(4)过往具有不健康饮酒史(饮酒折合乙醇量男性大于140 g/周,女性大于70 g/周);
(5)药物滥用者;
(6)过去6个月有服用VD史;
(7)纳入研究前3个月体重下降超过5%;
(8)酒精性肝病;
(9)其它药物性肝病、全胃肠外营养、肝豆状核变性、自身免疫性肝病等可导致脂肪肝的特定疾病;
(10)合并其他严重的全身性疾病和精神病患者;
(11)依从性差,不能保证按本研究完成研究者。
在入组开展试验之前,本次试验研究对象均对治疗及采样流程进行了详细了解,并签署了知情同意书。
1.2 分组与干预
本次试验目的是为了探索补充VD对NAFLD的缓解作用,采取了在内科治疗的基础上,以肌肉注射的方式,给NAFLD患者补充VD。
所有受试者随机分成对照组和VD组:对照组15例,治疗期间只进行内科治疗,即1日1次给患者静脉注射多烯磷脂酰胆碱注射液(天兴,成都天台山制药有限公司)10 mL,1日1次复方二氯醋酸二异丙胺(雅普宜,海南灵康制药有限公司)80 mg;
VD组14例,治疗期间在内科治疗的基础上,肌肉注射维生素D2注射液(华润双鹤药业股份有限公司),将入组时间计为第0天,一次性补充60万单位维生素D2。为保证用量安全,注射剂量严格参照中国药典剂量标准以及维生素D2注射液说明书用法用量指示。
30天后对患者进行血液生化全套检查(日立全自动生化分析仪7600型),包括肝功、肾功、血脂、血糖等指标,测定患者血清25(OH)D浓度(25-羟基维生素D ELISA试剂盒,英国艾狄斯公司),并且对患者粪便进行取样。详细检查指标包括ALT、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、GGT、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLO)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、总胆汁酸(TBA)、尿素(UREA)、肌酐(CR)、尿酸(UA),血钙(CA)、血磷(P)、血糖(GLU)、胰岛素(INS)、总胆固醇(CHOL)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.3 粪便DNA提取及检测
采集入组研究对象的粪便样本时,取0.25 g新鲜粪便样本保存于1.5 mL无菌离心管中,采集后的样本立即置于冰上,之后转移至-80℃冰箱保存待用。提取粪便样本DNA按照QIAamp®PowerFecal® DNA Kit(50)试剂盒的操作步骤进行,完成后将粪便DNA交由北京诺禾致源生物信息科技有限公司进行16S rRNA测序分析(Ion S5TMXL高通量测序)。
1.4 统计分析
组间临床指标基线水平、肠道菌群变化趋势的比较,采用Mann-WhitneyU检验、独立样本t检验;
组内治疗前后肠道菌群变化的比较,采用Wilcoxon秩和检验、配对样本t检验;
对组内、组间治疗前后进行聚类差异比较,采用Adonis(非参数多因素方差分析)检验;
生化指标与肠道菌群特定菌类之间的关联性分析采用Spearman相关性分析。计量资料以平均值±标准差表示。以上统计检验均由GraphPad Prism(Version 6.01,USA)软件进行计算,P<0.05为差异具有统计学意义。
2.1 受试者基本资料
本研究从完成试验NAFLD患者中随机选取29例患者的粪便样本,进行了肠道菌群16S rRNA测序。其中对照组15例,包含男性9例,女性6例,平均(36.50±1.97)岁;
VD组14例,包含男性10例,女性4例,平均(35.00±2.67)岁;
两组研究对象性别、年龄比较均无显著差异(P>0.05)。测序完成后,对两组患者的肠道菌群变化进行了细致分析。
2.2 NAFLD患者在治疗期间,25(OH)D水平的变化情况
为了保证肌肉注射维生素D2的有效性,本研究测定了两组患者在治疗前后血清25(OH)D水平,发现在对照组和VD组患者中,25(OH)D的基线水平无显著差异(P>0.05),基本在25~75 nmol/L之间,即处于不足(50~75 nmol/L,占51.7%)或缺乏(小于50 nmol/L,占44.8%)的状态,充足仅占3.4%(VD组有一位患者的25(OH)D为91.13 nmol/L)。治疗后,对照组患者的25(OH)D未发生显著变化(P>0.05),而VD组患者的25(OH)D水平出现显著升高(P<0.05)。组间比较,治疗后VD组25(OH)D水平明显高于对照组(P<0.01)。证实了补充维生素D2能有效提高NAFLD患者的血清25(OH)D水平,具体见表1。

表1 NAFLD患者血清25(OH)D均值在治疗期间的变化水平Table 1 Mean serum 25(OH)D levels in NAFLD patients during the clinical treatment nmol/L
2.3 NAFLD患者在治疗期间,血清生化指标的变化情况
为了评判VD对NAFLD的治疗效果,本研究测定了血清生化指标。部分指标在两组患者的组内、组间出现显著变化。组内比较显示:VD组的ALT显著下降(P<0.001),TP显著上升(P<0.05),ALB显著上升(P<0.01),CA显著上升(P<0.05),AST有显著下降的趋势(P=0.08);
而对照组的GLO在治疗后出现显著上升(P<0.05),P显著下降(P<0.01)。组间比较显示:治疗前生化指标无显著差异(P>0.05),治疗后VD组ALB(P<0.05)、UREA(P<0.05)显著高于对照组,HDL-C显著低于对照组(P<0.01),具体见表2。

表2 NAFLD患者在治疗期间生化指标均值的变化情况Table 2 Variation of mean biochemistry index in NAFLD patients during the clinical treatment
2.4 NAFLD患者肠道菌群OTU分布
根据维恩图所示,两组NAFLD患者治疗前后共检出808个OTU,对照组第0天有624个,第30天有635个,VD组第0天有605个,第30天有617个。采用相似度在97%以上的OTU进行分析,组内比较OTU共有数量,对照组第0天、30天共有572个,VD组第0天、30天共有531个;
组间比较OUT共有数量,对照组第0天、VD组第0天共有491个,对照组第30天、VD组第30天共有502个。对照组、VD组经过治疗,肠道菌群结构均发生了变化,具体见图1。

图1 NAFLD患者治疗前后肠道菌群的维恩图Fig.1 Venn diagram of gut microbiota in NAFLD patients during the clinical treatment
2.5 VD对于NAFLD患者肠道菌群多样性的影响
为了观察VD治疗后,NAFLD患者肠道菌群的群落构成变化,本研究分析了两组患者肠道菌群中的α多样性和β多样性。得到了两组患者肠道菌群多样性的统计平均值。
在分析α多样性时,本研究选取了菌群丰度指数Chao1指数、ACE指数,以及多样性指数香农指数(Shannon Index)、辛普森指数(Simpson Index)作为判别指标。两组患者在治疗前后组内、组间均无显著差异(P>0.05)。见表3。

表3 NAFLD患者的肠道菌群α多样性指数Table 3 Alpha-diversity of gut microbiota in NAFLD patients
接着,本研究对两组患者肠道菌群的总体构成β多样性进行了分析,基于Unweighted UniFrac(以物种间的遗传序列信息为参考,只考虑物种有无,不考虑物种丰度高低)算法,进行了主坐标分析(Principal Coordinates Analysis,PCoA)。结果发现以PC1(16.42%)、PC2(7.42%)为主坐标,组内比较,VD组、对照组在治疗前后,肠道菌群的聚类均没有显著变化;
组间比较,在治疗前后,VD组的聚类与对照组均存在显著差异(P<0.01)。具体见图2。

图2 NAFLD患者的肠道菌群β多样性指数在治疗前后的变化Fig.2 Altered beta-diversity of microbiota in NAFLD patients during the clinical treatment
2.6 VD对于NAFLD患者肠道菌群丰度的影响
本研究比较了两组患者治疗前后肠道菌群在门、科、属水平上的丰度变化,其中在门水平上,丰度最高的菌依次为拟杆菌门(Bacteroidetes)、厚壁杆菌门(Firmicutes)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、黏胶球形菌门(Lentisphaerae)、蓝菌门(Cyanobacteria)、软壁菌门(Tenericutes)、黑水仙菌门(Melainabacteria)、未命名细菌(unidentified_Bacteria),这些菌门的丰度在两组患者治疗期间均无显著变化(P>0.05)。见图3。

图3 NAFLD患者门水平上排名前10的物种Fig.3 Top 10 abundant taxa at phylum levels of gut microbiota in NAFLD patients
在科水平上,两组患者肠道菌群丰度排名前10位的菌依次为拟杆菌科(Bacteroidaceae)、普雷沃氏菌科(Prevotellaceae)、毛螺菌科(Lachnospiraceae)、瘤胃球菌科(Ruminococcaceae)、韦荣氏菌科(Veillonellaceae)、文肯菌科(Rikenellaceae)、链球菌科(Streptococcaceae)、坦纳菌科(Tannerellaceae)、梭杆菌科(Fusobacteriaceae)、丹毒丝菌科(Erysipelotrichaceae)。组内比较,在VD组患者中,毛螺菌科相对丰度水平治疗后显著降低(P<0.01),丹毒丝菌科显著升高(P<0.01),而在对照组中无明显变化(P>0.05)。并且组间比较,治疗前,毛螺菌科在两组间无显著差异(P>0.05),治疗后,VD组毛螺菌科相对丰度水平显著低于对照组(P<0.001),组间丹毒丝菌科在治疗前后均无显著差异(P>0.05)。见表4。

表4 NAFLD患者科水平上排名前10的物种Table 4 Top 10 abundant taxa at family levels of gut microbiota in NAFLD patients
在属水平上,两组患者肠道菌群丰度排名前10位的菌依次为拟杆菌属(Bacteroides)、粪杆菌属(Faecalibacterium)、巨单胞菌属(Megamonas)、毛螺菌属(Lachnospira)、罗氏菌属(Roseburia)、普雷沃氏菌科未命名属(unidentified_Prevotellaceae)、另枝菌属(Alistipes)、链球菌属(Streptococcus)、小杆菌属(Dialister)、丹毒丝菌科未命名属(unidentified_Erysipelotrichaceae)。组内比较,在VD组患者中,丹毒丝菌科未命名属相对丰度水平在治疗后显著升高(P<0.05),但与对照组无显著差异(P>0.05)。见表5。

表5 NAFLD患者属水平上排名前10的物种Table 5 Top 10 abundant taxa at genus levels of gut microbiota in NAFLD patients
2.7 肠道菌群与血清生化指标的相关性分析
Spearman相关性分析常被运用在肠道菌群与血清代谢产物关联分析(Association Analysis)中[25]。本研究发现NAFLD患者中的部分肠道菌与血清生化指标具有一定相关性。
在本研究中,VD组患者中厚壁杆菌门、毛螺菌科与TG呈中等程度正相关(厚壁杆菌:r=0.584,P<0.01;
毛螺菌科:r=0.404,P<0.05),而对照组则无显著关联。见图4(a)-图4(d)。此外,两组患者中丹毒丝菌科、丹毒丝菌科未命名属均与ALT、AST呈显著负相关,但两种菌在科、属水平在VD组表现出与25(OH)D水平呈显著正相关(丹毒丝菌科:r=0.452,P<0.05;
丹毒丝菌科未命名属:r=0.600,P<0.001),而在对照组则无显著关联,并且VD组中两种菌在科、属水平与ALT、AST呈强负相关,且相关性强于对照组。见图4(e)-图4(p)。
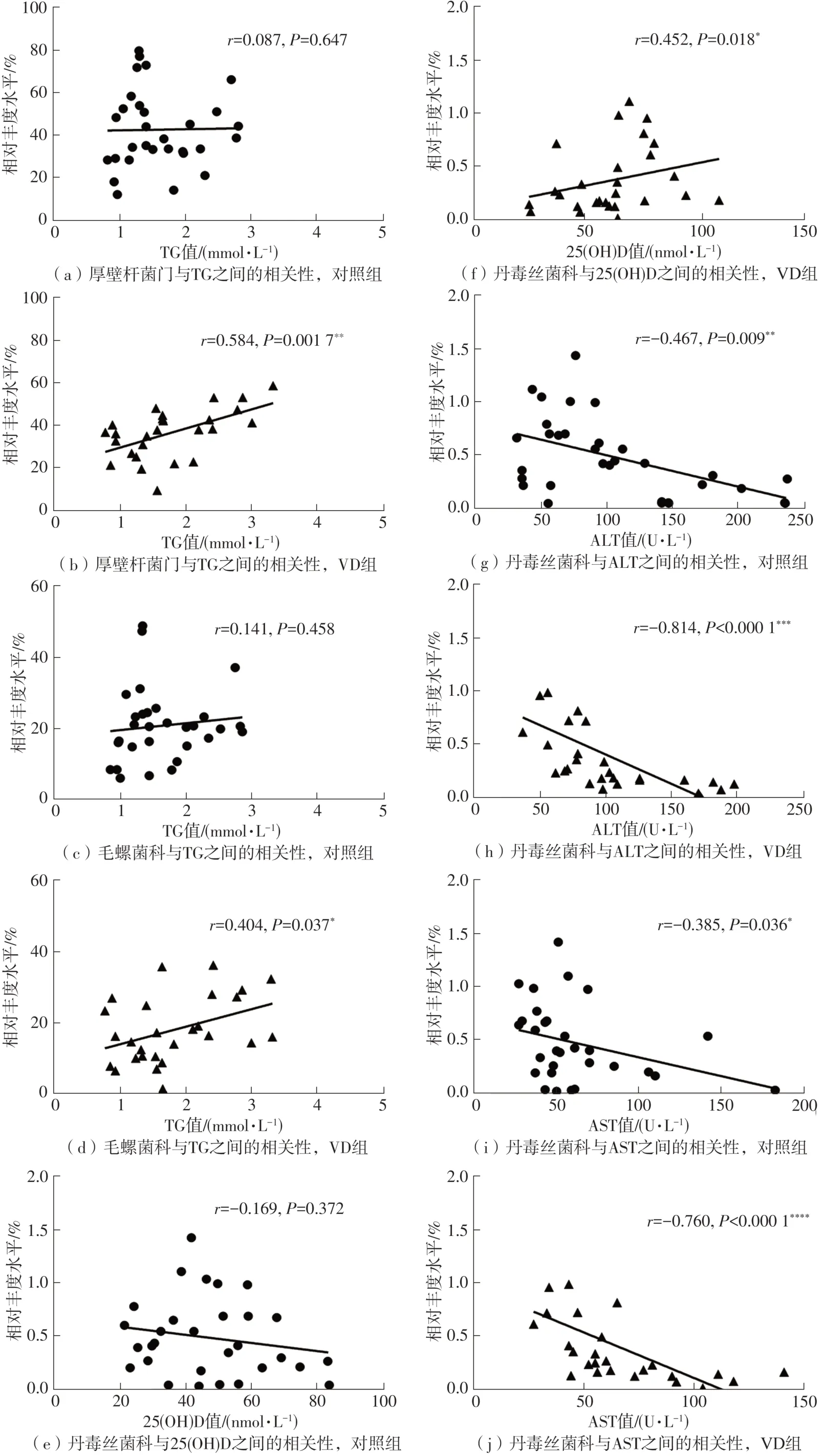

图4 NAFLD患者肠道菌群与血清生化指标的相关性分析Fig.4 Association analysis of gut microbiota in NAFLD patients with serum metabolites
VD是人体必需的营养元素,日光照射是人体合成VD的重要途径。随着城市化进程加快以及生活方式的改变,居民户外运动时间日趋减少,VD缺乏人群越来越多。根据一项我国成年人群VD情况调查,多数地区VD缺乏发生率高于60%,VD缺乏已成为我国居民面临的重要问题[26-27]。根据中国居民膳食营养素参考摄入量建议,成人推荐VD摄入量为400 IU/d,为了预防VD缺乏,日常可多晒太阳、多吃富含VD的食物如深海鱼、肝脏、蘑菇等,必要时可在医生建议下使用VD补充剂[28]。VD缺乏被认为与NAFLD有关[16-17]。本研究参照内分泌协会指南,将血清25(OH)D小于50 nmol/L定义为VD缺乏、50~75nmol/L为不足、大于75nmol/L为充足[29]。入组患者几乎都处于VD不足或缺乏状态(不足51.7%,缺乏44.8%,充足3.4%),这也暗示我们VD缺乏可能与NAFLD有着密切的联系。
转氨酶是反映肝损伤程度的重要标志,转氨酶水平高是NAFLD在临床上的重要表现。本研究发现,VD组患者在治疗前ALT值为(132.10±13.66)U/L、AST值为(60.14±7.73)U/L,两者水平远超出正常范围0~40 U/L,补充VD之后,VD组患者血清ALT、AST水平均出现降低,且ALT显著降低,AST呈现下降的趋势,说明VD对于改善肝损伤有一定的效果,这与之前的报道是一致的[30-31]。本研究同样发现VD组经过治疗后,CA浓度显著上升,并处于正常范围2.25~2.75mmol/L,体现出VD促进钙吸收的作用;
TP、ALB出现显著上升,治疗后UREA显著高于对照组,HDL-C显著低于对照组,但都属于正常范围之内的波动(正常值范围:TP,60~80g/L;
ALB,35~50g/L;
UREA,4.52~4.96mmol/L;
HDL-C,2~3.6mmol/L)。
笔者所在课题组前期研究发现,VD受体(Vitamin D Receptor,VDR)在小肠潘氏细胞中大量表达,后者是小肠重要的先天免疫细胞,VD信号通过VDR可上调机体先天免疫[20,32-33]。因此,给予NAFLD患者高剂量的VD,也可能通过调节小肠的先天免疫系统,包括防御肽的表达,平衡肠道菌群,进而缓解NAFLD。本次随机对照临床试验初步探索了NAFLD患者补充高剂量VD后肠道菌群的变化情况,观察指标包含肠道菌群多样性、丰度、肠道菌群与血清生化指标相关性。在本次试验中,VD对于NAFLD患者肠道菌群多样性,包括α多样性和β多样性,未观察到显著影响。但是,本研究发现VD能够调节特定菌的丰度,这些菌与血脂、肝损伤密切相关。
Spearman相关性分析结果提示肠道菌与部分生化指标存在一定相关性。本研究发现经过VD治疗的NAFLD患者,厚壁杆菌门、毛螺菌科与TG呈现中等显著正相关性,而对照组则无该现象。目前已知,毛螺菌是一类与肥胖相关的菌。此前有研究报道,从高血糖肥胖小鼠粪便中分离毛螺菌科下的菌株(AJ110941),移植给ob/ob肥胖易感小鼠,小鼠出现了肝脂肪变性,血糖显著升高,以及胰岛素、HOMA-β显著降低[34],揭示了毛螺菌可能导致肥胖、高血糖。高脂饮食会增加毛螺菌数量[35],根据已有研究,缺乏VD饮食导致小鼠中毛螺菌数量增加,提示毛螺菌可能与VD呈现负相关性[23]。在本研究中,VD治疗能够显著降低与肥胖相关的毛螺菌科相对丰度水平,可能从调节血脂的角度,缓解NAFLD。
此外,本研究发现补充VD后,患者丹毒丝菌科、丹毒丝菌科未命名属与血清25(OH)D水平呈显著正相关,而与ALT、AST呈中等或强负相关;
没有VD治疗情况下,丹毒丝菌科、丹毒丝菌科未命名属与血清25(OH)D水平无显著相关性,虽然与ALT、AST呈现显著中等负相关,但关联性相比VD治疗组较弱。目前在NAFLD中关于丹毒丝菌科的报道甚少,现有的几乎都来源于动物实验结果。有研究报道高脂、高糖饮食诱导的NASH小鼠相比正常饮食小鼠丹毒丝菌科水平升高[36];
另外一项研究报道肝实质细胞中的核苷酸结合寡聚化结构域蛋白2(Nucleotide-binding Oligomerization Domain-Containing,NOD2)能够抑制肝脂肪变性、肝纤维化以及肠道菌群失调,而经过NAFLD饮食诱导的肝实质细胞特异性敲除Nod2-/-的小鼠中丹毒丝菌科显著降低,说明丹毒丝菌科与NAFLD可能呈负相关[37]。此外,目前几乎没有针对丹毒丝菌科与肝损伤指标方面的相关研究。而在本研究中,VD不但与丹毒丝菌科、丹毒丝菌科未命名属呈现显著正相关,并且能够显著升高丹毒丝菌科、丹毒丝菌科未命名属相对丰度水平。这一现象提示我们丹毒丝菌科、丹毒丝菌科未命名属可能在VD治疗NAFLD过程中扮演着重要角色,并从减轻肝损伤的角度,缓解NAFLD。
人体的肠道菌群是庞大又复杂的,他们与免疫调节、代谢、维生素合成等生理功能息息相关,可以说是人体的又一个“器官”。尽管肠道菌群对人体健康十分重要,但不可否认的是,目前对于“健康肠道菌群”尚无确切的定义。目前已经有很多临床试验探讨了VD对于肠道菌群的影响,其中涉及了健康人群以及各类疾病患者[24]。VD对于肠道菌群存在一定影响,这点是可以确定的。并且VD的补充也不拘泥于形式,可以是口服、静脉注射,甚至通过照射NB-UVB来补充[38]。但是这些试验在结果的判定上都是定性的,而非定量的。不同于动物实验,临床试验难以控制,尤其是人体肠道菌群受多种可能因素的影响,如年龄、饮食、运动等等,这些因素可以归结为个体的差异。由于患者个体差异较大,本研究在组内、组间比较相结合的基础上,强化了组内比较,即关注NAFLD患者自身在治疗前后的变化。以此次试验为VD对于NAFLD患者肠道菌群的影响定论为时尚早,后续可延长VD干预疗程、增大样本量来进一步探索NAFLD患者肠道菌群对于VD的应答,并深入挖掘特定类群及其代谢途径,对VD作用机制加以解释。
综上所述,基于目前小规模的临床试验,本研究发现补充VD对于调节NAFLD患者肠道菌群、改善肝功能具有一定程度的积极影响。补充高剂量VD后,能够一定程度改善肝损伤程度,显著降低肝功指标ALT,能够降低NAFLD患者“肥胖菌”毛螺菌科的丰度,毛螺菌科与TG呈现显著正相关,并且能够提高25(OH)D相关菌丹毒丝菌科、丹毒丝菌科未命名属的丰度,而这两类菌与反映肝功能损伤的ALT、AST呈现显著负相关。
猜你喜欢 丹毒菌群肠道 “云雀”还是“猫头鹰”可能取决于肠道菌群中老年保健(2022年2期)2022-08-24发酵桂闽引象草替代部分日粮对鸡肠道菌群的影响中国饲料(2022年5期)2022-04-26功能性便秘患儿的肠道菌群分析及治疗干预昆明医科大学学报(2022年3期)2022-04-1970%的能量,号称“肠道修复菌之王”的它,还有哪些未知待探索?当代水产(2021年10期)2022-01-12夏季谨防肠道传染病保健医苑(2021年7期)2021-08-13常做9件事肠道不会差今日农业(2020年22期)2020-12-14“水土不服”和肠道菌群科学(2020年4期)2020-11-26黄马酊敷料外敷治疗急性下肢丹毒的疗效观察中国中医急症(2019年10期)2019-05-21丹毒夏季易发,防治做到4点家庭医药·快乐养生(2018年8期)2018-08-29丹毒夏季易发,防治做到4点家庭医药(2018年16期)2018-01-30推荐访问:肠道 维生素 病患者推荐文章
- 初中英语教师的述职报告范文【三篇】|初中英语教师个人人述职报告范文
- 2018年国产电影 2018年西藏注册测绘师考试报名入口【7月13日开通】
- 2018年安徽亳州经济开发区选拔教师公告【292人】_2018亳州经济开发区教师招聘
- 简短狼性团队口号 电商团队狼性口号:企业和市场同步,管理与世界接轨。
- 【2018年云南高考艺术、体育类一本批次征集志愿计划】2018云南体育类招生表
- 【战友聚会活动主持词结束语】战友聚会主持词结束语
- 2018辽宁丹东振兴区教育系统公开招聘合同制教师公告【40人】_
- [2018年重庆高考招生录取二次志愿征集公告七]2018高考招生征集志愿
- 2018年驱动型作文范例 [2018财务应聘简历范例]
- 关于学习的名言警句:不知则问,不能则学:励志的名言警句