三种商品化光敏剂诱导小鼠免疫原性细胞死亡的效果比较
来源:优秀文章 发布时间:2023-02-17 点击:
林 萱,毛 铎,白瑞霞
1内蒙古医科大学,内蒙古 呼和浩特 010110;
2内蒙古自治区人民医院检验科,内蒙古 呼和浩特 010017;
3中山大学附属第一医院精准医学研究院,广东 广州 510080
乳腺癌已超越肺癌成为全球第1大癌症,同时也是我国女性发病率最高的恶性疾病[1,2]。当前,最有希望的治疗方法是肿瘤免疫治疗,其主要应用免疫学原理,通过激活或增强机体自身免疫应答来杀伤肿瘤细胞,具有毒副作用小、疗效持续时间长以及有效抑制肿瘤复发和转移等优点[3]。目前,已被开发的免疫疗法主要包括:免疫检查点抑制剂疗法、CAR-T细胞疗法、肿瘤疫苗疗法和小分子药物疗法等[4],其中小分子药物疗法的一个重要研究方向是通过诱导免疫原性细胞死亡(ICD)激活免疫反应。
ICD是指肿瘤细胞受到刺激释放多种免疫损伤相关分子的一种死亡过程[5,6],其可刺激抗原提呈细胞成熟,进而提高CD8+T细胞的抗肿瘤功能,最终导致肿瘤生长抑制以及长期抗肿瘤免疫记忆[7]。因此如何更高效的诱导ICD是目前肿瘤免疫治疗领域研究的热点。常见的ICD诱导方法主要包括微生物诱导[8],化疗药物诱导(如蒽环类药物、蛋白酶体抑制剂[9-11])以及物理诱导(如光动力疗法(PDT)[12],电离辐射[13]和热效应[14]等)。
相较于其他方法,PDT具有低毒性、高特异选择性和非创伤性等优势[15],在原位诱导肿瘤细胞ICD中具有巨大的优势与应用前景。有研究表明,在PDT过程中,过量产生的ROS可引起肿瘤细胞中,包括内质网、线粒体和高尔基体在内的多种细胞器的氧化应激损伤。其可导致肿瘤抗原与ICD相关分子的释放,进一步激活抗肿瘤免疫反应[16,17]。因此ROS生成对激活ICD信号通路至关重要,如何开发新型的ICD诱导光敏剂也成为目前药学、材料化学以及医学领域研究的热点。目前ICD诱导光敏材料主要包括有机小分子光敏剂与光敏纳米粒子两类。前者主要通过连接靶向基团来使光敏剂定向结合细胞内重要细胞器,以达到精准杀伤癌细胞并诱导ICD 的目的[18]。金丝桃素是最具代表性的靶向性ICD诱导剂,其在光照条件下能产生高水平的ROS并诱导内质网氧化应激[19]。另外,针对细胞线粒体或高尔基体等细胞器的靶向光敏剂也被不断开发出来,它们被证明可以通过破坏特定细胞器膜结构来诱导ICD过程,在提高肿瘤免疫治疗中显示出潜在的应用价值[18,20]。目前,此类光敏剂仍处于研发早期阶段,复杂的化学修饰会导致制造成本上升,另外更强的细胞暗毒性以及代谢毒性也限制了这类光敏剂进一步的临床应用[21]。另一方面,为了增强生物体内的分散性与稳定性,光敏剂还被双亲聚合物包裹形成纳米粒子[22]。同时,多种化疗药物(如顺铂或阿霉素等)也可掺杂其中以协同增强ICD的治疗效果。然而,纳米粒子在体内同样面临实体肿瘤渗透率低与代谢效果差等问题[23]。
在本研究中,为了解决以上光敏材料体内应用存在的诸如生物安全性与体内代谢的问题,我们选取了3种具有临床转化潜力的商品化光敏剂,二氢卟吩e6(Ce6)、中性红(NR)以及虎红钠盐(RB),作为潜在的ICD诱导剂进行详细生物学评估。由于具有优异的光敏能力以及生物相容性,这3种光敏剂在预临床光动力治疗实验中已经有广泛的应用,但其在ICD 免疫诱导效果方面尚未进行详细评估。因此,本研究通过比较他们在肿瘤光动力疗效、ICD 诱导能力和体内抗肿瘤免疫治疗效果方面的优劣,试图挑选出免疫激活效果最好、最具转化前景的光敏剂,为临床抗肿瘤免疫治疗提供新的治疗工具。
1.1 主要仪器与试剂
UV-1900i 紫外可见分光光度计(Shimadzu);
FS5荧光光谱仪(Edinburgh Instruments);
多功能酶标仪(Thermo Fisher Scientific);
倒置荧光显微镜、激光扫描共聚焦显微镜(Olympus);
流式细胞分析仪(BD)。
Ce6(百灵威科技有限公司);
NR、ABDA 探针、DHR123 探针、Triton X-100(麦克林生化科技有限公司);
RB、HE试剂盒(索莱宝科技有限公司);
DCFH-DA探针(Sigma);
HPF 探针(懋康生物科技有限公司);
CCK-8试剂(东仁化学科技有限公司);
1640培养基、胎牛血清、PBS(Biological Industries);
含EDTA 胰酶(Gibco);
AM/PI活死双染试剂盒、TUNEL凋亡试剂盒(凯基生物科技发展有限公司);
CRT一抗、HMGB1一抗(Abcam);
Goat anti-Rabbit IgG(H+L)二抗(Thermo Scientific);
ATP试剂盒、DAPI(碧云天生物技术有限公司);
多聚甲醛(白鲨易科技有限公司)。
1.2 细胞与动物
4T1:鼠源性乳腺癌细胞(广州泰勒生物科技有限公司)。4T1是贴壁生长细胞,培养于含10% 胎牛血清(FBS)与1%PS的RPMI 1640培养基中,于37 ℃,5%CO2细胞培养箱中培养。
动物:BALB/c雌性小鼠(广东药康生物科技有限公司)。小鼠饲养于SPF级环境中。实验动物伦理批准编号:ZJCLA-IACUC-20030028。
1.3 Ce6、NR和RB的光学和功能表征
将Ce6、NR、RB溶于超纯水(终浓度:5 μmol/L),利用紫外可见分光光度计检测其吸收光谱,利用荧光光谱仪检测其荧光光谱。细胞外检测药物生成ROS效率,将Ce6、NR、RB溶于超纯水或PBS(终浓度:10 μmol/L),分别加入ABDA、HPF、DHR123以及DCFH-DA,用紫外分光光度计检测ABDA的吸光度;
用荧光光谱仪检测HPF、DHR123以及DCFH的荧光。
1.4 药物细胞摄取实验
共聚焦皿中孵育4T1细胞(10万/mL),加入Ce6、NR或RB溶液(终浓度:1 μmol/L),在细胞培养箱中孵育1 h,PBS洗3遍。每孔加300 μL4%多聚甲醛固定20 min,PBS洗3遍。再加入DAPI染色5 min,PBS洗过后在激光扫描共聚焦显微镜下观察。
1.5 细胞毒性检测
96孔板中过夜孵育4T1细胞(1万/100 μL)。加入不同浓度的Ce6、NR或RB溶液,在细胞培养箱中孵育1 h后更换培养基。用60 mW/cm2白光照射6 min,过夜恢复。各孔加入CCK-8溶液继续培养4 h,酶标仪测定各孔的A450nm,根据公式计算4T1细胞的存活率。
96孔板中孵育4T1细胞(1万/100 μL)。加入Ce6、NR或RB溶液(终浓度:1 μmol/L),在细胞培养箱中孵育1 h后更换培养基。细胞通过60 mW/cm2白光照射6 min,过夜恢复。各孔加入AM/PI混合液染色40 min,PBS洗过后于倒置荧光显微镜观察细胞活死情况。
1.6 细胞内活性氧检测
12 孔板中过夜孵育4T1 细胞(10 万/mL)。加入1 μmol/L 的Ce6、NR或RB溶液,在细胞培养箱中孵育1 h后更换培养基。加入DCFH-DA探针孵育20 min,PBS洗3遍。细胞通过60 mW/cm2白光照射4 min,于倒置荧光显微镜观察荧光强弱。
1.7 细胞内诱导CRT外翻
共聚焦皿中孵育4T1细胞(10万/mL),加入Ce6、NR 或RB 溶液(终浓度:1 μmol/L),在细胞培养箱中孵育1 h后更换培养基。细胞通过60 mW/cm2白光照射4 min,12 h后吸去培养基,每孔加300 μL 4%多聚甲醛固定20 min,PBS洗3遍。加入重组Anti-Calretinin抗体(1∶500)4 ℃过夜孵育,随后用PBS 洗掉一抗后再加入Goat anti-Rabbit IgG (H+L) 二抗(1∶1000)室温孵育1 h,PBS洗3遍。用DAPI染色5 min,PBS洗后在激光扫描共聚焦显微镜下观察。
1.8 细胞内诱导ATP释放
12孔板中孵育4T1细胞(10万/mL),加入Ce6、NR或RB溶液(终浓度:1 μmol/L),在细胞培养箱中孵育1 h后更换培养基。细胞通过60 mW/cm2白光照射6 min,12 h后取上清液使用碧云天ATP检测试剂盒检测细胞上清液分泌的ATP含量。
1.9 细胞内诱导HMGB1释放
共聚焦皿中孵育4T1细胞(10万/mL),加入Ce6、NR或RB溶液(终浓度:1 μmol/L),在细胞培养箱中孵育1 h后更换培养基。细胞通过60 mW/cm2白光照射6 min,12 h后吸去培养基,每孔加300 μL 4%多聚甲醛固定20min,PBS洗3遍。0.1%TritonX-100通透15min,PBS洗3遍。加入重组Anti-HMGB1抗体(1∶250)4 ℃过夜孵育,随后用PBS 洗掉一抗后再加入Goat anti-Rabbit IgG(H+L)二抗(1∶1000)室温孵育1 h,PBS洗3遍。用DAPI染色5 min,PBS洗后在激光扫描共聚焦显微镜下观察。
1.10 体内抗肿瘤免疫治疗
BALB/c 雌性小鼠6~8 周龄,体质量18~20 g。BALB/c雌性小鼠背部皮下接种4T1细胞(100万/只),14 d后在瘤内分别注射Ce6和NR(注射剂量:30 μL,5 mg/mL),2 h 后肿瘤部位通过白光照射(10 min,400 mW/cm2)(5只/组)。随后监测小鼠的体质量及肿瘤体积变化。治疗14 d后取材,取肿瘤和脾脏组织。肿瘤和脾脏取一部分经过研磨制成单细胞悬液,进行流式细胞术分析免疫指标,另一部分通过4%多聚甲醛固定,随后切片进行HE染色,部分肿瘤切片进行TUNEL染色。
流式细胞术分析:脾脏通过研钵研磨为单细胞悬液,加入2 mL红细胞裂解液室温静置2 min后1500 r/min离心10 min,稀释到100万/100 μL;
肿瘤组织通过一型胶原酶消化30 min后1500 r/min离心10 min,稀释到100万/100 μL。加1 μL抗体4 ℃孵育1 h,1500 r/min,离心5 min。2%多聚甲醛于4 ℃固定保存。上机前PBS洗去固定液,重悬到500 μL过筛网后通过流式细胞仪检测。
切片染色:肿瘤组织在4%多聚甲醛固定48 h,PBS浸泡10 min后于脱水机梯度脱水,第2天包埋后切片(厚度为4 μm)。染色时,切片通过脱蜡和复水,苏木素染色4 min,蒸馏水清洗后分化液分化2 min,伊红染色1 min后梯度乙醇快速脱水。最后,经过二甲苯透明,中性树脂封固,镜下观察。
TUNEL染色:组织切片经过脱蜡和复水后PBS洗3遍,每次5 min。切片滴加100 μL 10×Proteinase K工作液于37 ℃反应30 min,PBS洗3遍,5 min/次。加入提前配制好的TdT酶反应液37 ℃避光反应60 min,PBS洗3遍,5 min/次,注意避光。最后加入荧光标记液37 ℃避光反应30 min,PBS洗3遍,5 min/次。用含DAPI的封闭液封片,镜下观察。
1.11 统计学分析
使用GraphPad prism 8.0进行统计分析。实验符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2.1 3种光敏药物的光学光敏性质比较
紫外可见分光光度计检测其吸收光谱,荧光光谱仪检测其荧光光谱。Ce6在405 nm、640 nm处有特征性吸收峰,在650 nm 处有明显的荧光发射峰;
NR 在533 nm处有特征性吸收峰,在628 nm处有明显的荧光发射峰;
RB在534 nm处有特征性吸收峰,在554 nm处有明显的荧光发射峰(图1A、B)。
ROS是氧的单电子还原产物,包括单线态氧(1O2),超氧阴离子(O2-)和羟基自由基(·OH)等。2",7"-二氯荧光素二乙酸酯(DCFH-DA),是检测ROS的商品化荧光探针。经过白光照射处理,Ce6生成的总ROS明显高于NR和RB,NR与RB在光照的前40 s内没有明显差别,之后NR逐渐上升,RB则于80 s后趋于平稳(图1C)。利用更特异性的ROS 探针对3 种光敏剂所产生的ROS种类进行分析。通过378 nm处吸光度的变化来比较3种药物生成1O2的效率,Ce6的吸光度下降最快,在3种药物当中,Ce6的1O2生成效率最高,其次是RB和NR(图1D)。羟苯基荧光素(HPF)和二氢罗丹明123(DHR 123)是在溶液中分别检测·OH和O2-的特异性荧光探针。Ce6生成·OH和O2-的效率也明显高于另外两种光敏剂(图1E,F)。

图1 Ce6、NR及RB吸收发射光谱及其ROS产率比较Fig.1 Optical properties and ROS production-inducing capacity of Ce6,NR and RB.A:Optical absorbance of the 3 agents.B: Fluorescence emission spectra of Ce6,NR and RB.C: Total ROS producing capacity measured by DCFH-DA.D:1O2-producing capacity measured by ABDA.E: · OH-producing capacity measured by HPF.F:O2--producing capacity measured by DHR123.White light irradiation:60 mW/cm2.
2.2 3种光敏药物的肿瘤细胞杀伤能力比较
通过激光扫描共聚焦显微镜观察药物进入细胞的情况,确定光敏剂的细胞内吞效果。在明场条件下可看到清晰的4T1细胞(图2A)。分别通过530 nm和660 nm激光激发后,可观察到明显的荧光信号分布在细胞质中(红色信号),验证药物通过简单体外孵育可以被肿瘤细胞摄取,3种光敏剂均具有良好的细胞摄取能力。
共聚焦图片显示未加药组仅有微弱的绿色荧光(图2B),这是因为细胞中本身存在低水平的ROS,与DCFH结合后会发出微弱荧光。光照加药组有明显的绿色荧光发出,其中Ce6的绿色荧光最强,进一步验证Ce6是三者中ROS产率最高的光敏剂。
随后,我们通过细胞活力检测试剂盒(CCK-8)进一步评估不同光敏剂对肿瘤细胞杀伤效果的差异。经不同浓度的3种光敏剂处理后,4T1细胞存活率均高于90%(图2C),验证3种光敏剂暗毒性很小,具有良好的生物相容性。然而在光照条件下,Ce6和NR随着药物浓度的提高均显示出显著的肿瘤细胞抑制效果,其IC50值分别为1.18 μmol/L和1.37 μmol/L。而RB的细胞光毒性要明显弱于以上两种药物(IC50=4.92 μmol/L)。
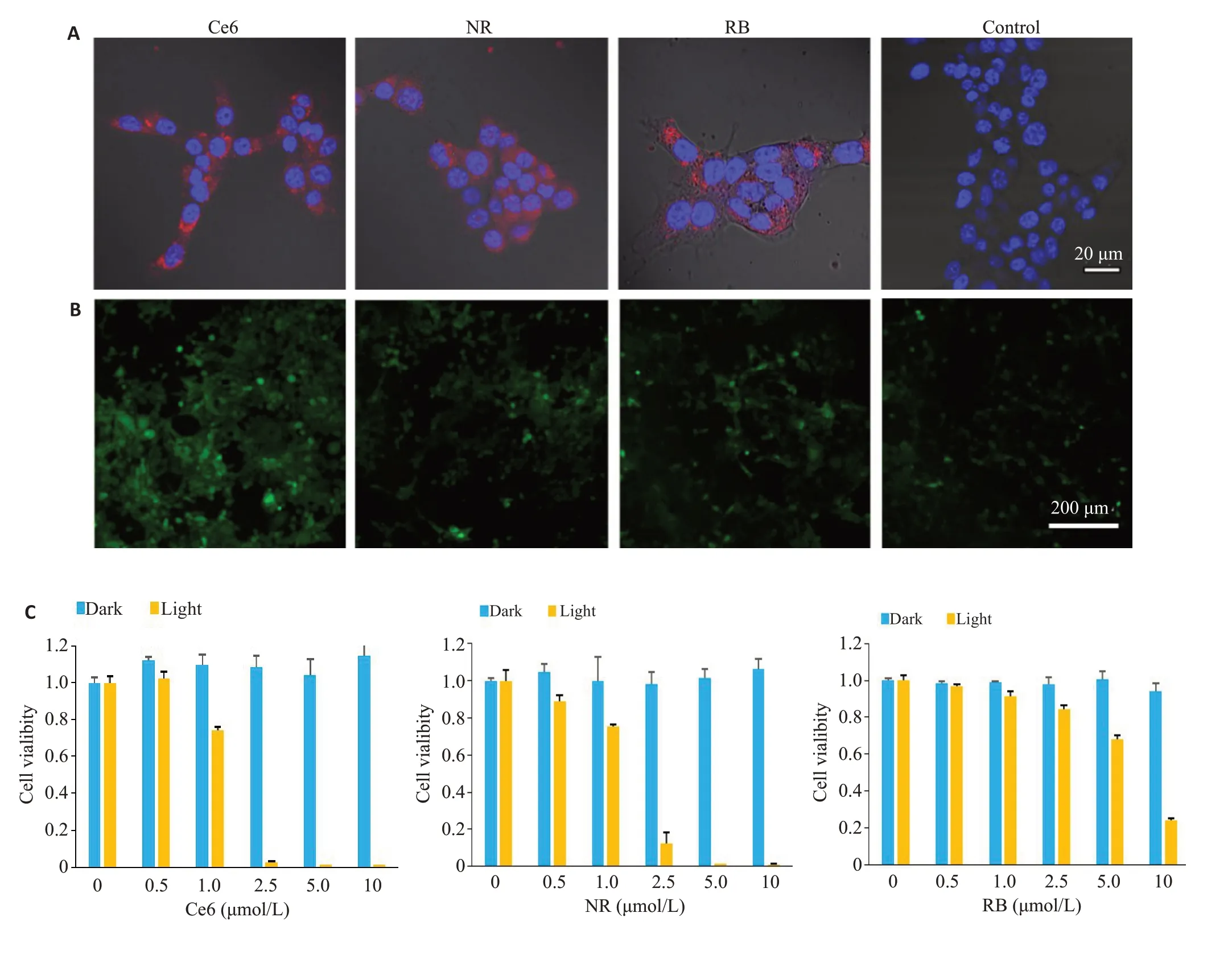
图2 Ce6、NR和RB药物摄取及细胞毒性Fig.2 Cell uptake and cytotoxicity of Ce6,NR and RB.A: Confocal images of 4T1 tumor cells incubated with Ce6,NR and RB for 1 h.B:Detection of intracellular ROS level within photosensitizer-labeled 4T1 cells by DCFH-DA(green),followed by white light irradiation(4 min,60 mW/cm2).C:Cell viability of different photosensitizer-labeled 4T1 cells under white light irradiation(60 mW/cm2)for 6 min or maintained in darkness.
2.3 3种光敏药物诱导免疫原性细胞死亡能力比较
通过共聚焦成像系统观察CRT表达情况(图3A),通过光照处理后,与对照组相比,3种光敏剂均可显著诱导肿瘤细胞膜的荧光信号,其中Ce6与NR组的细胞膜荧光明显强于RB,验证了Ce6与NR优异的CRT蛋白诱导能力。同时,治疗组的肿瘤细胞核HMGB1的荧光信号明显弱于对照非处理组(图3B),提示3种光敏药物均能促进免疫激活蛋白HMGB1的分泌,利于抗肿瘤免疫反应激活。最后,检测细胞光动力治疗后细胞上清液中ATP浓度(图3C),Ce6释放ATP能力显著强于NR和RB,验证Ce6具有优异的诱导细胞凋亡和促进肿瘤细胞ATP外排的能力。

图3 Ce6、NR和RB的ICD诱导能力评估Fig.3 ICD-inducing effect of Ce6,NR and RB in vitro.A:Confocal images of ecto-CRT(red)expression of different photosensitizertreated 4T1 cells,followed by white light irradiation for 4 min at 60 mW/cm2.B: Quantitative analysis of fluorescence of HMGB1 content in 4T1 cells with different treatments.C:Detection of ATP production in photosensitizer-treated 4T1 cells after 24 h of PDT(n=3,*P<0.05,***P<0.001).
2.4 体内抗肿瘤免疫实验
由于RB的细胞毒性和ICD诱导能力较弱,因此在体内实验中仅比较Ce6与NR最终的体内抗肿瘤效果。PBS组小鼠肿瘤组织生长迅速,而Ce6与NR组的肿瘤体积得到了显著的抑制,其中Ce6治疗组的肿瘤治疗效果明显好于NR组(图4A)。对第14天的小鼠肿瘤组织进行切片与组织学分析,HE染色结果显示,经Ce6与NR加光照治疗过的肿瘤组织出现明显的肿瘤细胞坏死与炎症细胞浸润现象。TUNEL染色结果显示,相对于PBS组,Ce6加光照射组的肿瘤组织中有最强的亮绿色荧光,NR的绿色荧光弱于Ce6,验证Ce6能导致严重的肿瘤细胞凋亡与DNA释放(图4B)。体质量变化监测显示,3组小鼠的体质量在14 d的实验期间没有显著差异(P>0.05,图4C),验证Ce6与NR具有良好的生物安全和生物相容性。

图4 Ce6和NR体内光动力治疗效果Fig.4 In vivo PDT effect of Ce6 and NR (n=5,*P<0.05,***P<0.001).A: Tumor growth curve of mice with different treatments.B: HE (upper panel) and TUNEL (lower panel) stained tumor slices of mice with different treatments.C:Body weight changes of mice with different treatments.
通过流式细胞分析可知(图5A,B),与对照组相比,Ce6照射后小鼠肿瘤组织中CD8+T细胞的比例增加至12.7%,其比例明显高于NR 组与PBS 组的肿瘤组织(6.1%与3.9%)。小鼠脾细胞流式结果显示,Ce6组的IFN-γ+CD8+水平是NR组的2.5倍,是对照组的23.6倍(图5C,D)。
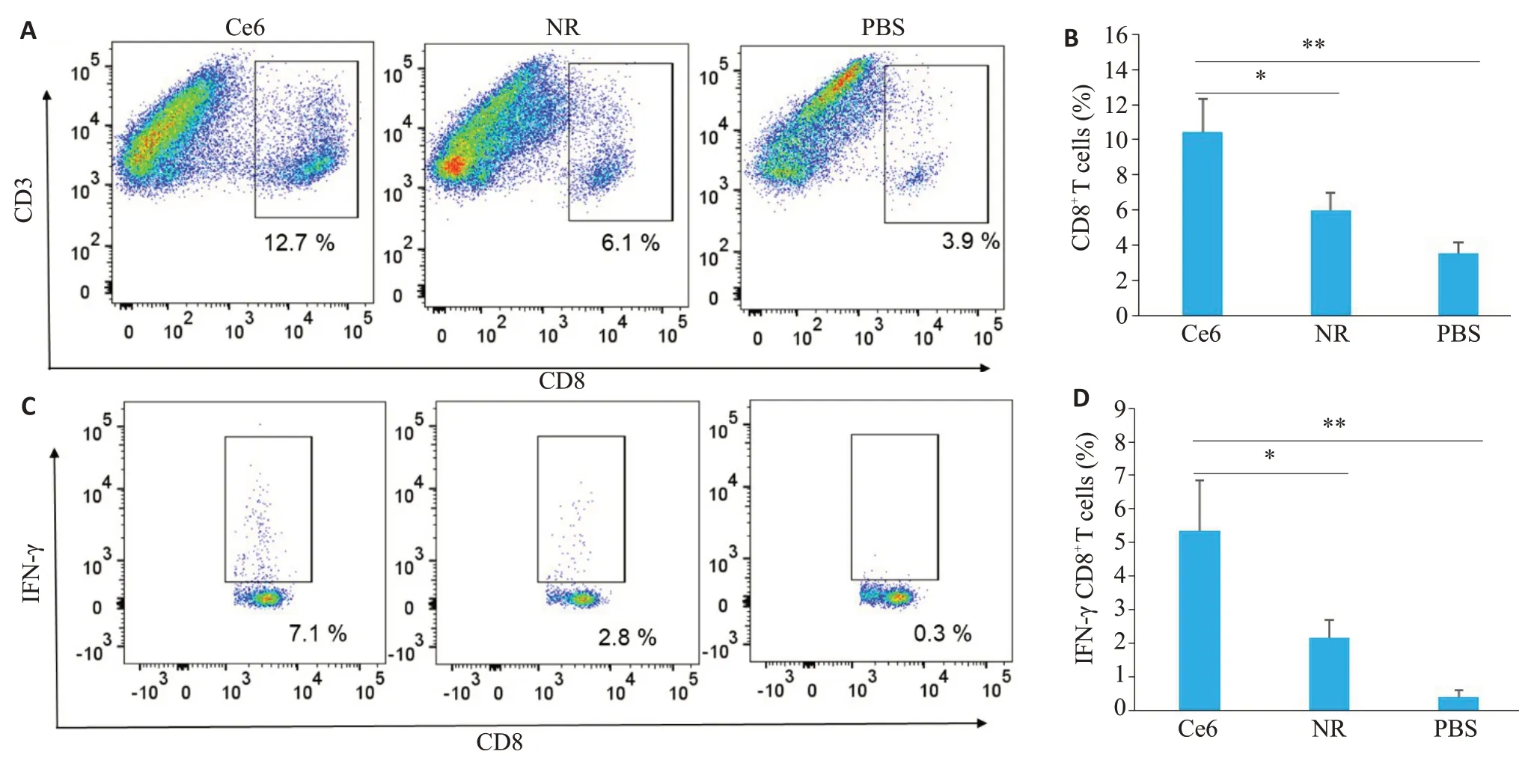
图5 Ce6和NR光动力治疗免疫学分析Fig.5 Immunological analysis of Ce6-and NR-treated mice after PDT.A,B: Flow cytometric analysis (A) and quantitative results (B) of CD8+ T cells in tumor tissues of mice with different treatments.C,D: Flow cytometric analysis (C) and quantitative results(D)of IFN-γ+CD8+T cells in spleen tissues of mice with different treatments(n=5,*P<0.05,**P<0.01).
近年来,PDT被认为可以潜在诱导ICD并激活获得性免疫反应用于实体肿瘤治疗[24,25]。PDT是一种基于光化学原理的治疗方法,其利用特定波长的光源照射光敏剂,导致光敏分子被激活产生能量跃迁,转化周围氧分子为多种ROS,进而实现肿瘤细胞的氧化损伤。目前,常见的ICD诱导光敏材料主要分为小分子细胞器靶向光敏剂与光敏纳米粒子两类。前者通常将小分子光敏剂经化学修饰正电基团来实现线粒体或内质网等细胞器特异性靶向,进而通过光动力治疗触发细胞器氧化损伤,引起ICD介导的抗肿瘤免疫反应。例如,丁丹等[26]开发了线粒体靶向光敏分子,其可作为新型ICD疫苗在肿瘤预防中发挥重要作用。然而,此类材料在体内通常会引起正常细胞非特异摄取以及溶血效应,极大限制其临床应用。另一方面,一些研究将光敏分子与其他药物共同包裹成纳米粒子,以达到肿瘤杀伤与ICD激活的协同治疗效果[27],但纳米粒子本身的体内代谢与生物安全性问题同样无法解决[28,29]。
相比之下,商品化非靶向小分子光敏剂则规避了以上问题,他们具有材料性质稳定、ROS产率高、暗毒性小以及体内代谢快等特点,被广泛应用于多种疾病的光动力治疗中。因此,为了规避体内安全性问题推动ICD光敏疗法的临床转化,对于现有商品化光敏剂的肿瘤免疫治疗疗效的评估与筛选至关重要,然而此类研究的报道相对较少。本研究对比了Ce6、NR 和RB三种小分子光敏剂,着重评价了它们的光敏效率、ICD诱导能力和PDT抗肿瘤治疗效果。研究显示,相对于另外两种光敏剂,Ce6的肿瘤细胞杀伤效果最好,同时其ATP与CRT的诱导表达能力最强,是一种优良的ICD诱导光敏剂。研究结果对于临床实体肿瘤光动力免疫治疗提供了重要的生物数据参考与理论支持。基于此,研究人员未来可以进一步开发更具临床转化潜力的ICD光动力治疗方案,同时也对今后ICD药物开发提供重要的借鉴意义。
猜你喜欢 光敏剂光敏孵育 溶酶体靶向吲哚氟硼二吡咯光敏剂的合成、双光子荧光成像及光动力治疗高等学校化学学报(2022年10期)2022-10-14光固化3D打印中光敏树脂的研究进展山东陶瓷(2021年5期)2022-01-17LINC00612靶向结合Bcl-2抑制Aβ1-42孵育的神经元凋亡中风与神经疾病杂志(2021年9期)2021-11-08光动力治疗中提高光敏剂靶向性的研究进展化工学报(2021年1期)2021-01-30鸣律炎黄地理(2021年12期)2021-01-04淀粉基壁材的光降解性能研究中国塑料(2019年9期)2019-09-25三物黄芩汤组分(群)配伍在大鼠肝微粒体孵育模型中的相互作用中成药(2017年9期)2017-12-19大鼠肝微粒体孵育体系中2种成分的测定及其代谢中成药(2017年5期)2017-06-13应用快速孵育法优化酶联免疫吸附实验过程探讨——以乙型肝炎病毒表面抗原检测为例标记免疫分析与临床(2016年9期)2016-11-21α桉醇光敏氧化及抗肿瘤活性研究云南中医学院学报(2015年2期)2015-07-31推荐访问:光敏剂 小鼠 商品化