大黄素诱导LXRα-ABCA1信号通路减少非酒精性脂肪性肝病细胞模型的脂质沉积*
来源:优秀文章 发布时间:2023-02-09 点击:
宁巍,杨金连,张涛
[1.湖南省人民医院(湖南师范大学附属第一医院)药学部,长沙 410005;
2.广州市妇女儿童医疗中心药学部,广州 510623]
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是目前严重的公共健康问题之一。随着人们生活水平提高,NAFLD患病率日益升高,已是继病毒性肝炎后我国第二大常见肝病[1]。目前,NAFLD的治疗药物主要包括抗氧化药物和他汀类药物等,但他汀类药物在治疗NAFLD同时会出现肌肉毒性和肝毒性等不良反应[2],限制了其临床应用。中药有效成分在NAFLD的防治中起着重要的作用,药理研究发现中药大黄的有效成分大黄素有抗炎、抗肿瘤、镇痛和抗氧化等功效[3-4]。刘鸣昊等[5]报道大黄素在动物模型中可能有缓解NAFLD的作用,但具体机制仍有待进一步研究。
ATP结合盒转运体A1(ATP-binding cassette transporter A1,ABCA1)是ATP能源转运蛋白,可调控胆固醇逆向转运,对维持细胞脂质平衡起着重要作用[6]。研究发现,ABCA1受到肝X受体α(liver X receptor α,LXRα)的调控,激活LXRα可增加ABCA1表达,并增加细胞转运出胆固醇的能力[7]。激活LXRα-ABCA1通路成为降脂药物研究的热点。本研究利用油酸和棕榈酸诱导HepG2建立NAFLD体外细胞模型,考察大黄素对细胞脂质堆积和LXRα-ABCA1通路的影响,探究其治疗NAFLD的可能作用机制。
1.1材料
1.1.1仪器与设备 Nano Drop 2000超微量分光光度计(美国Thermo Fisher Scientific公司),ETC-811逆转录仪(东胜创新生物科技有限公司),实时荧光定量PCR仪 480(瑞士Roche公司),FluorChem R型多功能成像分析系统(美国protein Simple公司),M1000PRO型多功能酶标仪(奥地利TECAN公司),Axio Observer A1型倒置荧光显微镜(德国卡尔蔡司公司)。
1.1.2药品与试剂 大黄素(阿拉丁试剂公司,含量>96%),实验用高脂细胞添加剂(西安鲲创科技公司),CCK-8试剂(TARGETMOI公司),三酰甘油(TG)测试盒(南京建成生物科技公司),胆固醇(TC)测试盒(南京建成生物科技公司),油红O工作液(西格玛奥德里奇公司),LXRα抗体(美国Abcam),ABCA1抗体(美国Novus Bidogicals),GAPDH抗体(杭州弗德生物科技公司),尼罗红(北京博奥拓达科技公司),M02对照质粒及LXRα过表达质粒(广州复能基因公司),ABCA1双荧光素酶质粒(广州艾西龙生物科技公司),双荧光素酶报告基因检测系统(上海普洛麦格生物产品公司)。PCR引物由生工生物工程(上海)股份有限公司合成,序列和产物长度信息见表1。

表1 PCR引物序列 Tab.1 PCR primer sequence
1.2方法
1.2.1细胞培养 HepG2细胞复苏后,用含10%胎牛血清和1%青链霉素的DMEM培养基(完全培养基)于37 ℃、5%二氧化碳(CO2)的恒温培养箱中培养。于显微镜下观察细胞的生长状态,待细胞融合度达80%~90%时,以胰酶消化传代后进行后续实验。
1.2.2细胞给药 取对数生长期的细胞,按每孔1×104个接种于两个96孔板中,分为正常对照组、模型对照组和不同浓度大黄素组。模型对照组加入500 μmol·L-1油酸溶液和250 μmol·L-1棕榈酸溶液,每组设复孔5个。培养48 h后,其中一个96孔板用于细胞活性检测,每孔加入CCK-8试剂10 μL,将培养板放在培养箱培养30 min,用酶标仪测定在波长450 nm处吸光度(A值)。计算细胞存活率公式:细胞存活率(%)=(实验组A值-调零孔A值)/(对照组A值-调零孔A值)×100%。
1.2.3尼罗红染色测定吸光度 用磷酸盐缓冲溶液(PBS)将96孔板的细胞洗3次,每次5 min。每孔加入稀释后的1:2000尼罗红工作液100 μL ,孵育15 min,用PBS洗3次。将酶标仪的激发光波长设置为485 nm,发射波长设置580 nm后,测定荧光强度。
1.2.4TG和TC含量的测定 取对数生长期的细胞接种于6孔板中,然后分为正常对照组、模型对照组、大黄素治疗组(10 μmol·L-1)和阿托伐他汀钙组(1 μmol·L-1)[8],每组设复孔4个。细胞培养48 h后,收集细胞并加入乙醇,采用超声波细胞破碎仪破碎细胞,收集细胞匀浆液。按照TG和TC检测试剂盒说明书相关方法检测细胞中TG和TC含量。
1.2.5油红O染色观察细胞中脂质蓄积 取对数生长期细胞接种于6孔板中,按照“1.2.2”项下方法分组、造模与给药,每组设复孔3个。细胞培养48 h后用PBS洗3次,加入4%多聚甲醛固定液固定30 min;
用70%异丙醇孵育5 min;
弃去异丙醇,加入油红工作液孵育20 min;
弃去染色液水洗后加入苏木精染色液复染1~2 min。于显微镜下观察细胞中脂质蓄积情况。
1.2.6实时荧光定量PCR测定mRNA表达水平 取对数生长期细胞接种于6孔板中,按“1.2.2”项下方法分组、造模与给药,每组设复孔4个。细胞培养48 h后,按照RNA提取试剂盒说明书提取细胞mRNA。PCR扩增反应体系如下:cDNA模板2 μL,2X Power Green qPCR Mix 10 μL,上、下游引物0.4 μL,无酶水7.2 μL。反应条件为:94 ℃,3 min;
94 ℃,5 s;
60 ℃,5 s;
72 ℃,10 s;
共40个循环。采用2ΔΔCt法计算mRNA表达水平。
1.2.7Western blotting检测LXRα、ABCA1的蛋白表达水平 取对数生长期细胞接种于6孔板中,按照“1.2.2”项下方法分组、造模与给药,每组设复孔3个。细胞培养48 h后,弃去培养基,用PBS洗3次,加入RIPA 裂解液提取总蛋白,BCA蛋白浓度测定,蛋白经煮沸变性后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳并转膜;
加入ECL化学发光试剂,采用多功能成像分析系统进行成像。采用Image J软件分析,以目的蛋白灰度值与内参GAPDH灰度值的比值表示目的蛋白的表达水平。
1.2.8双荧光素酶报告基因实验 取对数生长期细胞接种于24孔板,待细胞融合度达约70%进行转染。采用Lipofectamine 3000进行转染,将600 ng pEZ-M02 对照质粒或LXRα过表达质粒、300 ng ABCA1启动子质粒和30 ng pRL-TK共转染于细胞中。24 h后加入10 μmol·L-1大黄素。24 h后弃去培养基,加入裂解液,在室温下轻柔震荡20 min。采用Promega 报告基因检测试剂盒和多功能酶标仪检测荧光素酶的活性,并计算荧光素酶与海肾荧光素酶活性的相对比值。
1.2.9RNA干扰实验 取密度为60%~80%的HepG2细胞,加入10 nmol·L-1LXRα-siRNA 或Control-siRNA溶液, 放入CO2培养箱继续培养24 h后,或加入10 μmol·L-1大黄素继续培养24 h后,再收集细胞。
1.2.10统计学方法 使用SPSS 20.0版软件和GraphPad Prism 8.0版软件进行统计分析和绘图。
2.1大黄素对高脂诱导后HepG2细胞存活率的影响 结果见图1。与正常对照组比较,模型对照组细胞存活率下降,相对尼罗红荧光强度升高。与模型对照组相比,10 μmol·L-1大黄素组相对尼罗红荧光强度显著下降,并且细胞存活率恢复至最高(0.978 7±0.138 6)。因此,本研究选取降脂效果良好并对细胞活性无明显影响的10 μmol·L-1大黄素进行后续实验。

①与正常对照组比较,t=13.68,5.17,P<0.05;
②与模型对照组比较,t=2.553~5.83,P<0.05。图1 大黄素剂量依赖性降脂药效和细胞毒性评价①Compared with normal control group,t=13.68,5.17,P<0.05;
②Compared with model control group,t=2.553-5.83,P<0.05.Fig.1 Evaluation of emodin dose-dependent reduction of lipid efficacy and
2.2大黄素对高脂诱导后HepG2细胞中脂质蓄积的影响 油红O染色和显示与正常对照组相比,NAFLD模型组脂质堆积明显增加,细胞中TG和TC含量显著升高。与模型对照组相比,大黄素组与阿托伐他汀钙组的油红染色中脂滴的大小和数量都明显减少,细胞中TC含量显著降低(图2-4)。

图2 大黄素对HepG2细胞中脂质蓄积影响的显微图(油红O染色,×400) Fig.2 Effect of Emodin on lipid accumulation in HepG2 cells (oil red O staining,×400)

图3 大黄素对HepG2细胞中脂质蓄积影响的显微图(尼罗红荧光染色,×400) Fig.3 Micrograph of the effect of Emodin on lipid accumulation in HepG2 cells (Nile red fluorescence staining,×400)

①F=4.86,P<0.05;
方差不齐,与正常对照组比较,P<0.05。②F=17.29,P<0.01;
方差齐与正常对照组比较,P<0.05;
③与模型对照组比较,P<0.05。图4 各组细胞中TG和TC含量的测定结果①F=4.86,P<0.05;
The variance was uneven,compared with normal control group,P<0.05。②F=17.29,P<0.01;
The variance was uniform,companed with normal control group,P<0.05;
③Compared with model control group,P<0.05.Fig 4 TG and TC content of cells in each group n=4)
2.3大黄素对高脂诱导后HepG2细胞中脂质合成和代谢通路中相关基因mRNA表达的影响 如图5所示,对与脂质合成代谢有关的核转录因子进行mRNA检测,发现大黄素组对NR1H2、FXR、CAR等核转录因子无影响,但显著提高LXRα的转录水平。与模型对照组比较,大黄素组中ABCA1的转录水平显著上升。

①F=9.86,P<0.05;
方差齐,与正常对照组比较,P<0.05;
②与模型对照组比较,P<0.05;
③F=40.36,P<0.05;
方差齐,与模型对照组比较,P<0.05。图5 各组细胞与脂质合成和代谢通路相关基因mRNA表达水平的测定结果①F=9.86,P<0.05;
The variance was uniform,compared with normal control group,P<0.05;
②Compared with model control group,P<0.05。③F=40.36,P<0.05;
The variance was uniform,compared with model control group,P<0.05.Fig 5 mRNA expression of genes related to lipogenesis and lipolysis pathway in each group of
2.4大黄素对高脂诱导后HepG2细胞中LXRα-ABCA1通路相关蛋白表达的影响 根据“2.3”项下mRNA的检测结果,进一步检测各组LXRα、ABCA1的蛋白表达水平。如图6所示,与高脂模型对照组相比,大黄素组细胞中LXRα和ABCA1的蛋白表达水平显著升高。

①F=174.07,P<0.05;
方差齐,与正常对照组比较,P<0.05;
②与模型对照组比较,P<0.05;
③F=38.87,P<0.05;
方差不齐,与模型对照组比较,P<0.05。图6 大黄素对HepG2细胞中LXRα-ABCA1通路相关蛋白表达影响的免疫印迹图①F=174.07,P<0.05;
The variance was uniform,compared with normal control group,P<0.05;
②Compared with model control group,P<0.05;
③F=38.87,P<0.05;
The variance was uniform,compared with model control group,P<0.05。Fig 6 Western blotting images of the effect of emodin on the protein expression of LXRα-ABCA1 pathway in HepG2
2.5大黄素提高HepG2细胞中LXRα-ABCA1双荧光素酶系统的相对荧光值 结果见图7,与M02对照载体组相比,加入LXRα后能够显著提高ABCA1双荧光素酶系统的相对荧光值,证明LXRα-ABCA1双荧光素酶系统构建成功。而加入大黄素后,能够进一步提高LXRα-ABCA1双荧光素酶系统的相对荧光值。

①F=19.09,P<0.05;
方差不齐,与M02对照载体组比较,P<0.05;
②与LXRα对照组比较,P<0.05。图7 大黄素对HepG2细胞中LXRα-ABCA1转录活性的影响①F=19.09,P<0.05;
he variance was uniform,compared with M02 group,P<0.05;
②Compared with LXRα group,P<0.05。Fig 7 Effect of emodin on transcription activity of LXRα-ABCA1 in HepG2 cells
2.6敲低LXRα基因后,大黄素对HepG2细胞中脂质蓄积的影响 结果见图8,与正常对照组相比,敲低LXRα的细胞经大黄素处理后,细胞内脂滴的大小和数量均明显增多,结果表明敲低LXRα后大黄素降脂能力显著降低。
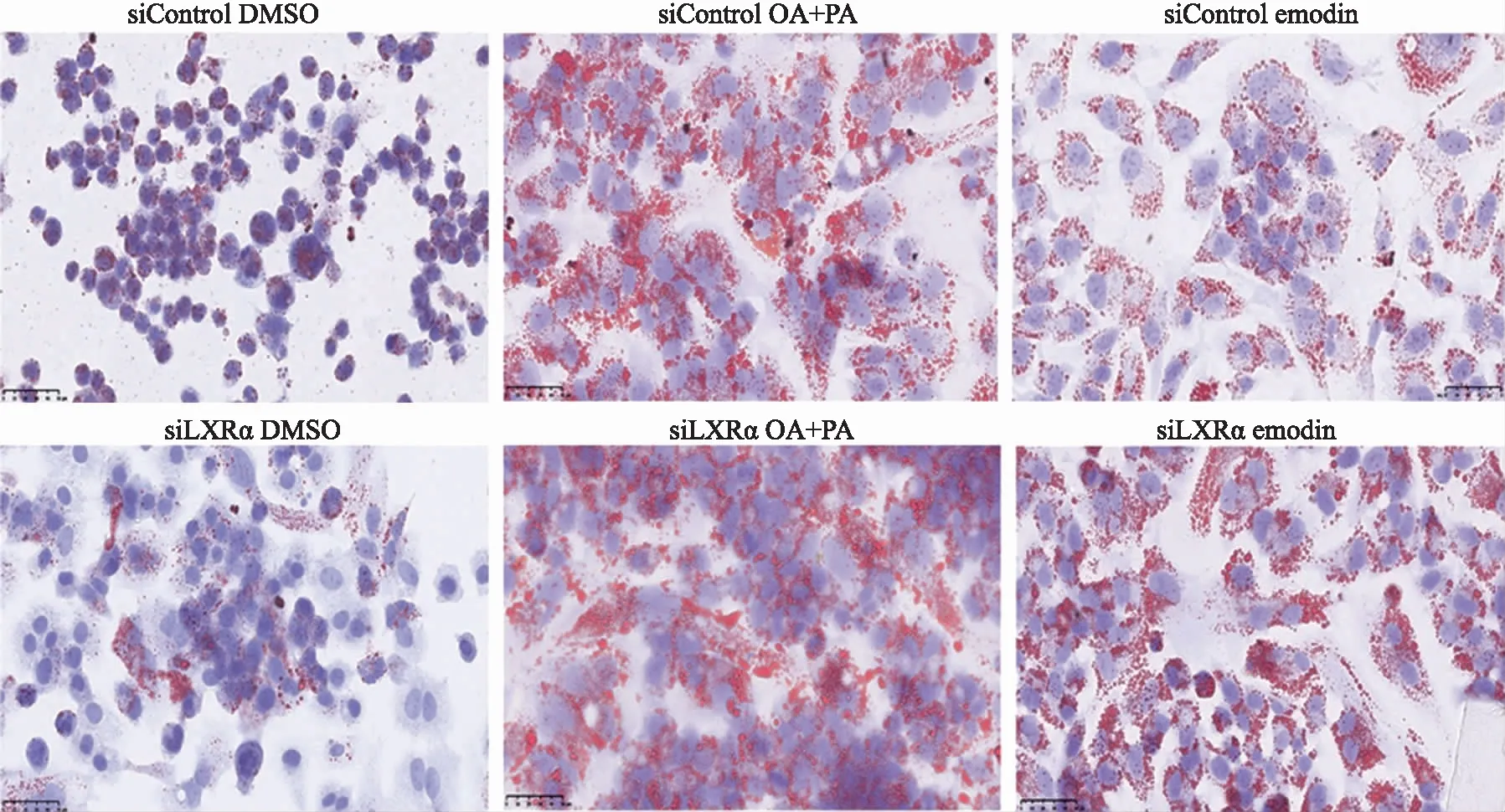
图8 敲低LXRα后,大黄素对HepG2细胞中脂质蓄积影响的显微图(油红O染色,×400) Fig.8 Effect of Emodin on lipid accumulation in siLXRα HepG2 cells (oil red O staining,×400)
成人NAFLD全球流行率约为25%[9]。随着生活方式的快速转变,我国NAFLD的发展日益加快,已成为一个重大的公共卫生问题[10]。因此,积极寻找NAFLD的治疗药物是临床亟待解决的问题。
本研究以高脂细胞添加剂诱导HepG2细胞产生脂质堆积,构建体外NAFLD细胞模型,以探讨大黄素对NAFLD脂质代谢紊乱的改善作用及相关机制。结果显示,HepG2细胞经高脂细胞添加剂诱导48 h后,细胞中脂滴数目增加,TG和TC含量均显著升高,表明脂质堆积模型构建成功。经大黄素干预后,细胞中脂滴数目明显减少,TC含量显著降低,表明大黄素可以减少NAFLD细胞中的脂质堆积。
ABCA1利用ATP作为能量运输胆固醇和磷脂等分子,在胆固醇运输中发挥重要作用。胆固醇代谢异常参与NAFLD和肝纤维化的发病机制。研究报道,在患者中,肝脏ABCA1蛋白水平显著降低[10],在小鼠NAFLD模型中,脂肪变性与ABCA1蛋白表达降低和肝脏脂质储存增加有关,而ABCA1过度表达导致胆固醇流出增加和肝脏脂质含量降低[11]。国内研究报道消瘀化痰中药,紫檀茋和四逆散等促使ABCA1的表达上调,减轻脂质沉积,改善肝组织的病变程度[12-14]。本研究结果显示,大黄素显著升高HepG2细胞中的LXRa和ABCA1的mRNA和蛋白的表达,并提高LXRα-ABCA1双荧光素酶系统的相对荧光值,证明大黄素可以激活LXRα-ABCA1信号通路。敲低LXRα后,大黄素改善HepG2细胞的脂质堆积的作用降低。综上所述,大黄素可通过调节LXRα-ABCA1通路促进细胞内脂质外排,达到降脂效果。
猜你喜欢 孔板黄素荧光素酶 孔板压降的内角影响机理分析及计算公式改进流体机械(2022年11期)2023-01-09核电厂高压安注系统再循环管线节流孔板的分析与改进核科学与工程(2022年3期)2022-10-18NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响中日友好医院学报(2021年1期)2021-04-14双荧光素酶报告基因系统在家蚕基因启动子研究中的应用广东蚕业(2021年1期)2021-03-18重组双荧光素酶报告基因质粒psiCHECK-2-Intron构建转染及转染细胞萤火虫荧光素酶和海肾荧光素酶表达山东医药(2020年9期)2020-05-20穿越时光的黄素石楼海峡姐妹(2019年8期)2019-09-03当药黄素抗抑郁作用研究天然产物研究与开发(2019年1期)2019-03-01当药黄素对H2O2诱导PC12细胞损伤的保护作用天然产物研究与开发(2018年1期)2018-02-02漆黄素固体分散体的制备中成药(2017年12期)2018-01-19推荐访问:沉积 通路 诱导