皮肤发育相关的miRNAs及其在糖尿病创面愈合中的作用*
来源:优秀文章 发布时间:2023-01-23 点击:
李子键 谢苏杰 张佳怡 胡守一 仵敏娟
(海军军医大学基础医学院,1 六大队16队,2 三大队8队,3 三大队7队,4 组织学与胚胎学教研室,上海 200433)
随着人们生活水平的提高以及老龄化进程的加快,我国糖尿病的发病率逐年上升。由于糖尿病患者创面愈合能力严重受损,皮肤创面的损伤可进一步发展为糖尿病溃疡,导致住院率、截肢率、致死率增加,这给国家、社会的健康发展带来了严重的经济与社会负担。近年来,人们对miRNAs在胚胎发育、创面修复、肿瘤发生和疾病调节中的重要作用有了新的发现,一些特定miRNAs的靶点以及作用机制可能成为糖尿病创面治疗与愈合的关键因素,为糖尿病患者皮肤创面的预后提出新的方案。
皮肤的形态发生是一个漫长且机制复杂的过程,受到多种不同信号通路及特定转录因子、生长因子的调节。现有研究已经证实,miRNA调控在这一过程中发挥了重要作用,miRNA异常会对正常的皮肤形态发生产生影响[1-3]。
早期研究miRNA在皮肤发育中的作用是通过特殊手段靶向降低或阻止miRNA生物合成所需要的关键酶,并对比前后皮肤发育的不同程度来推测某种miRNA的调节作用。组织学检查显示,胚胎发育晚期条件性敲除Dicer的小鼠(该种小鼠可以更好地研究miRNA功能[4])皮肤毛囊发育不全及错位,细胞凋亡明显,发育过程中毛囊非内陷性生长,反而向表皮外翻、退化,表皮层特化形成囊状结构,导致小鼠表皮屏障功能减弱或丧失,小鼠脱水以及早期死亡。角蛋白15和CD34属于干细胞的标志物,实验过程中它们的缺失,提示Dicer的小鼠毛囊发育缺陷极大可能是毛囊干细胞的早期缺失所致。该实验一定程度上证实部分miRNAs仅作用于毛囊干细胞,而不是表皮细胞,因为Dicer的小鼠表皮未受到明显影响[4]。毛囊是表皮细胞下陷形成的袋样结构,位于真皮和皮下组织中,可分为毛囊漏斗部、毛囊峡部和毛囊下部3部分。通过miRNA的表达谱研究可以证实调控表皮和毛囊发育的miRNA是不同的,miRNA在特定时期、特定组织中才会表达。在表皮发育早期表达的miRNA有miR-200家族(miR-200a、miR-200b、miR-200c、miR-141、miR-429)和miR-19/miR-20家 族(miR-19b、miR-20、miR-17-5p、miR-93),而miR-199家族成员只在毛囊发生过程中表达[5]。毛囊细胞中miRNA的缺失会减缓细胞增殖,并促进凋亡。相比之下,表皮细胞中miRNAs的生成缺失并不会对其增殖和凋亡有显著影响。这些都证实了miRNAs在皮肤形态发生、毛囊干细胞的稳定、表皮细胞增殖和凋亡中具有重要的作用。
表皮的结构从内到外依次为基底层、棘层、颗粒层、透明层和角化层。颗粒层、棘层与基底层又合称为生发层。生理情况下,基底层细胞不断分裂增殖,角化层细胞不断更新脱落,两者的生长与更新保持着动态平衡,其中miRNA可通过调控表皮角化层细胞的分化阶段从而打破这种平衡。miR-203是一条与皮肤生长发育有关的miRNA, 它在角化细胞中大量表达[6-9]。miR-203能够直接在表皮分化和分层的调控中靶向作用于p63转录因子,通过信号转导途径在强增殖能力的基底层细胞中高表达[10]。miR-203可以靶向作用于Delta Np63[6, 8, 11],抑制p63蛋白的转录翻译, 导致基底层细胞丧失增生能力, 转换为末端分化状态。因此,可以认为部分miRNAs是一种作用于p63的分子开关,能够通过抑制p63的促增殖能力和细胞周期来调节基底层细胞的增殖和棘层细胞的分化状态[8, 9]。不仅如此,p63还可以直接调控miR-34家族基因的表达。靶向敲除p63后,角化细胞中miR-34a和miR-34c的表达水平显著上调,该家族基因抑制细胞周期调控因子-细胞周期蛋白D1和细胞周期蛋白依赖性激酶4的活性,随之引起细胞G1期停滞[12]。同时一些miRNAs还维持着表皮稳态和影响着黑素细胞的色素沉着,此类效应可由miRNAs影响不同的信号通路和调控因子来实现。正常小鼠的表皮细胞和毛囊上皮细胞中表达miR-21。Ahmed研究显示并证实在HaCaT细胞中,miR-21能够阻断骨形态发生蛋白4(bone morphogenetic protein 4,BMP4)对细胞增殖和迁移的抑制作用[13]。综上所述,miRNA通过上调或阻遏特定靶基因的信号转导通路,并调节相关调控因子的活性来维持表皮的稳态,其中多种miRNAs与细胞内多种不同的转录因子、调节因子构成了复杂且精密的功能网络,使得表皮发生中的各个阶段能够有条不紊且精确实现。
由于外力因素等损伤因子造成皮肤的缺失损伤后,局部组织能够通过清理坏死细胞、凋亡损伤细胞,炎性物质的定向趋化作用以及纤维组织的增生等一系列病理生理过程对损伤组织进行修复,炎性阶段、增殖阶段与重塑阶段中miRNA的表达各不相同,影响与作用机制也相差甚远,miRNA的异常表达还可能引起创面畸形愈合[14]。
3.1 创面炎性阶段miRNA的作用
创面愈合释放的炎性介质能够诱导特异性的miRNA表达,而miRNA又能够沉默大量促炎因子,两者存在着一个互相调控的机制。创面炎症及免疫应答中miR-146、miR-155[15]、miR-21[16]及miR-125b[17]发挥了不同的作用,这些miRNAs又能被促炎因子如Toll样受体(toll-like receptors,TLRs)和肿瘤坏死因子(tumor necrosis factor-α,TNF-α),诱导其表达量增加。miR-21是一种可受炎症诱导的miRNA,经转录后能够抑制多个靶基因。炎症期间TLR-4的表达进一步上调miR-125b表达水平,miR-125b又通过直接结合TNF-α的3"UTR区,导致TNF-α表达沉默。在糖尿病小鼠伤口病变实验中[18],显示糖尿病小鼠真皮伤口中的miRNA-497表达显著降低,同时在糖尿病小鼠的全层真皮伤口周围皮内注射miRNA-497能够有效地加速伤口闭合。此外,miRNA-497体外实验与体内实验中被证明可以降低促炎因子白细胞介素IL-1β、IL-6和TNF-α的表达。
3.2 创面增殖阶段miRNA的作用
内皮细胞在增殖阶段的增生与迁移以及毛细血管形成是血管化的早期表现,组织再生的关键是创面中有新生的毛细血管形成,如果创面血管生成被抑制,将会严重影响创面愈合。研究显示内皮细胞毛细血管发芽、迁移和血管生成的抑制与Dicer、Drosha的敲除相关,这间接提示了miRNA参与血管生成[19]。创面增殖阶段miR-17-92的表达水平往往显著上调,其靶基因血小板反应蛋白1(thrombospondin-1,TSP-1)及结缔组织生长因子(connective tissue growth factor,CTGF)能够调控并抑制血管的生成,而miR-17-92通过抑制TSP-1及CTGF,从而干扰其抑制血管生成的过程,促进血管再生[20]。部分研究表明[21],miR-126的调控作用能一定程度上改变血管内皮细胞对血管内皮生长因子(vascular endothelial growth factor, VEGF)的敏感性,例如敲除miR-126后的斑马鱼细胞胚胎发育过程中血管内皮管壁完整性减弱,导致出血发生。
表皮细胞再生在增殖阶段中可表现为创面边缘角质形成细胞的迁移和增殖[22]。miR-205通过抑制SH2结构域的Ⅱ型5"肌醇磷酸酶2(SH2 domain containing 5"-inosi-tol phosphatase-2,SHIP 2)的转录从而促进角质形成细胞的迁移,增强蛋白激酶B(AKT)信号,从而有利于上皮细胞的稳定及创面的愈合;
抑制miR-205后,由于创面的肌动蛋白减少,导致细胞间黏附力增加,使得创面愈合速度减缓[23]。
3.3 创面重塑阶段miRNA的作用
重塑阶段的纤维组织再生是一个重要特征。部分miRNAs在纤维增生性瘢痕疙瘩形成中发挥了重要作用。哺乳动物妊娠早期阶段胎儿皮肤属于无痕愈合[24],而在后期改变为瘢痕愈合表型,通过对比显示在两者之间miRNA的表达存在明显差异,尤其是在妊娠后期miR-29b、miR-29c和 miR-192的表达水平显著升高,间接提示其参与了瘢痕愈合[25]。研究表明miR-29b、miR-29c通过抑制无痕愈合信号通路的相关蛋白质导致皮肤瘢痕修复。另有研究证实[26],正常成纤维细胞与瘢痕疙瘩成纤维细胞的 miRNA 表达谱中,对比显示一些表达水平异常的miRNA,特别是瘢痕疙瘩成纤维细胞中miR-196a下调最明显,miR-196a的表达量与Ⅰ、Ⅲ型胶原水平呈负相关[27]。伤口愈合研究中表明[28],miR-31在伤口边缘处的角质形成细胞中上调,已经显示转化生长因子-β1(transforming growth factor-β1,TGF-β1)和TGF-β2在伤口中均被上调,并促进角质形成细胞迁移(图1)。TGF-β1和TGF-β2与其相应受体的结合导致下游SMAD蛋白的激活,进而诱导TGF-β靶基因的表达。上皮膜蛋白1( epithelial membrane protein 1,EMP-1)一定程度上抑制角质形成细胞增殖和迁移。TGF-β2调控miR-31表达,EMP-1直接靶向miR-31。EMP-1的表达沉默导致角质形成细胞中miR-31的表达水平降低,这表明炎症过程中高水平的EMP-1可能触发miR-31高表达。

图1 EMP-1作为miR-31的治疗性伤口愈合靶标过程
创面愈合的调控过程涉及多个 miRNAs,本文中包含的或未能详述的 miRNA 及其靶基因或靶细胞见表 1。

表1 相关miRNAs在创面愈合中的作用靶点
3.4 miRNAs促进或抑制创面愈合的新进展
Saleh等[29]的研究表明,miR-223的上调显示巨噬细胞极化趋向于抗炎表型(M2),这可能有助于加速伤口愈合,并以此为依据开发了含有miR-223-5p模拟物(miR-223*)透明质酸纳米颗粒的粘合水凝胶,从而控制伤口愈合过程中组织巨噬细胞的极化,并进一步使伤口部位皮肤的血管均匀化,加速伤口愈合。另有研究显示[30],微囊泡(microvesicle,MV)最近已成为将遗传物质输送到靶细胞发挥细胞通讯功能的重要介质,表达miR-21模拟物HEKa-MV的直接递送显著促进了糖尿病大鼠皮肤伤口的愈合。MV miR-21促进成纤维细胞迁移,分化,诱导内皮细胞促血管生成的过程并介导促炎反应。同时,MV miR-21可能靶向成纤维细胞中发挥特定基本效应的mRNA,例如基质金属蛋白酶(matrix metalloproteinase,MMP)家族的MMP-1和MMP-3,组织金属蛋白酶抑制因子(tissue inhibitors of metalloproteinase)家族的TIMP3和TIMP4,可增加MMPs的表达和酶活性。此外,MV miR-21调节ɑ-平滑肌肌动蛋白(ɑ-smooth muscle actin,ɑ-SMA)和N-钙黏蛋白(N-cadherin)表达诱导成纤维细胞向肌成纤维细胞转化,并上调了IL-6和IL-8表达及分泌,从而增强免疫反应;
MV miR-21在蛋白水平下调磷脂酶和张力蛋白同源物 (phosphate and tension homology deleted on chromsome ten)和基质金属蛋白酶抑制基因(reversion-inducing cysteine-rich protein with Kazal motif,RECK),并激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) /细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号级联,从而促进成纤维细胞功能的发挥。
4.1 糖尿病创面的发生及愈合机制
糖尿病患者的创面与正常人的创面相比,糖尿病患者创面通常伴发周围神经及血管病变和感染。长期控制不良的高血糖患者还会引起神经纤维损伤,导致不同程度的感觉减退。糖尿病创面本身的愈合时间较长,再加上患者不同程度感觉减退,导致皮肤受损概率增加,这延长了糖尿病患者创面愈合的时间。同时,持续的高血糖状态还会导致患者血管异常收缩、平滑肌异常、内皮细胞功能障碍以及血浆高凝状态,极大程度提高了闭塞性动脉疾病的发生率,导致糖尿病溃疡形成,局部组织缺血缺氧又进一步加重溃疡。
4.2 促进糖尿病创面愈合的miRNAs
在糖尿病创面愈合中,部分miRNAs通过调控某些基因表达,激活或抑制特定的信号通路来发挥作用。部分研究证明调控止血期的miRNAs可能与血栓形成的几个miRNAs有关[31]。例如miR-96可与囊泡相关膜蛋白8(vesicle-associated membrane proteins 8,VAMP8)的3"UTR 区结合,发挥对血小板反应性的调节作用;
miR-223与人嘌呤能(P2Y12)受体miRNA的3"UTR结合,调节血小板生成[32]。炎症期,Li等[33]的研究显示miR-21可能通过程序性死亡因子4(programmed cell death factor4, PCDF 4)调节核因子κB(nuclear factor kappa-B,NF-κB)的表达,在糖尿病溃疡治疗中起抗炎作用。Xu等[34]的研究显示,miR-146a在糖尿病小鼠伤口中的表达明显下调,其表达降低可能一定程度上促进了与炎症相关基因的表达,导致糖尿病小鼠伤口难以愈合。Shanmugam等[35]研究证实miR-16能抑制环氧合酶-2的表达,显示出全身抗炎作用。Li等[36]研究表明miR-132在炎症期表达上调,在增殖期达到高峰,通过增加信号转导子和转录激活子3(signal transducer and activator of transcription3,STAT3)和ERK通路的活性,促进了角质形成细胞的生长。在糖尿病创面中,miR-26a表达水平显著提高,miR-26a通过局部提高表达水平从而诱导糖尿病小鼠的血管生成,促进创面愈合,参与血管再生反应及早期内皮功能障碍的修复[37]。
4.3 抑制糖尿病创面愈合的miRNAs
糖尿病患者的部分miRNAs通过引起血管内皮功能障碍、维持炎症状态以及抑制角质形成细胞迁移和再上皮化,抑制了愈合,造成创面愈合困难。糖尿病使得机体处于慢性低度炎症状态,并延长炎症反应,这对伤口闭合是不利的。Ramirez等[38]的研究显示糖尿病溃疡炎症期中的金黄色葡萄球菌具有抑制伤口闭合和诱导miR-15b-5p上调的特点,进而抑制下游靶基因IκB激酶β(inhibitor kappa B kinase β,IκBKβ),导致miR-15b-5p在创面处持续表达,炎症状态得以持续。Dangwal等[39]研究显示,Ⅱ型糖尿病患者创面中,miR-191与C-反应蛋白(C-reactive protein,CRP)和促炎症细胞因子增加有关,会延缓创面组织修复。糖尿病伤口中成纤维细胞增殖减少,细胞凋亡情况明显,纤维细胞迁移能力下降,角质形成细胞增殖明显但分化程度降低。Pizzino等[40]将 抗miRNAs、抗miR-15b、抗miR-200b或 抗miR-15b/200b,应用于糖尿病小鼠皮肤伤口边缘,显示抑制miR-15b和 miR-200b可改善糖尿病伤口愈合。Lucas等[41]的研究表明糖尿病创面与急性创面比较,在慢性伤口中miR-92a的表达水平有明显的上调,实验证实抑制miR-92a的表达水平能够促进糖尿病小鼠血管生成和创面愈合。综上所述,导致糖尿病创面愈合延缓与miRNAs表达水平失调有密切关系。
4.4 miRNAs在糖尿病足中的治疗前景
糖尿病足是糖尿病患者的一种神经病变,因末稍神经感觉障碍及植物神经的损害,导致下肢血管病变的一种疾病。糖尿病患者常因周围小动脉闭塞或细菌感染导致足部疼痛、溃疡、坏疽。相关研究表明,一些miRNAs的调节失控,参与了糖尿病不同病理生理阶段的伤口愈合,如图2[42]所示。例如,糖尿病患者中miR-27b[43]过表达使细胞增殖增加,通过直接靶向调控TSP1、TSP2、导向蛋白6A(semaphorin 6A)和p66shc改善伤口愈合。miR-99[44]在伤口中表达量减少,信号通路PI3K/AKT受到抑制,角质细胞的形成、迁移和增殖减少。糖尿病小鼠的实验显示miR-155[45]是一种功能性调节免疫应答的RNA,其表达的降低能够减少炎症反应,促进伤口愈合。此外,miRNA-26a[46]的表达受到抑制时,通过调控相关因子的表达水平来诱导血管生成与肉芽组织增生,促进创面愈合。
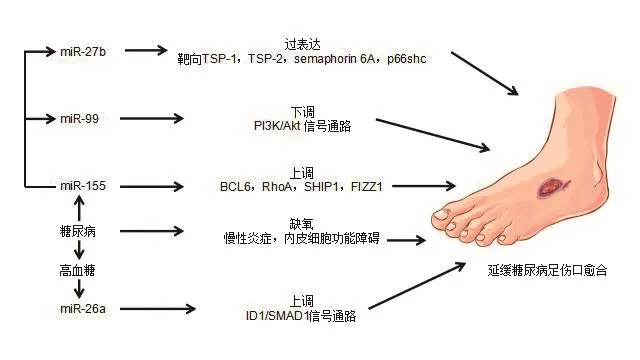
图2 miRNAs对糖尿病足创面愈合的调控
目前,已经有了多种基因传递系统。病毒理论上是最有效的载体,然而病毒载体通常具有突变、毒性、递送量有限的不足。因而发明安全高效的miRNA递送系统具有重要意义,非病毒性miRNA递送系统逐渐成为研究新焦点,其毒性和免疫原性较低,细胞摄取量大,水溶性强。一般而言,理想的miRNA载体应当充分考虑到miRNA分子本身带有负电荷,并能在血液循环中保持稳定,能够携带miRNA到达靶点,促进细胞摄取,避免溶酶体降解。非病毒性miRNA的传递方式可分为复合、结合和封装[42]。Wu等[47]通过使用阳离子脂质复合物系统传递miRNA,获得了更高的转染效率。金纳米粒子作为一种低毒的纳米材料成为目前备受关注的新型miRNA载体,多次实验证明金纳米粒子是非细胞毒性和无免疫原性的物质[48]。金纳米粒子在递送系统中首先通过络合作用将miRNA包被,结果表明其能使细胞通过高效的内吞作用释放复合物从而使miRNA在靶位点及时表达[49]。miRNAs在皮肤发育及愈合中的作用日益凸显,了解其作用机制并通过目前研究的miRNAs递送系统高效、精确地到达靶细胞,对进行治疗具有重要的临床意义。另外,外泌体是细胞自分泌和旁分泌信息的重要载体。外泌体能够与靶细胞融合,并将封装的物质(如蛋白质、脂质或RNA)运输到靶细胞,以介导细胞之间的信息交换,并调节靶细胞的生理和病理功能。有研究表明[50],miRNA-221-3p是内皮祖细胞(endothelial progenitor cell,EPC)衍生的外泌体中高表达的miRNA之一,其增加了血管生成相关因子VEGF,CD31和细胞增殖标记Ki67的蛋白表达水平,生物信息学分析表明miRNA-221-3p可能与糖尿病并发症、细胞周期和p53信号通路中的AGE-RAGE信号通路有关。
研究表明,一些特定miRNAs的靶点以及作用机制成为糖尿病创面治疗与愈合的关键因素。通过RT-PCR等简便易行并具有高度灵敏性的方法可以检测miRNAs的表达,从而监测糖尿病创面进展及评判疗效。未来可以将miRNAs作为切入点对糖尿病患者的溃疡创面治疗提供一条新思路。当然,糖尿病溃疡愈合中与miRNAs调控有关的研究目前仍然存在着局限性,目前得出的大部分理论成果主要来自小鼠模型,但是小鼠和人的伤口愈合方式并不相同,小鼠皮肤通过加强收缩加快愈合,人的伤口则通过肉芽组织的形成来愈合。并且人与小鼠参与创面愈合的miRNAs极大可能是不同的[51]。诚然,miRNAs对于创面愈合的机制尚未清楚,但相信随着研究的深入,未来将会有更多的治疗方法应用于临床,使糖尿病创面愈合得以解决。
猜你喜欢 毛囊表皮创面 科研人员揭示油桃果实表皮不长毛的奥秘今日农业(2022年3期)2022-06-05探讨浓缩生长因子(CGF)在糖尿病足溃疡创面治疗中对溃疡创面愈合的作用中国典型病例大全(2022年9期)2022-04-19透明质酸基纳米纤维促进创面愈合纺织科学研究(2021年6期)2021-12-02建筑表皮中超薄基材的应用分析建材发展导向(2021年14期)2021-08-23负压创面治疗技术应用的研究进展感染、炎症、修复(2021年1期)2021-07-28中西医结合治疗毛囊闭锁三联征2例感染、炎症、修复(2021年1期)2021-07-28中国美利奴羊(新疆军垦型)胎儿期皮肤毛囊结构及形态学观察西南农业学报(2021年1期)2021-05-25植发那些事爱你(2019年41期)2019-11-16“拆西墙补东墙”高质毛囊资源宝贵文萃报·周二版(2019年37期)2019-09-10人也会“蜕皮”,周期为一个月祝您健康·文摘版(2019年4期)2019-06-11推荐访问:创面 愈合 发育