17β-雌二醇诱导斑点叉尾鮰雌性化研究
来源:优秀文章 发布时间:2023-01-20 点击:
徐思琪 张世勇 段永强 张文平 王明华 边文冀, 陈校辉,,*
(1. 江苏海洋大学海洋科学与水产学院, 连云港 222005; 2. 江苏省淡水水产研究所, 南京 210017; 3. 江苏省农业种质资源保护与利用平台, 南京 210014; 4. 上海海洋大学水产与生命学院, 上海 201306)
斑点叉尾鮰(Ictalurus punctatus)属鲶形目, 鮰科, 原产于北美, 是美国目前产量最高, 养殖技术最为成熟的淡水鱼养殖品种[1]。因其具有较强的环境适应能力, 较好的肌肉品质, 无肌间刺并易于加工等优点, 目前已经成为世界性养殖品种, 2017年全美养殖产值近3.8亿美元。斑点叉尾鮰于1984年引种至我国, 广东、河南、江苏、湖北和四川等省份具有较大规模的养殖。近年来, 我国斑点叉尾鮰养殖年产量一直稳定在40×107kg以上, 已成为中国淡水养殖业的新兴养殖品种[2]。斑点叉尾鮰的生长存在一定的雌雄二态性, 且雌性规格达到500 g以上后, 性腺发育加快, 生长减慢, 饲料系数提高。雌性成鱼由于存在较大的卵巢组织, 导致其可食用比例下降, 市场需求降低。
硬骨鱼类的生殖方式分为雌雄同体、雌雄异体和单性生殖。对于雌雄异体的硬骨鱼类而言, 其性别分化易受环境因素的影响, 原始性腺分化为卵巢还是精巢由遗传因素和环境因素共同决定。通过外源性激素改变鱼类性别分化方向早有报道, 在性别分化前使用外源雌激素或雄激素处理后会使鱼类的性别雄性或雌性分化发生逆转[3]。Yamamoto等[8]成功将正常雄性青鳉(XY型), 与经过性逆转后得到的生理性别为雌性的青鳉(XY型)杂交, 得到超雄性青鳉(YY型)。在国内, 刘汉勤等[4]利用激素诱导性逆转的方法结合雌核发育技术, 获得超雄和全雄黄颡鱼(Pelteobagrus fulvidraco)。采用类似的方法,已成功培育出可育后代的超雄性尼罗罗非鱼(Oreochromis niloticus)[5]、虹鳟(Oncorhynchus mykiss)[6]和红斑石斑鱼(Epinephelus morio)[7]等。
斑点叉尾鮰性别决定机制研究开始于20世纪80年代, 目前广泛接受的观点认为其性别决定系统为雄性异配子型(XX/XY)[8]。理论上, 开展全雄斑点叉尾鮰选育技术研究, 可以显著提高其整体生长速度和规格整齐度, 且有助于良种的管控。使用雌激素诱导斑点叉尾鮰仔鱼, 筛选XY雌鱼与正常雄鱼杂交生产超雄鱼(YY型), 再将其与正常雌鱼(XX型)杂交即可获得全雄后代, 整个培育过程需要经过3个世代。获得稳定遗传的XY雌鱼是培育全雄鱼或超雄鱼最为关键的一个环节。为此, 本研究旨在探究培育斑点叉尾鮰XY雌鱼的方法及性逆转评估方法, 以期为后续全雄斑点叉尾鮰新品种的培育奠定基础。
1.1 试验材料
试验所选用的斑点叉尾鮰亲鱼来自江苏省淡水水产研究所扬中基地。选取健康亲鱼暂养一周,按照配种方案交配产卵后, 选取弹性十足、色泽饱满和颜色黄润的受精卵, 在斑点叉尾鮰鱼卵专用孵化装置中孵化出苗。设置A、B、C和D四个试验组, 分别投喂17β-E2添加剂量为0 (对照组)、6、30和60 μg/g 的微粒饲料, 各试验组设置3个平行,每个平行放养200尾卵黄囊苗(52尾/g)。粒径S1、S2、S3和S4的微粒饲料购自山东升索饲料科技有限公司。17β-E2母液与95%乙醇溶液混匀后加入微粒饲料中, 充分搅拌后于烘箱中60℃烘干, 密封袋保存备用。待鱼苗卵黄囊消失,开始投喂卤虫3d。对各组已经开口的仔鱼连续饱食投喂含有对应17β-E2剂量的微粒饲料至30日龄, 并根据仔鱼体长调整微粒饲料粒径, 微粒饲料调整方案如表 1所示。试验鱼养殖至30日龄后,转移至室外水泥池(5 m×5 m×1 m)中继续养殖,投喂商品饲料(南京市澳华生物科技有限公司)。养殖水体中溶解氧>5 mg/L, 氨氮含量<0.02 mg/L。每日于上午8:00和下午17:00各投喂1次, 日投喂量为鱼体重的3%。

表1 微粒饲料调整方案Tab. 1 Particulate feed adjustment scheme
1.2 试验样品采集
从各试验组中随机取10尾60日龄试验鱼, 3-氨基苯甲酸乙酯甲基磺酸盐(MS-222; Merck, 德国)麻醉后分别取尾鳍以及卵巢组织, 尾鳍用95%乙醇溶液保存在1.5 mL 离心管中,性腺用多聚甲醛溶液保存在1.5 mL EP管中, 样品存放于4℃的冰箱中保存, 用于遗传性别鉴定及组织切片。同时, 在60日龄记录各组试验鱼存活情况, 并称量各组试验鱼的体重和体长等生长数据。在270日龄, 从各试验组中取雌鱼的鳃、心脏、肝脏、肾脏、卵巢和肌肉后, 放置于冻存管中液氮保存, 用于17β-E2含量的检测。同时, 取A组雌雄鱼的卵巢、精巢组织, 以及D组XX雌鱼与XY雌鱼卵巢组织, 液氮速冻后于–80℃冰箱保存。
1.3 遗传性别鉴定
取20 mg尾鳍组织,剪碎后置于1.5 mL EP管中。使用DNA Isolation Mini Kit试剂盒(南京诺维赞生物科技有限公司)提取基因组DNA, 操作过程按照说明书进行, DNA样本于–20℃保存。应用斑点叉尾鮰遗传性别鉴定方法[8]对试验鱼的遗传性别进行鉴定。
1.4 解剖学观察
从各试验组随机取100尾60日龄试验鱼, 麻醉后在肛门开口1—2 mm处沿腹中线由下至上做纵向切口, 切口大约为3—4 cm左右, 切口根据试验鱼大小做细微调整, 剥离脏器后, 在体腔黏膜下方处观察性腺发育情况。根据遗传性别鉴定结果, 对各组100尾60日龄试验鱼的卵巢形成比例和性逆转率进行统计。在剥离脏器过程中, 避免破坏试验鱼各部位脏器, 防止内脏大量出血, 从而导致腹腔大量血液淤积, 不利于对卵巢的观察。
1.5 组织学观察
将保存在多聚甲醛中的卵巢组织经脱水、透明、石蜡包埋后, 常规切片5—6 μm, 经苏木精、伊红染色, 用中性树胶封片。光学显微镜成像系统(Nikon,日本)观察, 并拍照记录, 根据遗传性别鉴定结果, 挑选A组正常雌鱼和B组、C组、D组XY雌鱼卵巢进行组织切片, 在组织学水平比较卵巢发育差异。
1.6 17β-E2含量测定
根据遗传性别鉴定结果, 准确称取液氮保存的各处理组XY雌鱼和对照组雌鱼的鳃、心脏、肝脏、肾脏、卵巢、皮肤和肌肉组织, 按重量(g)﹕体积(mL)=1﹕10的比例加入10倍预冷PBS,高速研磨、离心后取上清50 μL加入考马斯亮蓝(G-250)(Merck,德国)作用25min后(5倍稀释), 于595 nm波长,1 cm光径, 蒸馏水调零, 测定各管吸光度后,进行各组织中17β-E2含量的测定。本试验所用17β-E2ELISA试剂盒购自南京建成科技有限公司。450 nm波长下依序测量各样品的吸光度(OD值), 测定应在加终止液后10min内进行。根据浓度和OD值得出标准曲线的回归方程, 并计算每个样品的17β-E2含量。
1.7 qRT-PCR检测雌雄性别分化相关基因
使用RNA提取试剂盒(Qiagen, 德国)提取270日龄A组雌雄的卵巢、精巢组织, 以及D组XX雌鱼与XY雌鱼卵巢组织的总RNA。按照Prime ScriptTMRT Master Mix试剂盒(TaKaRa, 日本)操作过程合成cDNA。分别根据斑点叉尾鮰雌雄性别分化基因foxl2和dmrt1编码区基因序列设计特异性qRT-PCR反应引物, 以α-tubulin基因作为内参基因, qRT-PCR反应引物如表 2所示。qPCR 体系为 25 μL, 包括12.5 μL TB Green染料(TaKaRa,日本), 2 μL cDNA,上下游引物各1 μL, 补H2O至25 μL。qRT-PCR程序为 95℃30s, 95℃ 15s, 57℃ 30s, 95℃ 15s, 60℃ 15s, 79℃5s, 95℃ 15s, 每个试验3次重复。采用2–∆∆Ct值法计算foxl2和dmrt1基因在各样本种的相对表达量。

表2 qRT-PCR反应引物表Tab. 2 The primers for q-PCR in this study
1.8 数据分析
采用Excel软件整理数据, 所有数据采用R 4.0.5软件进行单因素方差分析(One-way ANOVA), 显著性水平用P表示, 显著性水平为P<0.05, 极显著性水平为P<0.01。
2.1 17β-E2处理对生长和存活的影响
对各组60日龄试验鱼的生长情况进行评估, 分别测定了体长和体重等生长数据, 并计算各组试验鱼的存活率(表3)。结果表明, 各组试验鱼的存活率与对照组无显著性差异, C组试验鱼的体重和体长显著性高于B组和对照组(P<0.05), 极显著性高于D组(P<0.01), 说明适当提高饲料中17β-E2剂量有助于试验鱼的生长, 但添加的17β-E2量过高会抑制其生长(表3)。

表3 各组试验鱼生长和存活数据Tab. 3 Growth and Survival data of channel catfish in each experimental group
2.2 卵巢发育评估
根据遗传性别鉴定结果(图1), 挑选A组正常雌鱼和各B组、C组、D组XY雌鱼卵巢进行组织切片(图2)。对照组和各处理组卵巢的卵母细胞均以Ⅱ期卵母细胞为主, 大小均匀, 呈椭圆形或圆形。核内分布1至5个不等的核仁。在B组、C组、D组中, XY雌鱼的卵母细胞数量和核仁数量随着17β-E2剂量的升高而增多, 核质比随之减小。

图1 斑点叉尾鮰遗传性别鉴定示例图Fig. 1 Genetic sex identification of channel catfisha. 雌性斑点叉尾鮰遗传性别鉴定图; b. 雄性斑点叉尾鮰遗传性别鉴定图a. the genetic sex identification of female channel catfish; b. the genetic sex identification of male channel catfish
通过对各组60日龄试验鱼的卵巢形成及发育情况的解剖观察,卵巢的形成比例与17β-E2剂量呈正相关。对照组中精巢与卵巢的比例接近1﹕1, 随着饲料中17β-E2剂量的提高其性逆转率也呈升高的趋势(表4)。D组的逆转率达到100%, XY雌鱼的卵巢发育最好, 与对照组卵巢发育相似; B组的性逆转率最低, 为61.4%, 且XY雌鱼的卵巢发育较差, 与同时期对照组和其他处理组相比卵巢较细、轮廓不清晰(图2)。

表4 各试验组雌鱼比例统计表Tab. 4 Statistical table of proportion of female fish in each experimental group
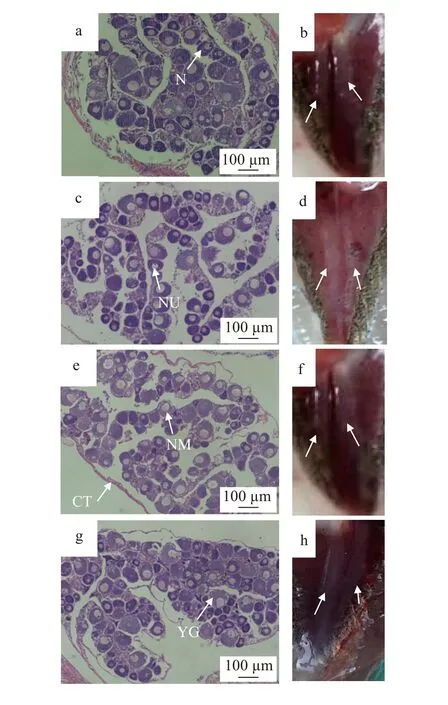
图2 60日龄斑点叉尾鮰卵巢组织图Fig. 2 Histological sections and anatomy of the ovaries of channel catfish at 60 dahsa、c、e、g. A组XX雌鱼及B、C、D组XY雌鱼的卵巢组织切片图; b、d、f、h. 分别是A组XX雌鱼和B、C、D组XY雌鱼的卵巢组织解剖图。NM. 核膜; N. 细胞核; NU. 核仁; YG. 卵黄颗粒; CT. 结缔组织a. the histological section figure of channel catfish (XX) ovary, c,e, g. the histological section figures of sexual reversal channel catfish (XY) ovaries in group A, B, C and D; b. the anatomy figure of channel catfish (XX) ovary, d, f, h. the anatomy figures of sexual reversal channel catfish (XY) ovaries in group A, B, C and D respectively. NM. Nuclear membrane; N. Nucleus; Nu. Nucleolus; YG. Yolk granules; CT. Connective tissue
2.3 17β-E2含量测定
对照组雌鱼和各处理组XY雌鱼的鳃、心脏、肝脏、肾脏、卵巢和肌肉中17β-E2含量进行测定(表5), 鳃、心脏、肝脏、肾脏和肌肉等组织中17β-E2含量均无极显著性差异(P>0.01); 而卵巢中17β-E2的含量与其添加剂量呈正相关, D组显著性高于对照组和C组(P<0.05), 极显著性高于B组(P<0.01)。

表5 各试验组斑点叉尾鮰不同组织中17β-E2含量Tab. 517 β-E2 content in different tissues of channel catfish from each experimental group
2.4 qRT-PCR检测雌雄性别分化相关基因
通过qRT-PCR对270日龄A组正常雌鱼、雄鱼的卵巢和精巢组织, 以及D组XY雌鱼和XX雌鱼卵巢组织中雄性性别决定基因dmrt1和雌性性别决定基因foxl2的相对表达量进行检测(图3)。结果显示,dmrt1基因在A组雄鱼的精巢中的表达量(P<0.01)极显著性高于A组正常雌鱼卵巢以及D组XY雌鱼和XX雌鱼卵巢组织, 且D组XY雌鱼的卵巢组织中其表达受到抑制;foxl2基因在D组XY雌鱼和XX雌鱼的卵巢组织中表达受到激活, 且在XY雌鱼卵巢组织中的表达量显著性高于XX雌鱼的卵巢组织及A组正常雌鱼和雄鱼的卵巢和精巢组织(P<0.05)。

图3 斑点叉尾鮰性别分化基因表达图Fig. 3 mRNA expression levels of sex differentiation genes in channel catfisha. 斑点叉尾鮰雄性性别分化基因dmrt1表达图; b. 斑点叉尾鮰雌性性别决定基因foxl2表达图。图中4个组织依次为D组XX雌鱼和XY雌鱼卵巢组织, 以及A组XX雌鱼卵巢和XY雄鱼精巢组织a. mRNA expression levels of dmrt1 gene; b. mRNA expression levels of foxl2 gene. The four tissues in the figure were XX female and XY female ovaries in group D, as well as XX female ovary and XY male testis in group A
动物在早期生长发育过程中, 性别分化是极为重要的生物学过程, 较为高等的脊椎动物的性别分化主要由性染色体上的性别决定基因所决定, 环境因素所起的作用往往较小, 而低等脊椎动物(如爬行类、两栖类、鱼类等)的进化程度相对较低, 其早期性别分化极易受到温度、pH、溶解氧、光周期、外源性激素和种群密度等环境因素的影响[9,10]。性别分化的差异是由于相关类固醇代谢酶在雌雄个体中差异表达, 从而导致内源性类固醇分泌水平的改变。雌激素对鱼类的雌性性别决定、性腺分化和维持具有至关重要的作用, 在外源性雌激素诱导下, 雄鱼的生理性别能够逆转为雌性[11]; 当体内雌激素下调时, 已分化的卵巢也能够逆转为精巢[12,13]。17β-E2是鱼类天然的雌性性别分化诱导剂, 在多种鱼类中已开展17β-E2诱导雄性性别逆转研究[14,15]。
不同鱼类的性腺分化时间存在一定的差异, 如斑点叉尾鮰的卵巢分化开始于19日龄, 而精巢分化于90—102日龄;黄姑鱼(Nibea albiflora)[16]是在36日龄时卵巢开始分化, 46日龄出现卵巢腔;半滑舌鳎(Cynoglossus semilaevis)[17]在62日龄卵巢开始分化,当发育到120日龄可以观察到明显的卵巢腔。本试验对斑点叉尾鮰开展17β-E2诱导起始于其开口时期, 直至第30日龄, 通过在饲料中添加不同剂量的17β-E2, 进而控制其体内雌激素水平, 以探究斑点叉尾鮰XY雄鱼雌性化的合适17β-E2剂量。
激素诱导鱼类性逆转研究一般采用投喂法和浸浴法两种方法。投喂法一般是将激素添加到饲料中, 鱼体以摄食的方式将激素摄入体内; 浸浴法是在养殖水体中加入一定浓度的激素, 以促进鱼类发生性逆转现象。较多研究表明, 激素饲喂法往往要好于浸浴法[18—20]。本试验以卤虫-人工配合饲料作为17β-E2载体, 在斑点叉尾鮰仔鱼开口阶段投喂激素处理的卤虫, 并在此后的不同发育阶段投喂合适粒径的微粒饲料。通过解剖观察发现, 仅60 μg/g 17β-E2处理组试验鱼的性腺全部为卵巢, 但其体长和体重及存活率均小于其他处理组合对照组, 30 μg/g处理组的性逆转率虽为81.4%, 但却拥有最佳的生长数据。在尼罗罗非鱼[21]、淞江鲈(Trachidermus fasciatus)[22]、河鲈(Perca fluviatilis)[23]的研究中发现, 在一定的范围内, 类固醇激素对生长具有促进作用, 但添加过高的激素剂量却会抑制的生长。
在性腺分化时期短期使用17β-E2, 一般不会造成其在鱼体内富集[24,25], 且我国农业农村部第193号公告《食品动物禁用的兽药及其他化合物清单》中并未将雌二醇列入该清单。高艳丽等[26]研究发现17β-E2处理史氏鲟(Acipenser schrenckii)后,在其肌肉中含量较低, 停药一段时间后, 17β-E2在肌肉中的含量达到正常水平。本试验对各处理组中60日龄试验鱼鳃、心脏、肝脏、肾脏、卵巢和肌肉等组织中17β-E2含量进行检测, 各组中仅卵巢组织中17β-E2含量存在差异, 其中D组卵巢17β-E2的含量显著性高于其他处理组和对照组; C组的卵巢组织中17β-E2含量显著性高于与B组, 但与对照组无显著性差异, 在一定程度上说明该处理组卵巢中17β-E2含量更加接近于正常卵巢组织。
与其他鱼类一样, 斑点叉尾鮰foxl2基因和dmrt1基因被广泛认为雌雄性别分化标志基因[27]。foxl2基因对卵巢的分化及功能维持起着重要作用,dmrt1基因主要调控雄性性别分化相关下游基因[28,29]。在性别分化前期, 红耳滑龟(Trachemys scripta)[30]、黑鲷(Acanthopagrus schlegelii)[31]和尼罗罗非鱼[32]等经17β-E2处理后,dmrt1基因表达显著降低, 而foxl2基因的表达则显著上调。在本研究中, XY雌鱼的foxl2基因的表达量显著高于其他3组, 而dmrt1基因的表达量则显著低于其他3组, 该结果进一步说明在斑点叉尾鮰性别分化前期使用17β-E2进行诱导能够促进雌性性别分化基因的表达, 并抑制雄性性别分化基因的表达, 进而实现斑点叉尾鮰由雄性逆转成雌性。
本试验采用17β-E2作为雌性性别分化诱导剂相对安全、可靠。30 μg/g17β-E2处理组(C组)具有较快的生长速率, 但不能实现雄性性别100%逆转;60 μg/g处理组(D组)虽能够实现全部逆转, 但由于剂量相对较高, 在一定程度上抑制了试验鱼的生长。因此, 实现斑点叉尾鮰雄鱼雌性化的最佳17β-E2剂量仍需要在30和60 μg/g 17β-E2处理组之间进一步优化。
猜你喜欢 斑点日龄分化 两次中美货币政策分化的比较及启示清华金融评论(2022年4期)2022-04-13斑点豹智慧少年·故事叮当(2021年5期)2021-08-23分化型甲状腺癌切除术后多发骨转移一例国际放射医学核医学杂志(2021年10期)2021-02-28鲁政委:房地产同城市场初现分化房地产导刊(2020年7期)2020-08-24初配日龄对大白母猪繁殖性能的影响养猪(2020年1期)2020-02-19不同初配日龄对二元杂种母猪繁殖成绩的影响养猪(2020年1期)2020-02-19新兴市场货币:内部分化持续中国外汇(2019年14期)2019-10-14不同去势日龄对保育猪生长性能的影响国外畜牧学·猪与禽(2018年11期)2018-05-14Finding beauty in your scars Alexandra Heather Foss第二课堂(课外活动版)(2015年4期)2015-10-21蛋鸡合理投料量农村农业农民·B版(2015年9期)2015-10-16推荐访问:雌性 斑点 诱导