杀菌剂毒力及其生物测定
来源:优秀文章 发布时间:2023-01-18 点击:
周明国
(南京农业大学 农药抗性与治理技术研究中心,南京 210095)
1.1 杀菌剂毒力的定义
一般认为现代杀菌剂发展历史开端于1885 年法国植物学家先驱米拉迪特 (Millardet) 报道并在后来大面积推广应用的波尔多液。但是,化合物用于消毒及防控植物病害的生产实践可以追溯到公元前大约1000 年。在漫长的杀菌剂发展历史长河中,人们对杀菌剂发挥作用的原理并无科学认知。直至1943 年,阿农 (Anon) 在美国植物病理学报发表了《杀菌剂术语的定义》,最早给出了比较准确的杀菌剂毒力定义[1-3]。他指出“杀菌剂的毒力是指一种化合物通过生理化学方式对某种真菌生命功能进行反向干扰的能力”。在该杀菌剂毒力定义的理论指导下,限定了杀菌剂的定义是“破坏或抑制真菌孢子萌发或菌丝发育的任何物质”[4],建立了杀菌剂筛选和毒力测定方法,促进了早期杀菌剂的快速发展。
然而,随着新型杀菌剂的开发和人们对杀菌剂生物学理论与实践的认知不断深入,这一早期的杀菌剂毒力定义显现出局限性,不能涵盖后来发展的所有杀菌剂及其在生产上应用效果的实际含义。考虑到目前一些防治植物病害的杀菌剂,在实验室离体条件下并不表现对病原菌的生长和发育等生命功能具有显著的反向干扰作用,而是在一定环境条件下通过干扰病原物与寄主的互作关系或改变环境减少侵染来源达到病害防控目的的[5-6]。因此,作者认为有必要将Anon 的杀菌剂毒力定义加以完善。根据当今对杀菌剂毒力的理解应该是一种化合物通过生物化学方式对某种病原菌生命功能进行反向干扰,抑制其生长发育的能力或通过与寄主和环境的相互作用,控制植物病害及其流行的效力。换言之,在杀菌剂创制过程中只有被证明其通过与寄主和环境互作能够防控植物病害的化合物,才具有进一步开发为农用杀菌剂的潜能。
一些化合物可能直接干扰病原菌的生命功能,抑制病原菌生长、发育和繁殖,阻止病原菌的侵染或侵染后在寄主体内扩展和繁殖,进而防治植物病害或抑制病害的进一步流行[7]。一些化合物也可能通过激发植物产生抗病 (亦称免疫激活)反应,产生活性氧、胼胝质、酚、醌类、萜类、黄酮类等植保素抵御病原菌侵染和扩展,通过对病原物的间接作用来防治植物病害[8]。无论是单一的直接作用或者间接作用,还是这两种作用方式兼备的杀菌剂,其毒力是由化合物的分子结构决定的,属于一种化合物对某种病原菌毒力活性或病害防控作用的固有生物学性质。凡是利于病原物生长发育和不利于作物健康生长的环境条件,会不同程度地降低杀菌剂的毒力作用,反之亦然。基于这种理论,以提高化合物毒力为目标的化合物分子设计、合成创制、结构优化,以及符合毒力作用的杀菌剂筛选方法、活性评价是农药创制和应用技术研发的基本研究内容。
人们通常以杀菌剂在离体条件下对病原菌孢子产生和萌发以及菌丝体生长发育的抑制作用,或者是在活体上诱导寄主植物产生抗病性、抑制病害发生的作用或效果表示杀菌剂的毒力作用。这种杀菌剂干扰植物病原菌生命活动或病程的直接毒力作用,虽然是衡量杀菌剂毒力的主要指标,但并不全面。人们往往忽视了某种杀菌剂或某种化合物降低病原物的繁殖能力和致病能力,如抑制致病的毒素小分子化合物和效应因子的生物合成或致害作用,尤其是忽视了对自然界微生物组、病原菌的侵染致病过程及病原菌生存环境的调控作用。杀菌剂的这些潜在的直接和间接的毒力作用对于植物病害流行及可持续控制的影响是巨大的,以致我们常常低估了杀菌剂的毒力作用和可能的副作用。遗憾的是,至今仍然鲜见有关杀菌剂对病害流行生态控制方面的研究报道。
1.2 杀菌剂毒力与化合物分子结构的关系
杀菌剂表现的毒力作用实际上是药物配体与病原菌或寄主植物细胞内的受体或作用的分子靶标在一定条件下相互作用的结果。多数情况下,杀菌剂的受体或作用的分子靶标是蛋白质。生物化学反应是生物分子之间相互作用的结果,而生物体内的分子互作是极其精确、有序和复杂的。杀菌剂小分子与作用靶标蛋白的相互作用也同样具有精确结构的专化性,并影响或改变细胞内分子互作的时序性和复合体三维结构,传导毒力信号,产生毒理学反应[9-10]。只要药剂分子结构发生轻微改变,甚至是手性结构变化也很可能引起与受体蛋白互作方式和结合力的改变,甚至改变互作位点或互作的分子靶标,从而表现出毒力变化甚至作用机制的变化[11-13]。正是基于这种生物学理论,人们才能基于活性先导物合成大量的衍生物,并从中筛选到活性更高、选择性更强或其他生物学性能更佳的新型杀菌剂。
受体蛋白在折叠或与其他分子发生生化反应过程中可以形成具有腔或囊的结构,或是形成与一定结构的小分子化合物亲和互作结构域的所谓“口袋”三维结构颗粒,小分子化合物是在与特异性受体蛋白质颗粒之间的不同类型分子相互作用下,将杀菌剂分子装入“口袋”或黏附在亲和结构域上[10,14-15]。杀菌剂分子的某个基团能够与受体蛋白质的特定氨基酸形成化学键,组成药-靶复合体,以致受体蛋白质丧失功能。例如,我们发现苯并咪唑类杀菌剂多菌灵与真菌细胞内β-微管蛋白第16、50、167、198、200、240 位等氨基酸组成的“口袋状”结构域互作,其中苯并咪唑基团与200 位苯丙氨酸和240 位亮氨酸/苯丙氨酸、氨基甲酸酯基团与198 位谷氨酸形成化学键,阻止β-微管蛋白和α-微管蛋白二聚体组装微管,或使二聚体解聚,抑制细胞有丝分裂[16-18];
或者竞争性抑制微管蛋白二聚体与异柠檬酸脱氢酶互作,降低三羧酸循环速率,促进次生代谢物合成[19]。氰烯菌酯的氰基丙烯酸乙酯基团插入由216、217、375、418、420 位等氨基酸残基形成的肌球蛋白I 囊腔,阻止囊腔的收缩和舒张运动,使肌球蛋白失去马达功能[14]。因此,具有相同毒力基团的化合物往往具有相同的作用位点。
一般情况下,杀菌剂分子结构上必须同时具有毒力基团和辅助基团或成型基团。毒力基团是指杀菌剂分子结构上与作用的某种分子靶标发生亲和互作的部分,毒力基团与精细结构的受体分子互作的亲和性是杀菌剂毒力的决定性因素,往往具有质量性状的生物学性质。在细胞中杀菌剂分子与靶标蛋白分子之间的相互作用可以下列生物化学反应平衡式表示[20]。
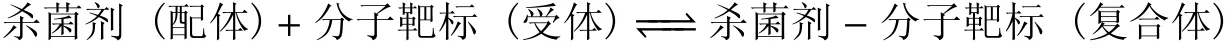
从该平衡式可以看出,配体与受体结合形成复合体的生物化学反应是可逆的,药/靶结合能越高,靶标分子单体就越少,药-靶复合体越多,能够维持生命功能的分子靶标蛋白越少,杀菌剂的毒力作用就越大,表现为杀菌剂作用的摩尔浓度就越低。
除了小分子化合物与受体蛋白的结合能以外,影响杀菌剂毒力的因素还有很多,如分子靶标蛋白及其药敏性位点的生物学功能的重要性及可补偿性、生物体对毒物的各种代谢与调控作用及药剂与靶标蛋白的结合方式[21]。一般情况下,药剂分子能够与靶标蛋白多个氨基酸形成共价键或装入“口袋”底部的结合力较高,也会表现较高的毒力。杀菌剂结合域附近氨基酸与杀菌剂分子伸出“口袋”部分的相互作用,也会影响杀菌剂的毒力[22]。
细胞内杀菌剂受体蛋白与杀菌剂互作的部位往往是该蛋白质的重要功能域。杀菌剂小分子只有与蛋白质三维结构的功能域结合,竞争性抑制靶标受体蛋白与细胞内其他配体 (蛋白) 互作或非竞争性结合破坏靶标蛋白的功能反应,才能发挥杀菌剂的毒力作用。有些杀菌剂靶标蛋白与杀菌剂互作的功能域附近还存在有其他功能域,或存在可以与小分子化合物发生化学键的结构,那么在这种情况下增加杀菌剂可以与该靶标结合的其他基团,也能够增加杀菌剂小分子与靶标蛋白的亲和力,在不影响杀菌剂分子在植物和菌体内移动的情况下,能够大幅度提高杀菌剂毒力作用并可能解决交互抗性问题。
针对杀菌剂的交互抗性问题,近年有些学者提出农药靶标组学的新概念。作者认为可以利用靶标组学的理论指导作用方式不同、抗性风险低的杀菌剂组合使用,但是创制能够与多个分子靶标结合的药物新分子还存在理论障碍,因为难以想象有限尺度的小分子化合物如何同时与几个大分子蛋白复合体、或分布在细胞内不同部位的几个蛋白分子相结合。
需要特别注意的是杀菌剂受体蛋白在细胞内往往并不是以单体的形式存在的,或者以单体存在的时间很短,多数情况下是以与其他蛋白或小分子物质形成复合体的稳定结构存在的,杀菌剂可能与靶标蛋白单体结合,阻止复合体形成,也可能与复合体中的靶标蛋白结合,干扰复合体功能或使复合体解聚[18]。因此,采用生命科学理论和分子生物学技术,探明重要生命功能蛋白在病原菌体内存在的形态,解析其三维结构,揭示功能性和药敏性结构的物理、化学特征,以及干扰靶标蛋白与细胞内其他分子互作的毒理学信号传导途径,对于杀菌剂新靶标发现、小分子化合物结构创新与优化及其靶向杀菌剂和靶向增效剂研发都具有十分重要的实用价值。
在过去很长时间内,由于人们无法揭示药靶蛋白在细胞内存在的真实形态和结构特征,以致难以成功研发基于分子靶标的特异性药物,尤其是丝状植物病原菌的药靶蛋白含量极低,且常常与其他蛋白组分形成复合体的形态存在于细胞中,无法直接提取和纯化,阻碍了农用杀菌剂靶标蛋白的结构解析。然而,生命科学和生物技术的快速发展,正在不断为杀菌剂靶标蛋白发现及其精细结构解析提供了必要手段,本研究团队最近突破植物病原真菌药靶蛋白体外表达、纯化和结晶的技术障碍,成功解析了小麦赤霉病菌和水稻稻瘟病菌的肌球蛋白I 药敏性结构,并针对靶标蛋白结构特征创制出具有开发潜力的广谱肌球蛋白抑制剂,为农用杀菌剂进入靶向发展新时代提供了理论与实践支持[14]。
一般情况下,具有相同毒力基团或者具有相同的作用位点的杀菌剂,常常归属一类,如多菌灵、苯菌灵、噻菌灵、涕必灵和硫菌灵等分子含有或经过生物转化形成苯并咪唑基团的杀菌剂都称为苯并咪唑类杀菌剂,作用于β-微管蛋白;
嗪胺灵、啶斑肟、氯苯嘧啶醇、三唑酮、咪鲜胺等含有哌嗪、吡啶、嘧啶、三唑、咪唑等含N 杂环毒力基团,并作用于细胞色素P450 加单氧酶(C14α-脱甲基酶) 的杀菌剂又都称为麦角甾醇生物合成脱甲基抑制剂。我们研究发现,有些植物病原菌在进化过程中可能形成了与杀菌剂作用靶标功能互补的同工蛋白质,以补偿环境胁迫对该蛋白功能的不利影响。这些同工蛋白质在结构上往往具有很高的同源性[23],尤其是在与杀菌剂互作位点的结构上十分相近,如小麦赤霉病菌等镰刀菌,具有可以与多菌灵相互作用的两个β-微管蛋白,并且在生命活动中发挥主要功能的β2-微管蛋白,在第240 位氨基酸由亮氨酸分化为苯丙氨酸,降低了与多菌灵的亲和力,以致小麦赤霉病菌等镰刀菌对多菌灵的敏感性较灰葡萄孢菌、核盘菌等降低了5 倍以上[24]。
随着对靶标蛋白药敏性结构的解析及与药物相互作用机制的研究深入,我们发现一种靶标蛋白并不局限于与某种毒力基团互作,该蛋白的其他药敏性功能域甚至同一个功能域可能会与不同结构的化学小分子互作。例如:已知多菌灵、乙霉威、戊菌隆及杀卵菌剂苯酰菌胺,尽管它们在化学结构上各不相同,但都能与微管蛋白互作,干扰细胞有丝分裂,表现不同的交互抗性模式。麦角甾醇生物合成过程中的14α-脱甲基酶的抑制剂包括有三唑、咪唑、嘧啶、吡啶和哌嗪类不同结构的毒力基团,△8→7 异构酶和△14-15 还原酶抑制剂也包括吗啉和哌啶不同结构的毒力基团。肌球蛋白I 除了具有与变构抑制剂互作的囊腔结构以外,还存在与肌球蛋白激活剂和肌球蛋白II 抑制剂的药敏性结构域 (图1)[14]。这些研究结果提示我们,在药物靶标蛋白非常有限的情况下,认识靶标蛋白具有与不同化学结构的小分子化合物存在互作的潜能,能够改变基于某种先导物 (含毒力基团) 合成衍生物创制新型杀菌剂的传统思路,开拓基于靶标结构开展不同结合位点、不同化学结构类型的杀菌剂创制新视野。
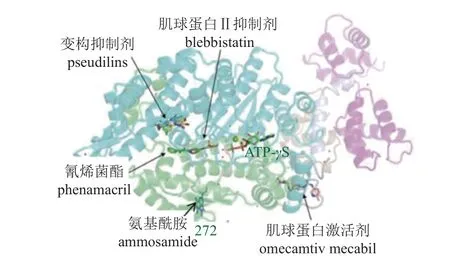
图1 肌球蛋白I 可与小分子化合物互作的结构域示意图Fig. 1 Diagram of myosin I domains for potentially sensitivity to small compounds
辅助基团是利于杀菌剂分子到达作用靶标并有助于增加毒力基团与受体亲和力的分子部分。辅助基团决定药剂到达作用靶标位点的途径、速度和数量,往往具有数量性状的生物学性质[25]。有些分子结构比较简单的杀菌剂,毒力基团也同时具有辅助基团的生物学性质。杀菌剂分子要到达作用靶标的部位需要通过菌体亲脂性的细胞壁和双分子层的生物膜,用于处理植物的杀菌剂还需要通过疏水性的叶面角质层、蜡质层或根部处理需要通过疏水性很强的内皮层凯氏带等障碍,这就需要杀菌剂分子具有较强的亲脂性和适当的亲水性。药剂的亲脂性和亲水性分配以脂/水系数logKow 值表示。Kow 是杀菌剂在辛醇中的溶解度与在水中的溶解度之比的对数值,故又称辛醇-水分配系数,简称分配系数。改变辅助基团可以改善杀菌剂分子的脂/水分配系数,通常在一定范围内增加杀菌剂分子的脂溶性有利于提高杀真菌剂的毒力。一般情况下,对卵菌表现高活性的杀菌剂,脂/水系数小于对子囊菌、半知菌和担子菌表现高活性的杀菌剂,因为卵菌的细胞壁主要成分是非极性相对较低的纤维素和半纤维素,而高等真菌的细胞壁主要组分是亲脂性极强的几丁质。药剂的脂水系数与其电离常数和所在介质中的二价阳离子和质子浓度,对于该药剂的内吸输导性能,包括在不同作物和不同生育期作物上的内吸输导性具有决定性作用,亲脂性过强,容易被作物的木质素吸附,不易在作物体内输导。因此,针对某种作用靶标进行亲和力强并具备适当脂水分配系数的杀菌剂分子设计与结构优化,是发现新型高效杀菌剂的重要策略。
1.3 杀菌剂毒力与受体分子功能的关系
病原菌细胞内的杀菌剂受体分子,一般对于生命体来说是不可或缺的功能蛋白质,否则杀菌剂难以表现高毒力活性。受体蛋白与杀菌剂互作的部位往往是该蛋白质的重要功能域,杀菌剂小分子只有与蛋白质三维结构的功能域结合,阻止或干扰靶标受体蛋白与细胞内其他配体 (蛋白或小分子物质) 互作的功能反应,或使其丧失功能才能发挥杀菌剂的毒力作用[26-27]。杀菌剂作用的受体蛋白质在生命活动中的功能及其重要性和可补偿性决定了杀菌剂的毒力潜能。
呼吸是生命的体征,生物体通过呼吸作用为其生命活动提供能量和为生长发育尤其是病原菌孢子萌发的芽管发育提供生物合成的基本原料[28]。因此,抑制呼吸作用的杀菌剂往往对孢子萌发具有较高的抑制活性并表现杀菌作用。呼吸作用包括糖酵解、三羧酸循环、呼吸电子传递链和氧化磷酸化等生物化学反应。糖酵解和三羧酸循环以生物合成生长发育必须的小分子原料为主,呼吸电子传递链和氧化磷酸化以生物合成ATP 储能物质为主。因此,抑制呼吸链和氧化磷酸化的杀菌剂往往具有比抑制糖酵解和三羧酸循环的杀菌剂具有更高的毒力活性。如抑制呼吸链复合物III 的细胞色素b 抑制剂类嘧菌酯、抑制呼吸链复合物II 琥珀酸脱氢酶抑制剂类氟唑菌酰羟胺、氧化磷酸化解偶联剂类氟啶胺等不仅抑制能量形成,而且还干扰靶标蛋白在生长发育中的功能,具有极高的杀菌和抑菌毒力活性[29-33]。糖降解催化酶抑制剂硫代氨基甲酸酯类的福美双、代森锰锌,邻苯二甲酰亚胺类的克菌丹等主要抑制糖代谢,干扰真菌孢子萌发所需的能量和物质供应,其杀菌剂毒力则显著低于呼吸链和氧化磷酸化解偶联剂[34-36]。井冈霉素虽然与海藻糖酶结合,阻止海藻糖转化为葡萄糖,但是细胞内糖酵解基质葡萄糖的来源广泛,以致井冈霉素不足以显著抑制糖酵解和菌体生长[37-38]。然而,我们发现井冈霉素能够阻止海藻糖酶与一些生物合成酶的互作,减少毒素和甾醇的生物合成,降低致病力,同时还能激活植物的抗病反应[38]。
核酸、蛋白质、氨基酸、脂质、葡聚糖等是生命有机体重要组成物质,与这些物质生物合成、代谢有关的酶蛋白往往是小分子化合物的作用靶标。基于这些物质的来源及合成代谢相关酶的重要性和可补偿性,抑制剂的毒力存在很大差异。如核酸生物合成抑制剂类甲霜灵、核酸代谢抑制剂类甲菌啶、蛋白质生物合成抑制剂类春雷霉素、氨基酸生物合成抑制剂类嘧霉胺、磷脂生物合成抑制剂类异稻瘟净、脂肪酸生物合成抑制剂类稻瘟灵、纤维素生物合成抑制剂类烯酰吗啉、几丁质生物合成抑制剂类多氧霉素等具有较高的杀菌剂毒力。
微管蛋白在细胞分裂、构建细胞骨架及真菌致病毒素生物合成中具有重要作用,因此微管蛋白抑制剂类如多菌灵,对很多植物病原真菌具有很高的毒力[39-40]。
目前已知对于真菌细胞发育具有激素信号功能和保持生物膜完整性及稳定性的甾类化合物中,C-14 脱甲基化比C-4 脱甲基化、△5,7-和C-24 甲基化的甾醇更为重要[41-44]。因此,在真菌麦角甾醇生物合成途径中,抑制14α-脱甲基酶的化合物如叶菌唑等毒力显著高于抑制C-4 脱甲基酶的环酰菌胺等和抑制△8→7-变构酶及△14-15 还原酶的苯锈啶等杀菌剂。
在甾类物质生物合成途径中,C-24 甲基化是真菌不同于动物和植物的特有生化反应,化学家们针对甲基供体S-腺苷甲硫氨酸研发了许多竞争性结合的化合物,试图抑制C-24 甲基化[43]。虽然有些化合物表现出了一定的杀菌剂毒力作用,但尚未发现其毒力活性能够满足市场应用要求的杀菌剂品种,说明甾醇C-24 甲基化的生命功能较弱。
已知氧化固醇结合蛋白 (OSBP) 抑制剂氟噻唑吡乙酮对卵菌具有特别高的毒力活性[45],因为氧化固醇结合蛋白相关蛋白 (ORPs) 在脂质代谢过程的脂质转运和信号传导中发挥重要功能[46]。进一步探明氧化固醇结合蛋白相关蛋白在不同真菌中的生命功能及其结构的特异性,对于创制特高效的选择性真菌氧化固醇结合蛋白抑制剂具有重要的基础理论价值。
黑色素不仅是生物抵御紫外线杀伤力的重要物质,而且在一些真菌中还能调控侵入结构的形成。因此,三环唑等黑色素生物合成抑制剂不仅在较低剂量下能够降低稻瘟病菌的抗逆生存力,而且抑制依赖黑色素保持渗透压的附着胞形成,阻止稻瘟病菌对水稻的侵染[47-49]。
马达蛋白在细胞器运动和营养物质运输等方面发挥着不可或缺的生命功能,已知氰烯菌酯能够插入肌球蛋白I 的囊腔,抑制蛋白ATP 水解释放能量形成的囊腔舒张/收缩驱动肌动蛋白运动,使蛋白失去马达作用,阻止真菌生长所需的营养物质运输[14,50-51]。肌球蛋白I 作为杀菌剂分子靶标的发现,激发了人们针对物质传输和细胞器运动的骨架马达蛋白和跨膜马达蛋白创制新型杀菌剂的热情。
1.4 杀菌剂毒力的选择性与靶标分子遗传分化的相互关系
杀菌剂分子结构与受体互作的特异性及受体蛋白质在不同物种中的遗传分化决定了杀菌剂毒力的选择性。药剂的受体分子尤其是与药剂互作的结构域,在不同物种中常常存在不同程度的遗传分化,且分化程度常常与生物的分类特征差异有关,以致一种杀菌剂对不同种类病原菌之间的毒力存在很大的差异,从而表现了选择性[52]。因此,在评价化合物或杀菌剂的毒力时,应该选用不同分类地位及多种不同类型的病原菌进行毒力测定。
病原菌对植物的侵染和危害性遗传基础,往往不同于其他高等生物,针对病原菌与生长发育无关而识别、侵染和危害寄主的关键功能蛋白设计的抑制性化合物,将表现极好的选择性和安全性。但是这些功能蛋白往往与病原菌的生长、发育无关,主要或只作用于寄主识别、建立寄生关系、抑制致死寄主的有毒物质合成或激发寄主防卫基因表达产生抗病性等,评价这些新概念杀菌剂的毒力就不能采用传统的生物测定方法,应该建立符合新概念杀菌剂作用方式的毒力测定方法,测定对接种寄主的保护作用或相应的生理生化反应,也可以测定对已知致病和致害的关键蛋白质或次生代谢物合成的抑制作用。因此,符合毒理学机制和生产实际的杀菌剂活性筛选技术创新是推进新概念杀菌剂发展的基础。
即使在同一种病原菌群体中,不同的个体也会因为药剂靶标或受体编码基因的单核苷酸或受体蛋白的单个氨基酸变化,或者与药物代谢或药物毒理学信号传导途径及有关调控因子的变异,而表现不同的药敏性[53]。如果生产上未经相同抗药性机制的杀菌剂应用的筛选,同一病原群体中的这种与药敏性有关的过敏性或抗药性自然变异概率是极低的,不过我们在研究杀菌剂毒力或创制杀菌剂活性筛选过程中,应该采用同一种病原菌的2~3 个不同来源的菌株进行毒力测定,以保证测定的菌株具有自然病原群体的代表性,防止采用单个菌株测定因可能的偶然变异而误判杀菌剂的毒力。如果测定的杀菌剂毒力具有很强的专化性或选择性,以及存在靶标药敏性调控机制,剂量反应曲线的斜率往往较小。剂量-效应变化速率较小意味着在病原群体中靶标分子的分化或变异度较高,因此,测定这类杀菌剂如双炔酰菌胺和氰烯菌酯等的毒力时,使用一株以上的菌株尤为重要。
当化合物的分子靶标在植物病原群体中分化很高,甚至存在同源不敏感或药敏性很低的分子靶标时,用特别敏感的菌株或敏感性较低的菌株评价化合物的毒力则没有实际意义。如在灰霉病菌群体中,甲氧基丙烯酸酯类杀菌剂分子靶标细胞色素b 基因存在第143 位密码子处有或没有内含子的两种基因型,前者对嘧菌酯等QoIs 杀菌剂特别敏感,后者常因143 位密码子变异而对嘧菌酯不敏感[54]。虽然室内测定嘧菌酯对灰霉病菌具有很高的毒力作用,但在生产上使用后不久,便会因形成细胞色素b 基因143 位密码子处没有内含子的抗药性群体而丧失防治效果。
研究发现,我国灰葡萄孢群体中杀菌剂分子靶标SDHB 的互作蛋白SDHC 存在多态性,已知在群体中占有1.92%的SDHCI79V、G85A、L151I分化型菌株对氟吡菌酰胺、啶酰菌胺和萎锈灵的敏感性比占63.46% 的野生型菌株分别高59 倍、10.4 倍和2.8 倍[55]。因此,在测定琥珀酸脱氢酶抑制剂的毒力时,测定菌株的遗传分化背景对测定结果具有重大影响,杀菌剂进入市场后,病原菌会在筛选压力下,迅速向敏感性低的基因型群体发展,花巨资研发的杀菌剂使用寿命则非常短暂。
1.5 杀菌剂的毒力作用
杀菌剂的毒力作用包括杀菌作用 (fungicidal action) 和抑/静菌作用 (fungistatic action)。前者是指病原菌不仅暴露于杀菌剂时停止了生命活动,而且在脱离药剂后也不能恢复生命活动,即杀菌剂对病原菌的毒力是一种不可逆的永久性作用。后者是指病原菌暴露在杀菌剂时虽然停止了生命活动,但脱离药剂后能够恢复生命活动,即杀菌剂对病原菌的毒力是一种可逆的暂时性作用。杀菌剂表现为杀菌作用还是抑菌作用,是由化合物本身结构及其性质决定的,并受杀菌剂处理的条件所影响。当具有杀菌作用的杀菌剂处理病原菌的剂量较低或暴露时间较短时,也可能表现为抑菌作用。同理,当具有抑菌作用的杀菌剂处理病原菌的剂量较高或暴露时间很长时,也会表现为杀菌作用。因此,杀菌剂的杀菌作用和抑菌作用在很多情况下是相对的,与处理药剂浓度、作用时间及处理条件尤其是温度密切相关[56-58]。例如一些含铜、汞等重金属的杀菌剂、二硫代氨基甲酸酯/盐类的福美双、代森锰锌、邻苯二甲酰亚胺类的克菌丹等杀菌剂,对病原菌的毒力作用主要表现为杀菌作用[59],但降低药剂处理浓度或缩短处理时间也可能会表现为抑菌作用。相反,大多数现代选择性杀菌剂如苯并咪唑类的多菌灵等、三唑类的戊唑醇等一般认为是抑菌作用,但如果提高处理浓度和延长处理时间,病原菌也会因生命必须物质的耗尽而死亡,从而表现为杀菌作用。现代选择性呼吸抑制剂如甲氧基丙烯酸酯类的嘧菌酯、吡唑醚菌酯等,琥珀酸脱氢酶抑制剂类如萎锈灵、氟唑菌酰羟胺等和氧化磷酸化解偶联剂如氟啶胺等,作用于呼吸链的杀菌剂既有杀菌作用也有抑菌作用,但他们多数的杀菌作用高于抑菌作用[60-62]。当然,也有一些具有抑菌作用的现代选择性杀菌剂,即使处理浓度提高100 倍以上也不表现杀菌作用,如氰烯菌酯对小麦赤霉病菌和腐霉利对番茄早疫病菌的抑菌作用。也有些杀菌剂因在不同剂量下的特殊作用机制,在提高处理剂量时还会降低毒力作用,如井冈霉素、福美双和咯菌腈等。
随着新概念抗菌化合物的发展,一些新型杀菌剂在细胞学水平上对病原菌既没有直接的杀菌作用,也没有直接的抑菌作用。但是他们可以通过影响寄主植物的代谢,使植物产生抗病性物质(植保素等),从而抑制或杀死病原菌,间接地对病原菌产生毒力,或者通过抑制病原菌产生植物毒素和效应蛋白,干扰病原菌与寄主的相互识别,从而达到防治植物病害的目标[63-65]。这类仅在寄主上才表现抗菌活性的杀菌剂又称为间接作用杀菌剂。目前对间接作用的杀菌剂毒力作用机制的认知还不够全面和深入。尽管发现一些小分子化合物,如井冈霉素、烯丙苯噻唑、水杨酸和茉莉酸甲酯等能够激发植物产生抗病反应[66-68],但是这种抗病反应往往是短暂的,只是在实验室条件下处理后准时接种才表现一定的抗病作用,因自然界的病原物侵染具有持续性,故在生产上防治植物病害的效果并不理想。事实上,我们最近研究发现,井冈霉素和茉莉酸甲酯等除了诱导寄主抗病反应以外,还能够抑制病原菌致病有毒物质的生物合成,从而降低某些病原菌的致病力[38,69]。常见的这类杀菌剂作用方式可能属于诱导寄主产生防御反应或抑制病原菌与寄主的相互识别和侵染过程。随着大量研究的深入,越来越多的证据表明,一些所谓的免疫激活剂很可能是通过干扰病原菌的致病因子或寄主的受体、或调节病原菌或寄主的信号传导系统、或调节基因沉默及激活的机制而发挥抗病作用的,也许并不具有严格意义上的免疫功能。
在个体和细胞水平上研究杀菌剂对病原菌的直接毒力作用,实际上是其对病原菌生命活动干扰的总体效应。大多数情况下,我们测量的杀菌剂毒力作用是其化学分子与靶标病原菌或寄主植物的受体分子相互作用的最终毒理学效应。导致这种最终毒力作用表型的生理化学过程十分复杂,是在一定时间内和环境条件下,杀菌剂分子与受体分子结合以后干扰受体分子与细胞内其他分子的互作和互作接力过程,及这种毒理学信号传递、扩散和细胞内产生各种调控作用平衡后的毒理学效应,是对病原菌各种生命活动破坏的综合结果。通常包括形态效应和生化效应。形态效应包括抑制孢子萌发、菌丝生长、附着胞和各种繁殖体的形成,及导致菌体畸形、细胞肿胀、原生质体液胞化、线粒体和内质网等细胞器甚至细胞壁和细胞膜的瓦解等等。生化效应包括呼吸强度和有关生物合成酶的活性下降,以致几丁质、蛋白质、脂类、核酸、激素、维生素和其他维持细胞结构和生命活动必需物质的生物合成量减少等等。杀菌剂剂量的形态效应和生化效应可以作为评价杀菌剂的毒力参数,至于哪种指标可以作为杀菌剂毒力测定的通用标准,不同的科学家有不同的观点,一般采用测定原理符合杀菌剂和病原菌的生物学特征、测定结果具有实际应用价值的毒力测定方法,最常见的是测定杀菌剂抑制病菌生长和孢子萌发的毒力参数[70]。基于毒力作用机制构建化合物抑制有关靶基因或蛋白表达和酶活水平等的毒力测定技术,可以对定向创制杀菌剂进行初步高通量筛选,但不宜作为评价杀菌剂的毒力指标。因为化合物在体外对分子靶标的抑制作用避免了细胞内可能存在的复杂调控作用,往往会过高评价化合物的毒力作用。
杀菌剂对病原菌的毒力作用和在植物上防治病害的效力,是化合物对病原菌和对病原菌与寄主及环境条件相互作用,分别干扰病原菌生长发育和病害发生发展的总体效应。实践上通常以对病原菌孢子萌发和菌体生长及对病害发生度的控制作用作为毒力效应的评价参数[71]。在植物上测定的这种杀菌剂毒力常称为药效,可以排除药物可能易受环境影响或对菌体生长发育没有毒力作用,导致离体测定结果与实际应用效果产生的偏差,植物上测定的杀菌剂毒力最接近该化合物在生产上应用的实际效果[71]。
因为不同的化合物对病原菌的毒力作用机制和作用方式不同,所以无法依据对某一指标的效应正确比较不同化合物的毒力大小。只有选择适合于某种化合物的效应指标,如对形态的总体效应,或生化总体效应,或防治病害的总体效力进行毒力测定,才能客观评价和比较不同化合物的毒力。在实践中测定抑制呼吸作用和抑制生物合成的杀菌剂混剂毒力,或测定其他不同作用方式的杀菌剂混剂毒力时,应该考虑采用不同的毒力测定方法进行综合评价,并分析可能的相互作用方式。如果以抑制生长或孢子萌发的一种效应评价生物合成抑制剂和呼吸抑制的相互作用,结果往往会过低评价由两种作用方式杀菌剂混用的毒力。直接作用和间接作用方式的杀菌剂混剂毒力测定,则应该在植物或植物器官上进行。
1.6 杀菌剂毒力的副作用
除了病原菌致病和致害特有的杀菌剂分子靶标外,与生长发育生命活动有关的杀菌剂分子靶标大多数也存在于其他微生物、植物和动物中,发挥相应的生命功能。在理论上,杀菌剂对病原菌发挥毒力作用的同时,也存在对其他生物毒性的潜在风险。
杀菌剂毒性大小取决于杀菌剂作用靶标的多寡和靶标药敏性结构域的分化程度及其分化特征。一般情况下,杀菌剂的作用靶标和作用位点越多、靶标与药物结合位点的结构保守性越高,杀菌剂的抗菌谱也越广,对其他生物的毒性风险也就越高。传统的多作用位点杀菌剂大多对动植物及其他微生物的毒性高,不具有选择性,一般用于植物体外,保护作物不受病原菌的侵染并获得对作物的安全性。
为了提高杀菌剂的安全性和防治植物病害的有效性,自20 世纪60 年代,人们开始基于单个作用靶标或作用位点在不同物种中的遗传分化,合成和筛选对病原菌分子靶标亲和力强、对动植物同源靶标亲和力弱、能够进入植物体内并传导的化合物,推动了单作用位点的、具有选择性内吸治疗作用的杀菌剂发展。
分子靶标在不同分类地位的物种中分化程度和药-靶互作的特异性,是决定杀菌剂抗菌谱和毒性风险的重要基础。已知多菌灵的作用靶标β-微管蛋白在动物、植物和真菌界之间存在着显著的分化,因此苯并咪唑类杀菌剂具有广谱抗真菌活性,而对动植物安全。肌球蛋白I 在不同物种中的分化程度高,尤其是药敏性囊腔结构的氨基酸在不同物种中存在明显分化,以致肌球蛋白变构抑制剂氰烯菌酯的抗菌谱比较窄,只对少数几种镰刀菌具有抗菌活性,对那些编码第216、217、375、418 和420 等残基的任一氨基酸分化的其他物种几乎都不存在毒副作用[14,53,72-73]。真菌麦角甾醇生物合成脱甲基酶Cyt.P450 与植物中的赤霉素脱甲基酶Cyt.P450 的药敏性结构相似性高[74],因此唑类等麦角甾醇生物合成脱甲基抑制剂 (DMIs)在防治植物病害的同时[41],也能够阻止植物体内的赤霉素 (GA3) 生物合成,打破赤霉素与脱落酸(ABA) 之间的激素水平平衡,导致植物矮化甚至僵化,双子叶植物及水稻等作物尤为敏感,如果在瓜果蔬菜上使用,常常会产生抑制生长的隐形药害,高温下使用常常会出现稻叶黄化和褐斑等药害现象,高或低温下在水稻抽穗前使用还存在抑制敏感水稻品种抽穗的严重药害。然而,DMIs 杀菌剂毒力的这种副作用也常常被用作植物生长调节剂,例如多效唑可用于水稻秧苗和小麦株高控制。DMIs 通过改变植物激素平衡还可以调控植物气孔关闭,增强植物的抗旱能力。琥珀酸脱氢酶B 亚基抑制剂拌种灵处理种子,对双子叶植物棉花的种子发芽和出苗具有很高的安全性,而对单子叶植物小麦的种子发芽和出苗则很容易产生药害。Cyt b 抑制剂如嘧菌酯对大多数作物非常安全,而对烟草和苹果的少数品种则具有强烈的药害副作用,用200~250 mg/kg 有效浓度喷施嘧菌酯,在云烟G80 和嘎啦苹果叶片上就会产生坏死枯斑;
对防治甜瓜也有药害的风险,导致果面产生斑块,降低了甜瓜的商品性[75]。嘧菌酯在高于规定剂量时对玉米和大豆也会产生药害,会使其地上部分的鲜重减少,生长速率减慢[76]。杀菌剂对不同植物的安全性差异可能与植物的同源杀菌剂分子靶标结构尤其是药-靶结合位点的相似性有关[23]。
任何生物为了保持物种的延续,在长期的生物进化过程中通过一定频率的基因变异和繁殖,获得了能够适应生存环境的遗传物质基础。一般来说,繁殖速率和繁殖系数高的微生物,药靶编码基因单一,而繁殖速率和繁殖系数相对很低的高等生物往往存在多个同源编码基因,使之在逆境条件下能够功能互补。同时,动植物功能蛋白或编码基因序列与微生物的相似性也较低,一般只有50%~70%,有的甚至更低。因此,这也可能是杀菌剂对高等生物的毒性较低的原因。目前生产上登记使用的选择性杀菌剂急性毒性除个别属于中毒以外,大多属于低毒和微毒。
尽管选择性杀菌剂抑制靶标蛋白的直接毒副作用较小,但是一些研究表明,杀菌剂通过结合靶标蛋白后,会钝化靶标蛋白与其他蛋白的互作生化反应,从而产生难以预料的毒副作用或生长促进作用。如多菌灵和QoI 类杀菌剂防治小麦赤霉病,药-靶互作能够导致乙酰辅酶A 积累,促进病原菌的脱氧雪腐镰刀菌烯醇(DON)毒素生物合成,增加谷物的毒素污染,威胁食品安全[77-78]。同时这些杀菌剂也能增加作物的生物合成,大幅度提高小麦的千粒重。氰烯菌酯、琥珀酸脱氢酶抑制剂类(SDHIs)和井冈霉素等杀菌剂用于小麦赤霉病防治,则能显著降低赤霉病菌的DON 毒素生物合成[37,69,79-81]。
2.1 杀菌剂毒力测定的方法
杀菌剂的用途决定了其毒力测定的基本方法是生物测定法。每年对数万甚至几十万个化合物进行杀菌或防病的活性测定代价非常高昂,这就要求杀菌剂毒力生物测定技术的实用化和简单化。在杀菌剂发展史上,人们研究了各种各样的生物测定技术来满足新的杀菌剂创制和研发需求。但随着人们对杀菌剂的安全性和有效性的要求越来越高,从化合物中筛选出杀菌剂的成功率越来越低,需要从事杀菌剂生物学研究的科技工作者研发更加简便实用、快速高通量的杀菌剂毒力测定技术,特别是满足新型作用方式的颠覆性靶向毒力测定新技术。
杀菌剂毒力测定的方法可以分成两种类型。一是离体毒力测定方法,即用药剂直接处理病原菌或病原菌在含药基质上培养,测定药剂对病原菌生长发育的影响。这种方法只考虑药剂与靶标病原菌的相互作用,排除了寄主植物和环境条件的影响,测定的药剂毒力体现了化合物对病原菌潜在的直接毒力作用。二是活体毒力测定方法,即将病原菌接种到药剂处理过的植物活体,如小苗、胚芽、叶片、叶碟、叶段、穗、花、果等,在适宜发病条件下培养,测定药剂对病害发生的抑制作用。这种方法考虑了药剂-病原物-寄主之间的相互作用,测定的杀菌剂毒力包含了对病原菌的间接作用。
活体测定方法不仅可以验证那些在离体条件下表现抗菌活性化合物是否具有潜在的抗病毒力,还是测定那些仅在活体上才能表现抗病活性的化合物毒力和测定对专性寄生菌的毒力来说是必不可少的。如测定三环唑或含有三环唑的组合物毒力时,就必须在药剂处理的感病水稻品种上接种,适当培养后以对病症的抑制作用表示其毒力。在含药培养基上测定的三环唑毒力并与其他作用方式的化合物毒力进行比较是不科学的。测定杀菌剂对专性寄生的卵菌毒力时,尽管可以基于杀菌剂的作用方式,在含药水溶液中测定化合物对卵菌孢子囊萌发的毒力,但是测定化合物对霜霉病菌、白粉病菌和锈菌等植物专性寄生菌的毒力,通常还是在植物活体上进行测定,
离体毒力测定又可以分为针对抑制孢子萌发和菌体生长的形态效应测定及针对相应分子靶标和生理生化指标的效应测定。孢子萌发法是杀菌剂离体毒力测定的经典方法,20 世纪50—60 年代以前,有许多文献研究了孢子萌发法测定和评价杀菌剂毒力的方法。随着现代选择性杀菌剂的诞生和病原菌抗药性问题的出现,杀菌剂的毒力测定及病原菌对杀菌剂的敏感性测定方法,更多地是基于对菌体生长所需物质的生物合成抑制而产生的菌体生长抑制效应,包括药剂对菌丝的线性生长、干重增加、细胞分裂指数 (浊度) 的抑制作用等。随着现代生物技术的快速发展,测定杀菌剂对靶标基因的表达水平、杀菌剂与分子靶标的亲和性,或杀菌剂对靶标生物学功能的抑制活性等,正在成为新型杀菌剂高通量筛选和毒力评价技术的研究热点。
在室内的离体毒力测定,能够在较小的空间内测定和比较多种药剂的毒力,测定条件容易控制,结果能够反映化合物本身的绝对毒力大小,重复性好和可比性强,所以常常被指定为大多数杀菌剂的毒力测定方法。活体毒力测定包括用药处理植物部分器官或组织后接种和处理盆栽小苗后接种对病害发生严重度的抑制效应。病害严重度的记载常常从无病至全部发病划分5~6 个相等间隔空间或梯度的病级。事实上,病害发生严重度的分级标准应该依据不同病害的经济危害性进行区别分级,如草莓等浆果一旦发病,则可能完全失去商业和食用价值。活体毒力测定引入了寄主植物及可能的环境影响因子,其结果的重复性取决于测试条件的控制,不同条件下测定的结果可比性差,但是测定的杀菌剂毒力更接近于应用的实际效果,应用价值较高。
杀菌剂毒力测定还常常依据药剂的作用机制或实际用途采用其他适当的测定方法。如用药剂处理病斑后培养一段时间,计数分生孢子的数量,测定其抗产孢的毒力;
或在密闭的空间里培养病原菌,让其接触药剂挥发性气体,测定药剂的熏蒸毒力;
还有收集杀菌剂处理过的植物上所产生的病原繁殖体,如孢子或菌核接种未处理植物测定其致病力;
或者处理过敏性植物后接种,测定免疫激活形成的过敏性坏死病斑等。
通常情况下,离体测定的杀菌剂毒力会远远高于活体测定的毒力,尤其是基于分子靶标的体外高通量毒力测定,因为其结果在不同程度上排除了病原菌、寄主植物和环境因子对化合物毒力的调控作用,并使作用方式不同的杀菌剂在离体和活体上测定的毒力差异相差很大。
经过上述毒力测定具有应用价值潜力的化合物,需要开展药效试验,即在温室控制条件下对盆栽植物处理后接种病原菌或者接种病原菌后施药,在适宜病害发生的条件下培养适当时间后评价防治植物病害的效果。温室药效试验还可以通过人为控制条件,测定环境因素对杀菌剂毒力的影响。温室药效试验评价具有应用价值的化合物,在进入应用之前还需进一步在不同生态环境条件下和常规农艺管理措施下,采用适当施药方法进行3~4 个不同剂量处理的大田小区药效试验,每个小区面积视作物长势的一致性一般为20~50 m2,每个处理剂量重复3~4 个小区。
2.2 杀菌剂毒力测定的意义
通过杀菌剂毒力测定,可以发现一种或一类化合物固有的杀菌或抗病的生物活性,可以在人为控制的条件下研究田间可能影响药剂毒力的因素,如光照、温度、雨水、酸碱度等。通过在植物器官、组织、小苗上的毒力测定,可以评价杀菌剂的保护和治疗作用及内吸、输导性能。通过杀菌剂的毒力测定还可以评价其在植物表面的沉积和持效性及其残留活性,预测和评估其在自然界的行为。通过测定杀菌剂对病原菌不同发育阶段或病害循环各个时期的毒力作用,可以指导防治病害的用药时间及施药技术研发等。
在室内筛选获得的有活性化合物不一定就可以开发为田间有效的杀菌剂,通过测定化合物在温室或田间作物上防治病害的毒力,可以分析其原因,指导化合物结构优化,获得良好的物理、化学性能和生物学性能。因为室内测定接种孢子悬浮液时,其中的水能够使病原菌和药剂直接接触,而自然界的一些真菌孢子通过气流传播到叶面,无须液态水即可萌发侵入,接触药剂的概率较低。因此,能够获得成功的杀菌剂,应该在植物表面具有良好的扩散性能,特别是可以通过挥发或渗透作用扩散,增加接触病原菌的概率。室内测定的杀菌剂毒力是药剂对病原菌的直接作用,而在自然界使用还受药剂的有效沉积、植物代谢、光解、雨水冲刷、微生物降解、有机质的吸附钝化等药剂与寄主-环境-病原互作的影响。因此,成功的杀菌剂应该具有理想的理化性能。通过受体分子与药剂的亲和性测定获得的高效杀菌剂,也不一定对病原菌的生长发育表现毒力。因为药剂处理病原菌需要通过细胞壁和细胞膜才能达到发挥毒力的场所,而且还可能在传导和扩散过程中与植物的木质素、生物体细胞中的脂质、蛋白质、酶等发生反应而被储存、钝化和降解。因此,成功的杀菌剂还应该具备良好的生物学性状。
2.3 杀菌剂毒力测定应该注意的问题
2.3.1 毒力作用表型 绝大多数杀菌剂的毒力作用表型不外乎质量效应和数量效应之一。质量效应如处理的真菌孢子萌发或不萌发,数量效应如处理的菌体生长快慢或酶促反应等生化指标的强弱。一般抑制能量合成的杀菌剂具有抑制孢子萌发的质量性状,孢子萌发较菌体生长需要更强的呼吸作用降解储存物质,提供芽管形成的能量和物质。通常情况下,呼吸抑制剂的毒力测定采用孢子萌发法。抑制生物合成的杀菌剂往往对孢子萌发没有抑制作用,但能够抑制芽管发育和菌丝生长,因此测定这类杀菌剂的毒力一般都是采用菌体生长法。
2.3.2 杀菌剂 用于毒力测定的杀菌剂或化合物应该采用尽量纯的样品,纯度最好达到95% 以上,以防止杂质对测试化合物毒力的影响。
2.3.3 培养基 培养基质也会影响杀菌剂毒力测定的结果。用孢子萌发法测定杀菌剂毒力时,一般需要对照的孢子萌发率能够达到95%以上,测定的结果才有较高的可靠性。配制孢子悬浮液或稀释药液时最好不要使用蒸馏水或去离子水,因为自来水中的矿质往往有助于孢子萌发。对于一些孢子萌发率较低的真菌,为了提高对照处理的孢子萌发率,确保试验结果的可靠性,常常在孢子悬浮液中加入1%的葡萄糖或橘子汁等营养物质。用生长速率法测定杀菌剂的毒力时还应该考虑药剂的作用方式,采用合适的培养基配方。如已知可酵解碳水化合物对QoI 类杀菌剂和井冈霉素的毒力有颉颃作用,所以常常采用甘油或淀粉作为碳源的人工合成培养基或水洋菜培养基。磷酸根离子对烷基亚磷酸盐类杀菌剂的毒力也有颉颃作用,所以应该采用不含磷酸根的合成培养基测定乙磷铝的毒力。一些电离度高的离子型杀菌剂和一些在酸碱条件下容易降解的杀菌剂毒力测定时还要考虑培养基的酸碱度和金属离子的存在,防止药剂转化成其他化合物而改变毒力[59]。如二硫氰基甲烷在碱性条件下易分解丧失活性,福美双在酸碱条件下易与铜离子形成2 : 1 的螯合物降低活性,噻唑锌在酸性条件下易降解成溶解度高的噻二唑提高离体毒力。
2.3.4 病原物 病原物群体中的遗传差异决定了不同个体对药剂的敏感性差异,病原群体对药剂表现相同效应的敏感性分布往往呈正态分布。正态分布曲线下面积反映了病原菌群体中在不同药剂剂量下产生相同效应的比例,说明群体中绝大多数个体的敏感性相似处于中等。只有少数比较敏感或耐药。当然,也可能存在频率极低的个别突变体而表现对药剂的抗性或超敏感,也可能因为与已用杀菌剂存在交互抗药性而对测定的药剂表现不敏感。因此,在测定杀菌剂毒力时应该选择有代表性的菌株作为试验材料,防止采用超敏感菌株或抗药性菌株,即毒力测定的菌株应该包含在野生型敏感群体一定变异的范围之内,最好是经过单细胞分离纯化和遗传稳定、表现中等敏感性的菌株。
菌龄可能增加或减少病原菌对药剂的敏感性。一般来说,生长旺盛和生长速率快的菌体对药剂比较敏感,例如在一周内连续测定酵母对克菌丹的敏感性,每天转接测定发现ED50值从周一至周四依次降低为0.35、0.29、0.27、0.25 μg/mg干重。因为,周一接种体中老化的母细胞群体比例最高,周四是最低的。
2.3.5 杀菌剂浓度 杀菌剂毒力测定时的处理剂量或浓度设置,理论上应该在其产生0~100%效应的范围内,但是,考虑到不同作用方式杀菌剂的剂量效应变化速率,最好在产生5%~95%的效应范围内设置至少5 个剂量。基于化合物毒力与剂量变化的效应关系,常按等差或倍量或对数的梯度设置处理剂量。
2.3.6 寄主植物 由于不同的植物材料对化合物的吸收、传导、代谢、感病性等存在差异,故用于杀菌剂毒力活体测定的植物或植物组织、器官应具有感病性及遗传和生长发育的一致性,并在相同的环境条件下进行测定。如活体测定乙磷铝对致病疫霉Phytophthora infestans的毒力时,在药剂处理的番茄植株上进行接种,能够测定到乙磷铝的抗病活性,而在马铃薯植株上测定则不表现抗病活性,因为前者能够水解乙磷铝,释放具有抗菌活性的亚磷酸根离子发挥作用,后者则没有这种化合物的代谢转化作用。
2.3.7 杀菌剂的溶解度 由于大多数有活性的杀菌剂是水难溶性化合物,而不溶解的杀菌剂一般不能发挥毒力作用。因此应该选择适当的溶剂将杀菌剂溶解,再与培养基质混合进行毒力测定。有的药剂在水中的溶解度极低,高剂量或高浓度的药剂溶液与培养基质混合后很可能析出形成不能发挥活性的结晶。这也是我们在测定杀菌剂毒力时常常发现病原群体敏感性分布曲线偏向药剂浓度较低一侧的主要原因。因为随着测定药剂浓度增加,不溶的药物比例增加。尽管随着菌体生长和培养基中溶解的药剂被吸收而促进结晶体或未溶解的药剂逐步溶解,但是其作用的剂量无法估计。因此,配制药液的溶剂及设置的毒力测定剂量范围会影响毒力测定的结果。一般选择溶解度高、具有极性而能与培养基质相容的有机溶剂配制药液,并尽可能多地加大溶剂用量。但是必须防止溶剂对测定病原菌产生过高毒力和对作物产生药害,并应设置溶剂处理作对照。蛋白质或多肽类杀菌剂只有以溶解的分子态才能发挥抗菌活性,在加工成制剂和配制过程中极易变性而失去毒力活性。
2.3.8 暴露时间 孢子萌发法测定杀菌剂毒力时,一般在适宜温度下培养至对照处理的真菌孢子萌发95%以上时测定抑制孢子萌发的毒力,暴露时间依真菌种类而异,一般需要暴露在化合物下2~10 h。菌丝生长抑制法测定杀菌剂毒力时,一般在适宜温度下培养菌落生长接近直径90 mm培养皿边缘时测定菌落生长抑制率,通常培养时间为1~7 d,对于那些生长缓慢的真菌需要延长培养时间时,需要考虑药物的持效期。抑菌圈法测定杀菌剂毒力时,还应根据病原菌的生长速度和杀菌剂在培养基中的扩展能力,在适宜温度培养之前需要在0~4 ℃下放置适当时间,让化合物在病原菌生长之前得到充分扩散。
在植物活体上测定杀菌剂的保护作用、治疗作用和传导性能时,应该根据实际情况考虑药剂施用位点至病原菌侵入位点的扩散行为。在药剂处理与病原菌接种位点一致的情况下,一般在药剂处理前24 h 或处理后24 h 接种,测定治疗作用和保护作用。当药剂处理位点与接种位点不一致时则需要考虑药剂的传导时间,大部分内吸性杀菌剂的输导方向是向顶性的质外体输导,在温室里对作物小苗根部处理,测定对地上部位的保护作用,一般需要在药剂处理24 h 后接种。杀菌剂向顶输导的速度与蒸腾作用及作物茎秆的木质化程度密切相关,在阴雨天气、植物置于密闭培养箱内 (蒸腾作用小)、作物较高大、茎基部木质化程度高、药剂脂水系数过大的情况下,应该适当延长药剂根部处理与地上接种的间隔时间。向基性输导的杀菌剂在共质体内传导的速度较慢,更加需要考虑接种病原菌的量及其病原菌侵染、扩展和发病的速度,防止药剂到达接种位点之前病原菌已经侵入危害。
2.4 杀菌剂毒力分析
2.4.1 剂量反应曲线 以剂量反应曲线评估杀菌剂毒力需要将原始的数据资料进行处理,得到线性曲线才能进行分析。对杀菌剂的剂量进行对数转换,消除曲线的“S”形态组分。Horsfall 称此为递减率规律 (the law of diminishing returns),即随着剂量增加,药剂对病原菌的效应越来越小[82]。因此,生物学效应的变化在数学上是随处理剂量的对数变化而变化的。当分级的效应数据与剂量对数作曲线,则形成S 形曲线。该曲线的中间部分可用来该曲线的线性表达。然而,以孢子萌发抑制率相对于剂量对数作出的S 曲线,其中间部分是非线性的[83]。这种S 曲线对于大多生物现象来说,是病原菌对药剂敏感性的频率正态分布变化。Bliss 将这种对称性的S 曲线定义为累加性正态分布[84]。就是说只有少数孢子对药剂特别敏感或抗性,大多数属于中等。因此,增加药剂剂量,对每个孢子的影响是一致的。某剂量抑制孢子萌发的百分率也代表着该剂量抑制某一个孢子的概率。Bliss 还发现,如果所有孢子对药剂的反应概率是呈正态分布的话,那么将这些数值作点,就完全可以作出直线。孢子萌发抑制率可以通过直接在对数-概率图纸上作点,获得病原菌反应的概率与药剂的剂量对数之间的直线相互关系。
2.4.2 毒力指数 从剂量反应曲线可以求出毒力指数。等量效应的杀菌剂剂量,如EC50或EC95,常用作表示杀菌剂的毒力参数。尽管杀菌剂的最低抑制浓度MIC 值 (杀死或抑制群体100%的最低浓度) 能够获得化学防治的理想效果,但是群体中个体的敏感性是不同的,总有一些是比较耐药的,实际上不可能杀死100%的病原物。随着对病原物的效应增加,杀菌剂的用量则是以对数级别增加。因此,应该根据病害或病原菌危害的经济阈值,确定可采用的、经济的毒力指数。
杀菌剂毒力可以用该化合物抑制菌体在一定时间内的形态效应或生化效应或病害防治效应的反应单位的浓度或剂量数值来表示。常用抑制50%的有效浓度数值 (EC50),或抑制90%的有效浓度数值 (EC90),或抑制100%的最低浓度 (MIC)表示,单位常用μg/mL 或mg/L。
从防治效果看,毒力指数EC95比EC50更有价值。但在条件可以控制的室内毒力测定中常用EC50作为毒力比较的参数,这不仅因为与EC95相比,以较少的工作量和较少的原药材料就可以得到EC50值,还因为在EC50处理剂量下,杀菌剂在培养基中的溶解度高,并基本都可以被菌体吸收而发挥作用,所以EC50具有更高的可信度。在杀菌剂活性低而处理浓度较高的情况下,杀菌剂在培养基中会有一部分处于不能发挥活性的非溶解态,特别是在比较活性差异很大以致设置的试验剂量水平不同情况下的杀菌剂毒力时,用EC95或MIC 值作为毒力参数可靠性更低。
为了满足人们对降低农药在自然界释放量的要求,活性更高的新型杀菌剂成为研发的目标。因此,评价新型杀菌剂的毒力应该计算相对毒力指数,与已有的标准杀菌剂或常用杀菌剂毒力进行比较。相对毒力指数 (T) =标准药剂毒力指数(B) /测定的药剂毒力指数 (A)。当T>1 时,说明测定的药剂活性高于现有的标准药剂,T<1 时,则说明测定的药剂毒力活性低于现有标准药剂。
2.4.3 斜率 剂量反应曲线的斜率是病原菌对相应药剂剂量变化的反应速率,同时也体现了药剂在剂量变化条件下的效价。更准确地说,在孢子萌发测定中斜率是每剂量对数单位的抑制概率。因此,斜率也是杀菌剂本身的固有特性,随药剂而异。斜率可以完善EC50值对药剂毒力的评价。在比较剂量反应曲线斜率差异很大的杀菌剂毒力时,应该考虑斜率对毒力指数的影响。
斜率的坡度受测定的真菌、试验条件和药剂的影响。一种真菌对不同药剂的效应斜率不同,不同真菌对同种药剂的效应斜率也可能存在差异。同种真菌对同一药剂的效应斜率也会因测定条件而异。幼孢子比老孢子对药剂的效应斜率高;
pH 及其他任何利于孢子萌发和生长的因子都有利于剂量反应曲线斜率增加。接种量一般对斜率没有影响。相反,改变最适宜的条件或增加孢子萌发和生长限制因子的强度,剂量反应曲线则会变得平坦。杀菌剂在田间的实际剂量反应曲线因环境因素的影响,往往要比实验室测定的剂量反应曲线平坦,剂量增加的效能递增率较小。在杀菌剂应用过程中,改善药剂在处理表面的覆盖率、气候及其他任何不利于病害发生的因子都能使田间处理的剂量反应曲线变得平坦。这就意味着改善施药技术和降低病害发生压力比在一定范围内提高杀菌剂的使用剂量所获得的效果更加明显。此外,缩短培养时间,剂量反应曲线的斜率也会变低。
斜率对杀菌剂毒力指数存在不同的影响。其影响程度取决于与毒力指数相关的等量反应水平。通过控制影响斜率的因子,药剂的剂量反应曲线斜率就趋于100%抑制率时的斜率范围。所以测定条件变化而引起的斜率改变,导致EC50值变化幅度远远大于EC95值的变化幅度。从理论上来说,MIC 值不受斜率的影响,所以测定的MIC值可重复性好。然而,在测定EC50时则必须精确控制测定条件,尽量减少对剂量反应曲线斜率的影响。
当一种药剂对某种病原菌不同个体的EC50值分布范围很大时,说明病原菌对剂量变化的反应速率相对较小。因此,在毒力测定过程中影响斜率变化的因子一般对该药剂毒力评价的影响较小。相反,当EC50值分布范围很小时,必须注意药剂毒力以外的影响因子的作用。
实际上,杀菌剂的剂量反应曲线斜率反映的是作用靶标的保守性,分子靶标的保守性或遗传同一性越高,斜率越大。相同的斜率说明病原菌与不同药剂发生互作的机制可能是相同的,在某种程度上斜率可以反映杀菌剂的作用机制。结构相关或相似的不同杀菌剂的剂量反应曲线斜率如果相同,可能是因为他们具有相同的毒力基团和作用靶标,并具有相同的作用机制,不同的斜率则可能具有不同的作用机制。然而,结构上差别很大的不同杀菌剂,他们的毒力因子可能完全不同,即使具有相同的斜率,也不能说明他们是否具有共同的作用机制。
2.4.4 剂量 评价农药的活性高低或毒力大小必须考虑剂量。因此,剂量是评价一种化合物或农药的关键因子。不考虑效应或防治效果与剂量相互关系的任何新农药研发都是不可信的。通过相同效应剂量的EC50值比较是发现新杀菌剂的基础。因为只有通过与已有杀菌剂的相同效应剂量比较,才能筛选出活性更高的化合物,推动杀菌剂的发展和科技进步。然而,不同杀菌剂的作用方式可能完全不同,甚至会发现全新作用方式的新型杀菌剂。因此,以何种效应参数评价和比较新的杀菌剂活性十分重要。如能量抑制剂往往以抑制孢子萌发的相同效应剂量进行比较,抑制病原菌生物合成的杀菌剂以抑制菌体生长的相同效应剂量进行比较,干扰病原菌的致病性或病原菌与寄主的早期识别、或诱导寄主抗病性等,往往根据抑制发病率或病害扩展的相同效应剂量进行比较。
一般来说,剂量取决于杀菌剂的使用浓度,通常以农药的使用浓度来表示剂量。早期研发的非内吸保护性杀菌剂,也有以受药表面单位面积的药量作为剂量的表达方法。以浓度表示剂量的方法,对于指导农业生产上的农药使用,如喷雾器里需要加入多少农药或每单位面积需要用多少药具有实际意义。在实验室研究中,对于分子质量未知的化合物,如一些抗菌素和生物源农药,以有效成分或活性物质的质量或处理浓度来表示相同效应的剂量,也可以说明化合物的生物活性。在实验室的杀菌剂活性精确研究中,则常常以单位接种体质量的EC50值表示杀菌剂的毒力。因为,过高的接种量会增加EC50值。
在研究结构与活性时,也常常以药剂的质量来表示剂量。因为各同系物的分子质量差异相对于真菌对不同化合物的反应来说,误差不大。但是,研究杀菌剂的作用机制时,以摩尔浓度表示剂量则比较准确。
一些作用于细胞内分子靶标的杀菌剂必须进入菌体细胞才能发挥毒力。在细胞内发挥毒力反应的剂量又称为吸收剂量或内剂量。吸收剂量在菌体细胞内往往会保持在一定的动态水平,但一般都能够达到或超过EC50剂量的水平,这也是认为EC50值作为毒力评价参数具有较高可信度的重要依据。
对于活体微生物农药来说,剂量 (活菌数) 同样与防治效果密切相关,但是其剂量在很大程度上受微生物的存活力、繁殖力和定殖能力的影响。因此,提高微生物的存活力 (货架期) 和改善使用后微生物的繁殖和定殖条件,对于确保微生物农药的效果十分重要。
杀菌剂毒力体现的是化合物分子与植物病原菌、寄主植物和环境条件相互作用、抑制病原菌生长发育或控制植物病害效力的生物学性质。因此,杀菌剂毒力大小不仅取决于化合物本身结构,还取决于该分子结构在植物体内外及不同环境条件下的稳定性和可能代谢转化的化合物生物学性质。杀菌剂对不同物种甚至不同个体的毒力与这些物种或个体的药物受体蛋白遗传分化以及对化合物的代谢转化水平有关,并因此而获得选择性。
杀菌剂毒力的生物学性质,决定了测量杀菌剂毒力的基本方法是生物测定法,并在进行杀菌剂毒力生物测定时,必须考虑化合物可以发挥毒力作用的有效剂量、病原菌和植物的遗传及试验条件的一致性。杀菌剂抑制病原菌生长发育的毒力测定可以在室内离体下进行,常用于抑制病原菌生长发育的化合物活性筛选。基于杀菌剂的用途,杀菌剂还应该在温室和不同生态环境的田间植物上进行防治植物病害效力的毒力测定。评价和比较杀菌剂的毒力时,不仅需要比较化合物的等效剂量或等剂量效应,而且还应该综合考虑改变化合物剂量的效应变化速率 (斜率) 以及毒力作用方式和可能引起的毒力副作用,确保杀菌剂发展的科技进步。
谨以此文庆贺中国农业大学农药学学科成立70周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

周明国,男,南京农业大学教授。1982 年毕业于南京农学院 (现南京农业大学)并留校工作,1999年获中国农业大学博士学位。主要从事杀菌剂生物学和农作物病害防控理论与技术研究。现任国际植物病理学会病害控制委员会组委、中国农药发展与应用协会杀菌剂专业委员会主任委员及《农药学学报》编委。1990 年和1993 年分别入选欧盟为中国培养100 名博士后和25 名跟踪培养人才计划,1998 年享受国务院特殊津贴。先后主持完成欧盟、U N I D O、ICGEB 政府性及先正达、巴斯夫农药企业的重大国际合作项目和国家973 课题、863 和948 项目、行业专项、国家自然科学基金重点及面上项目及省部级科技项目近30 项。获国家科技进步二等奖3 项(第1 完成人2 项,第3 完成人1 项),光华工程科技奖、江苏省专利发明人奖、中国农药工业协会农药创新奖突出贡献奖等。发表研究论文400 余篇,获国家发明专利45 件,国际专利7 件。
猜你喜欢 靶标毒力杀菌剂 纳米载体可缓解农药对靶标作物的负作用今日农业(2022年4期)2022-11-1611种杀虫剂对透明疏广蜡蝉3龄若虫的毒力测定天津农业科学(2022年5期)2022-05-31高毒力肺炎克雷伯菌研究进展检验医学(2021年11期)2021-11-29木霉和杀菌剂联用对橡胶榕白绢病菌的抑制作用湖南农业大学学报(自然科学版)(2021年3期)2021-07-02“百灵”一号超音速大机动靶标军民两用技术与产品(2021年10期)2021-03-161-MCP复合杀菌剂处理对“金红宝”甜瓜常温贮藏品质的影响保鲜与加工(2021年1期)2021-02-06副猪嗜血杆菌河南分离株的优势血清型和毒力基因研究养猪(2020年6期)2021-01-27食源性单增李斯特菌毒力岛基因检测与致病性江苏农业科学(2019年14期)2019-09-23药物靶标作用关系预测结果评价及查询验证计算机研究与发展(2019年9期)2019-09-16靶标评改,让习作评改有序更有效师道·教研(2019年7期)2019-08-13推荐访问:杀菌剂 测定 生物