不同浓度GA3对切花郁金香“道琼斯”保鲜效果的影响
来源:优秀文章 发布时间:2022-12-08 点击:
盛璐,张茜茹,杨茜茜,王诗娴,蔡磊
(滁州学院 土木与建筑工程学院,安徽 滁州 239000)
近年来,我国花卉产业快速发展,鲜切花种植面积增长迅速,占全国花卉总面积的4.85 %。如今得益于互联网和物流行业的蓬勃发展,鲜切花可以销售于全国各个范围乃至世界各地,受到了大家的强烈喜爱[1,2]。郁金香(TulipagesnerianaL.)作为十大切花之一,需求量逐年也因此大幅增加。在国内,郁金香种植区域主要集中分布在辽宁省凌源及其周边地区,其种植量超过全国80 %,在华东等地区有少量种植。由于鲜切花种植产地和销售地大多分开,存在比较严重的损耗问题,流通与运输过程中,鲜切花的瓶插寿命因不同因素缩短,平均每天减少5%~10%。郁金香瓶插寿命相对较短,平均4~5 d[3]。
目前对于郁金香切花的物理保鲜方法主要以冷藏保鲜为主,0~1 ℃下可湿藏6~7 d,干藏4 d,9 ℃下可湿藏4 d,干藏1 d[3]。化学保鲜主要以保鲜剂为主[4]。FU Khan等的研究表明,4 %蔗糖+200 ppm硫酸铝瓶插液可延长郁金香切花“Apeldoorn”瓶插寿命4 d[5]。Wawrzyńczak A 等的试验证明,在经过脉冲液 2 mmol Ca(NO3)2+ 0.1 mmol GA3+ 10 mg/L乙烯利或2 mmol Ca(NO3)2+ 0.1 mmol BA + 10 mg/L乙烯利处理24 h后,郁金香切花品种“Fantasy”和“Aladdin”可以显著被延长瓶插寿命和干储寿命[6]。Pisulewski T R等的试验中,使用配方为100 mg/L 8-HQC + 20 g/L蔗糖+ 20 mg/L GA3+ 25 mg/L 乙烯利的瓶插液,50 mg/L GA3+200 mg/L 8-HQC + 50 g/L蔗糖 + 50 mg/L乙烯利的脉冲液,均可以有效延长郁金香切花品种“Christmas Surprise”“Red Matador”“All Bright”和“Polka”等的瓶插寿命[2]。李宁毅[7]等人的研究表明,不同浓度的S3307能一定程度抑制细菌的产生,增加开花直径和开放时间,降低MDA含量和细胞膜相对透性,延长瓶插寿命。FC Gómez Merino等利用La、LaCl3和La(NO3)3× 6H2O对郁金香切花进行保鲜研究,发现一定程度延缓了郁金香切花的衰老,提高了采后质量[8]。
有关GA3作为保鲜剂的报道较少,而将GA3应用于郁金香切花保鲜的报道更为少见。本研究选取切花郁金香较受欢迎的品种“道琼斯”为实验材料,在加入营养物质蔗糖[9]、杀菌剂8-HQ溶液的基础上[10],添加不同浓度的GA3溶液,对郁金香鲜切花进行预处理,记录和分析鲜重变化率、瓶插寿命、花苞高度、细胞膜通透性和瓶插寿命等生理及形态指标,探讨不同浓度GA3对切花郁金香“道琼斯”保鲜效果的影响,为郁金香切花的保鲜提供一定参考。
1.1 试验材料
试验材料购自于滁州市花卉市场,郁金香系道琼斯品种。选择花苞未开放、发育程度一致、大小相似的单苞健康花卉。注意运输途中保护花卉不受损坏。
1.2 试验方法
在室内温度16 ℃条件下,蒸馏水为对照组(CK1),4种添加不同浓度GA3预处理液为处理组,预处理液配方如表1[11]。试验开始前将花卉插入蒸馏水中2 h,对其基部进行倾斜45°修剪,再将花卉插入瓶中进行复水24 h。5组预处理液分别培养郁金香15 h,将预处理后的5组进行瓶插,瓶插液为500 ml蒸馏水,放入人工培养箱(温度25 ℃,湿度60 %,照度60 %)进行观测[12]。郁金香插入瓶中后每隔一天需要更换一次瓶插液。
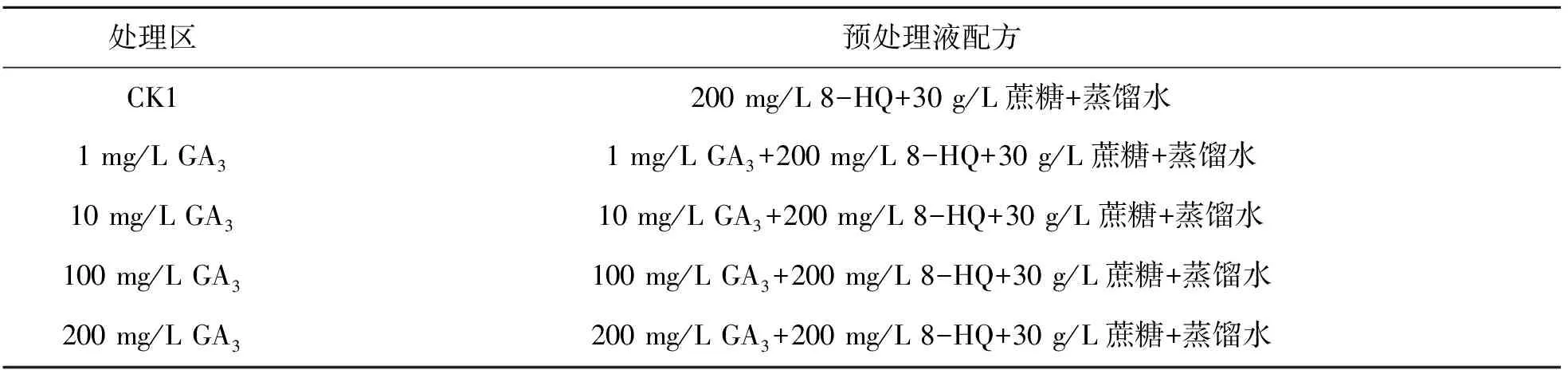
表1 不同浓度的GA3预处理液配方
自瓶插第二天开始,每日同一时间(上午十点)测定花卉鲜重、花瓣花径、花苞高度、叶绿素含量、花和叶的细胞膜通透性。测定鲜重转化率、花瓣花径和花苞高度等形态指标时,从每组处理中取4个样本,进行4次重复。叶绿素含量测定各处理区每次取1枚叶片,每天3次重复[13]。
1.3 测定指标
1.3.1 切花鲜重变化率与瓶插寿命 鲜重变化率=[(瓶插期切花鲜重—初始切花鲜重)/初始切花鲜重]×100%[14];
每天同一时间称量(上午10点),每次分别从对照区、1 mg/L GA3处理区、10 mg/L GA3处理区、100 mg/L GA3、200 mg/L GA3五个处理区中各取4支以作标记的切花样本(第一次从各个处理区中随机选取4枝,用标签标记,以备以后称重),用电子天平称重,取4支切花的鲜重平均值为当天的切花鲜重。
瓶插寿命以天(d)为单位,从切花插入瓶子开始进行第一次称重,为初始切花鲜重,而后每天进行鲜重测量,直到郁金香切花无观赏价值停止。无观赏价值的切花表现:花瓣严重失水、叶片花瓣膜质化或发生褐变、花瓣脱落[15]。
1.3.2 切花花径 用游标卡尺测量切花直径:展开花苞花瓣间的最长距离。
1.3.3 切花花与叶细胞膜透性 采用相对电导法[16]检测。取花瓣及叶片各0.3 g(3个重复),分别放入广口烧瓶中,并加入20 ml超纯水加以浸泡,然后用保鲜膜封住广口烧瓶瓶口,充分晃匀,放置24 h。待到24 h后,用电导率仪分别测定每个广口烧瓶中样本的数值,并记录数据作为煮前数值;
然后用恒温100 ℃水煮20 min,冷却4 h后再次用电导率仪测定每个广口烧瓶中样本的煮后数值。最后计算出每份样的电导率值:电导率=(煮前数值/煮后数值)×100 %。计算三个重复的平均值,作为当次样本的电导率值,以提高实验精确度。
1.3.4 切花花与叶的叶绿素含量 使用SPAD-502Plus叶绿素仪测定[17]。
1.3.5 实验数据处理 采用EXCEL,DPS等软件处理数据结果[18]。
2.1 不同浓度GA3对郁金香切花瓶插寿命的影响
实验结果表明,与CK1对照组相比,不同浓度的GA3处理组均延长了瓶插寿命,通过添加10mg/L GA3浓度的预处理组的瓶插寿命可延长至9.5 d,比CK1对照组延长了2.75 d。瓶插寿命相较CK1增长了40.74%。100mg/L GA3浓度的预处理组的瓶插寿命可延长至9.0 d,比CK1对照组延长了2.25 d。瓶插寿命相较CK1增长了33.33%。1 mg/L GA3和200 mg/L GA3瓶插寿命为8.0 d,比CK1对照组延长了1.25 d。瓶插寿命相较CK1增长了18.52%。不同浓度的GA3处理均延长了瓶插寿命,减缓了衰老。其中10 mg/L GA3处理效果最佳。
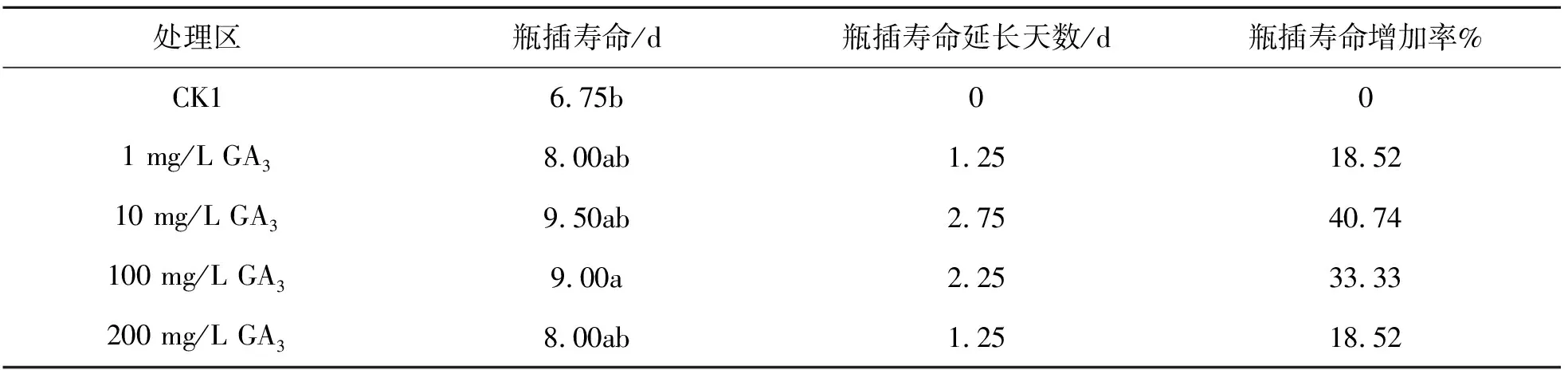
表1 不同浓度的GA3对郁金香切花瓶插寿命的影响
2.2 不同浓度GA3对郁金香切花鲜重变化率的影响
由图1所示可以得出,五组处理区的郁金香鲜切花鲜重变化率都有下降和上升期。1 mg/LGA3处理组鲜重变化率呈向上抛物线趋势上升,终止鲜重变化率高于起始鲜重变化率。10mg/L GA3处理组终止鲜重变化率与起始鲜重变化率相持平。100 mg/L GA3、200 mg/L GA3与CK1鲜重变化率基本呈向下抛物线趋势下降。1 mg/L GA3和10 mg/L GA3处理组鲜重变化率与CK1差异最为显著。瓶插第4 d后,GA3预处理后的处理组鲜重变化率均显著高于未处理CK1组,低浓度GA3对切花后期鲜重的下降具有显著的延缓作用,10 mg/L GA3效果最明显。不同处理的鲜重变化率最大值和出现负值的时间也不相同,这在一定程度上反映了不同处理对切花的鲜重保鲜效果不同。
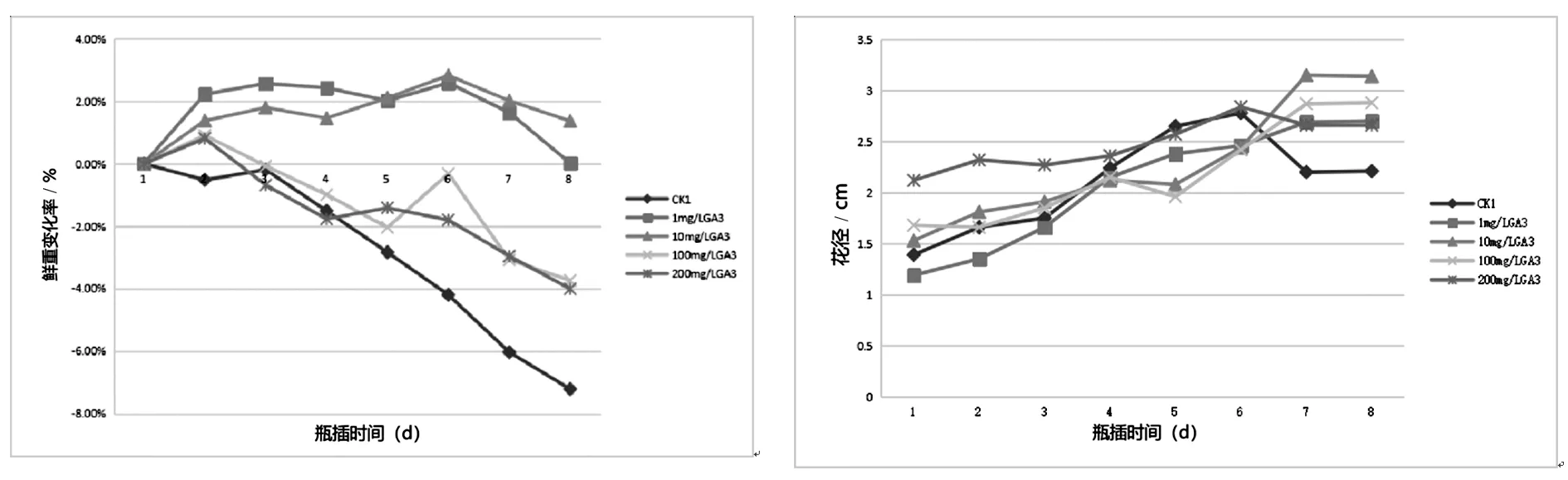
图1 不同浓度GA3对郁金香切花鲜重变化率 图2 不同浓度GA3对郁金香切花花径的影响
2.3 不同浓度GA3对郁金香切花花径的影响
如图2所示表明,各处理区花径的变化呈上升趋势。其中10 mg/L GA3、100 mg/L GA3和200 mg/L GA33组处理区最大花瓣间距大于蒸馏水对照组,10 mg/L GA3处理效果最好,最大花径达3.14 cm,比蒸馏水对照组增加0.93 cm。1 mg/L GA3处理组花径间距小于蒸馏水对照组,效果不明显。结果表明10 mg/L GA3、100 mg/L GA3和200 mg/L GA33组处理促进了郁金香切花花苞的开放程度,10 mg/L GA3处理对花苞开放程度影响最显著。
2.4 不同浓度GA3对郁金香切花花苞高度的影响
各处理花苞高度的变化趋势基本一致(图3),呈现出稳步上升趋势。四组GA3处理区花苞高度均高于蒸馏水对照组,10 mg/L GA3、100 mg/L GA3与200 mg/L GA3处理组对于郁金香切花花苞高度增长效果较显著,其中10 mg/L GA3效果最明显,增长了1.6 cm。100 mg/L GA3与200 mg/L GA3增长了1.4 cm。综上表明,不同赤霉素处理均增长了郁金香鲜切花花苞高度,且10 mg/L GA3效果最明显。
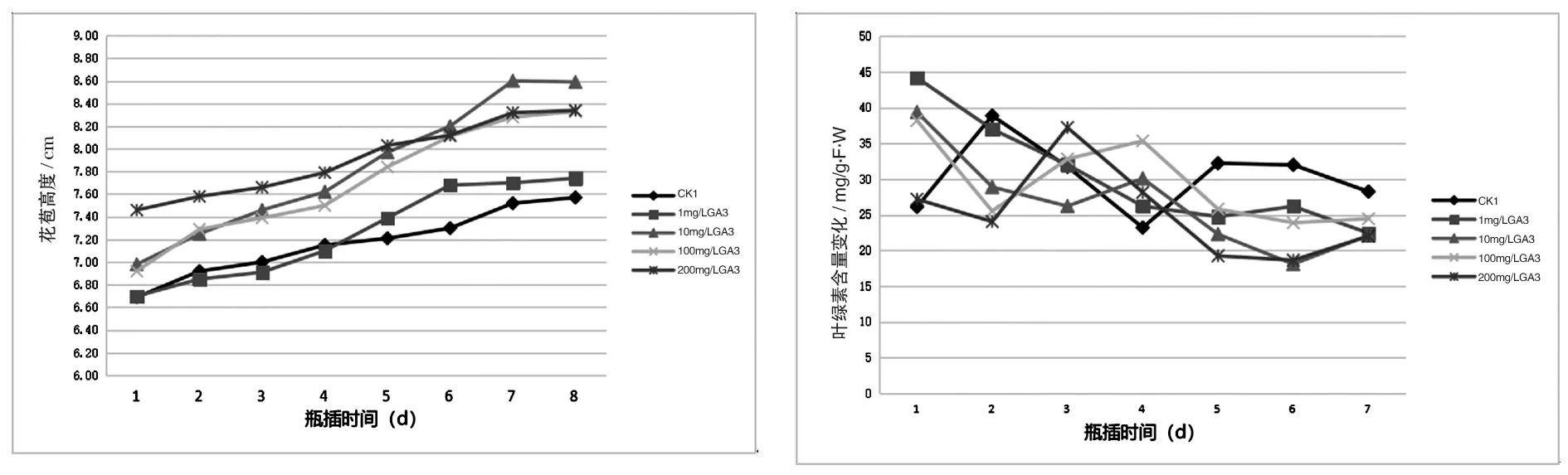
图3 不同浓度GA3对郁金香切花花苞高度的影响 图4 不同浓度GA3对郁金香切花叶绿素的影响
2.5 不同浓度GA3对郁金香切花叶绿素的影响
叶绿素降低是植物叶片衰老的基本特征,如图4所示,处理组切花瓶插时间越长,叶绿素的含量越低,呈下降的趋势。4组GA3处理组终止叶绿素含量均低于初始叶绿素含量,但在CK1对照组中最后叶绿素含量高于第一次叶绿素含量。200 mg/L GA3处理组叶绿素含量终止值与初始值相差较小,1 mg/L GA3、100 mg/L GA3和10 mg/L GA3处理叶绿色含量终止值和初始值相差较大。高浓度的赤霉素处理比中低浓度赤霉素处理缓解郁金香切花衰老效果更显著。不同的处理区下降的程度不同,200 mg/L GA3处理组对于郁金香鲜切花叶绿素含量下降减缓效果最显著。
2.6 不同浓度GA3对郁金香切花叶的细胞膜通透性的影响
当鲜切花衰老时,细胞膜的结构和功能会发生一系列变化。花瓣和叶片中膜的流动性一般在老化过程中会降低,并且膜开始从液晶相变为凝胶相,导致老化组织中的物质泄漏,最终导致花瓣和叶片萎蔫[19]。
图5表明,蒸馏水对照组叶的细胞膜通透性随瓶插时间呈波动性上升。在瓶插时间第3 天时,1 mg/L GA3处理组郁金香鲜切花叶的细胞膜通透性达到5组处理组最大值70%,且增高速率最快。10 mg/L GA3处理组切花叶的细胞膜通透性第7天低于第1天,100 mg/L GA3处理组切花叶的细胞膜通透性第7天基本等于第1天,其余3组处理组切花叶的细胞膜通透性第7天均大于第1天。10 mg/L、100 mg/L浓度的GA3预处理对郁金香切花叶的细胞膜通透性的升高有一定的抑制作用,10 mg/LGA3处理组抑制作用最显著。高浓度200 mg/L及低浓度1 mg/L GA3处理对于郁金香鲜切花叶的细胞膜通透性的升高具有促进作用。

图5 不同浓度GA3对郁金香切花叶的细胞膜通透性的影响 图6 不同浓度的GA3对郁金香切花的细胞膜通透性的影响
2.7 不同浓度GA3对郁金香切花的细胞膜通透性的影响
由图6所示,CK1对照组花的细胞膜通透性随瓶插时间延长波动最剧烈,在第三天达到最大值120 %,并且有所上升;
除清水对照组外,其它四组处理区切花花的细胞膜通透性随瓶插时间变化相对稳定,没有较大波动,并且有所下降,花的细胞膜通透性终止值均低于初始值。与CK1相对照,4组赤霉素处理组对郁金香切花花的细胞膜通透性的升高有明显的抑制作用,使花的细胞膜通透性变化相对稳定,有效地保持了细胞膜的稳定性。
本实验中,与蒸馏水对照组相比,对于鲜重转化率,四组赤霉素预处理液均对切花鲜重有促进作用,且中低浓度的赤霉素处理会对切花的鲜重有着显著的提升效果;
对于郁金香鲜切花花瓣间距,4组赤霉素处理均增加了花苞开放的直径,但增长较为缓慢;
在花苞高度上,中低浓度的赤霉素处理对于郁金香花苞高度增长效果较好,200 mg/L GA3处理效果一般;
在叶绿素含量上,高浓度的赤霉素处理郁金香切花比低浓度赤霉素处理效果明显,能够有效减缓郁金香鲜切花的叶绿素含量的降低;
在叶的细胞膜通透性上,10 mg/L和100 mg/L赤霉素处理对郁金香切花叶的细胞膜通透性的升高抑制作用显著,高浓度200 mg/L及1 mg/L赤霉素处理细胞膜通透性的升高有促进作用;
在花的细胞膜通透性上,赤霉素处理抑制了郁金香鲜切花花的细胞膜通透性的升高,使其变化相对稳定,有效地保持了细胞膜的稳定性。综上所述,得出结论:经过GA3预处理液处理延长郁金香“道琼斯”鲜切花的瓶插寿命、提升切花的鲜重、增长花苞高度、抑制了郁金香鲜切花叶和花的细胞膜通透性的升高,对于其保鲜效果起到促进作用,且中浓度的赤霉素预处理液促进保鲜效果最为显著。10 mg/L的GA3处理可以明显促进郁金香鲜切花的保鲜效果,改善切花的瓶插质量。但本实验对于赤霉素预处理液浓度的选取存在局限性,还有待于继续进行更加细致严谨的研究。