瑞香素通过含半胱氨酸的天冬氨酸蛋白水解酶通路对胶原诱导性关节炎大鼠成纤维样滑膜细胞增殖与凋亡的影响
来源:优秀文章 发布时间:2022-12-08 点击:
郑茂,邹玉,王洁莹,况南珍,傅颖媛
作者单位:1德阳市人民医院检验科,四川 德阳 618000;
2南昌大学基础医学院,江西 南昌 330006;
3海南医学院第二附属医院检验科,海南 海口 570100
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的全身性自身免疫性疾病,主要病理特征是骨与软骨组织受损,继而造成关节破坏[1]。RA病程长、预后差、致残性大,且病情进行性加重,一直以来是临床研究关注的重点。然而,RA确切的发病机制仍未完全阐明,目前的研究观点主要认为与滑膜细胞异常增生密切相关[2]。成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)是RA滑膜内膜衬里的主要填充细胞,在滑膜衬里层处于极度活跃的状态,呈肿瘤样增殖,在RA病人滑膜病变及关节损伤中起着关键作用[3]。因此,抑制FLS增生对控制RA发病及病情进展具有重要意义。
瑞香素(daphnetin,DAP),化学名7,8-二羟基香豆素,是金边瑞香、长白瑞香等瑞香属植物的主要活性成分,为我国自主研发的天然药物。文献报道显示,DAP具有抗炎、抗氧化、抗肿瘤、免疫调节等多种药理作用[4]。本课题组前期研究从金边瑞香中分离提纯出DAP,并发现DAP可抑制胶原诱导性关节炎大鼠(collagen-induced arthritis,CIA,一种类风湿关节炎常用的动物模型)的关节炎症,改善关节病变,提高Foxp3+Treg细胞水平,使Th17/Treg趋于平衡[5-7]。体外实验还发现DAP能促使CIA大鼠成纤维样滑膜细胞(fibroblast-like synoviocytes in collagen-induced arthritic rats,CIA-FLS)的促凋亡基因DR3、PDCD5、FasL、p53去甲基化,以及降低Bcl-2、STAT3基因的表达,使其出现凋亡现象[8-9]。然而,DAP诱导CIA-FLS凋亡的信号途径尚不清楚。为此,本研究自2018年3―9月利用DAP结合不同特异性含半胱氨酸的胱天蛋白酶(cysteinyl aspartate specific proteinase,caspase)抑 制 剂,观 察DAP对CIA-FLS增殖与凋亡的影响,旨在初步探讨DAP诱导CIA-FLS凋亡的可能机制途径,为DAP用于临床治疗RA提供实验依据。
1.1 细胞系CIA-FLS购于上海研生实业有限公司,许可证号J2900117872001。细胞采用含10%胎牛血清的双抗DMEM培养液,置于37℃、5%二氧化碳饱和湿度的培养箱内培养,CIA-FLS为贴壁生长。
1.2 药物DAP化学式C9H6O4,纯度≥98%,购于北京索莱宝生物科技有限公司。将20 mg DAP溶于1 mL二甲基亚砜(DMSO)配成20 g/L贮存液,使用时以培养液稀释至目标浓度。
1.3 试剂caspase-3抑制剂(Casp3-In,美国Selleck公司),caspase-8抑制剂(Casp8-In,美国Santa Cruz公司),caspase-9抑制剂(Casp9-In,美国Santa Cruz公司),泛caspase抑制剂(Pancasp-In,美国Selleck公司),人胆囊收缩素/缩胆囊素八肽(CCK-8)细胞增殖及细胞毒性检测试剂盒(上海贝博生物公司),Hoechst 33258染液(上海贝博生物公司),AnnexinVFITC/PI细胞凋亡双染试剂盒(美国BD公司),离心柱型总RNA提取试剂盒(北京天根科技公司),PCR逆转录试剂盒(日本TOYOBO公司),Real-time PCR试剂盒(日本TOYOBO公司),PCR引物(北京华大基因公司),含链霉素青霉素的DMEM培养液(北京索莱宝生物公司),胎牛血清(天津灏洋生物公司),AccutaseTM细胞分离溶液(美国eBioscience公司)。
1.4 仪器二氧化碳细胞培养箱(美国Thermo Scientific公司),超净工作台(上海博迅公司),水平摇床(海门其林贝尔公司),倒置荧光显微镜(日本OLYMPUS公司),多功能酶标仪(美国Molecular Devices公司),流式细胞仪(美国BD公司),PCR热循环仪(美国Thermo Scientific公司),Real-time PCR仪(美国Applied Biosystems公司)。
2.1 CCK-8检 测DAP对CIA-FLS增 殖 的 影 响取生长良好的对数期CIA-FLS,加入AccutaseTM细胞分离液消化,低速离心收集细胞,再加入培养液重悬后计数细胞浓度,将细胞接种于96孔板(每孔约8×103个细胞)。培养12 h后,加入不同浓度DAP(终浓度分别为0、5、10、20、40、80 mg/L),每个浓度设3个平行孔,对照孔(含细胞)和空白孔(不含细胞)加入等体积培养液。培养48 h后,每孔加入CCK-8溶液10 μL,轻轻混匀,并放回培养箱继续培养1 h再取出,在酶标仪上测定各孔450 nm处的吸光度(OD)。CIA-FLS细胞活力(%)=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100%。
2.2 Real-time PCR检 测DAP对CIA-FLS中caspase基因的影响取CIA-FLS接种于24孔板(每孔约5×104个细胞),培养12 h后,加入DAP(终浓度为40 mg/L)处理48 h,并设细胞对照孔。培养结束后提取CIA-FLS的总RNA,并进行逆转录反应(逆转录反应体系:11 μL RNase-free Water,4 μL RT Buffer,1 μL RT Enzyme Mix,1 μL Primer Mix,3 μL Total RNA)。将逆转录好的cDNA继续进行实时荧光定量PCR扩增反应(扩增反应体系:6.4 μL RNase-free Water,10 μL Master Mix,0.8 μL Forward primer,0.8 μL Reverse primer,2 μL cDNA)。每个基因设3个平行管,采用公式2-ΔΔCt计算目标基因caspase-3、caspase-8、caspase-9 mRNA相对表达量。
2.3 caspase抑制剂不同条件预处理后,CCK-8检测DAP对CIA-FLS增殖的影响取CIA-FLS接种于96孔板(每孔约8×103个细胞),培养12 h后,分别加入不同浓度的各caspase抑制剂预处理1、2、4 h,再加入DAP共处理48 h,其中Casp3-In、Casp8-In、Casp9-In终浓度为0、1.25、2.5、5、10、20 μmol/L,Pancasp-In终浓度为0、1.25、2.5、5、10、20、40 μmol/L,DAP终浓度为40 mg/L。其余实验步骤同2.1,最后计算各孔CIA-FLS细胞活力。
2.4 Hoechst 33258荧光染色观察CIA-FLS凋亡形态取CIA-FLS接种于24孔板(每孔约5×104个细胞),培养12 h后,分别加入各caspase抑制剂预处理2 h,再加入DAP共处理48 h,其中Casp3-In、Casp8-In、Casp9-In终浓度为5 μmol/L,Pancasp-In终浓度为20 μmol/L,DAP终浓度为40 mg/L,并设细胞对照孔。培养结束后,吸去各孔培养液,加入PBS洗涤1 min。将Hoechst 33258染液稀释30倍制成染色工作液,每孔加入200 μL染色工作液,室温避光染色10 min。吸去染色液,加入PBS水平缓摇洗涤3 min,重复3次。染色完成后尽快置于荧光显微镜下,选择340~350 nm蓝色激发光观察细胞凋亡形态,并拍照留存。
2.5 Annexin V-FITC/PI双染流式细胞术检测CIA-FLS凋亡率细胞分组同“2.4”,CIA-FLS培养48 h后,加入AccutaseTM细胞分离液,室温消化后低速离心,使用流式管收集细胞。每管加入预冷PBS洗涤2次,低速离心后弃尽上清,加入200 μL Binding Buffer重悬细胞,再分别加入5 μL Annexin VFITC和5 μL PI,室温避光孵育15 min,最后上流式细胞仪检测各组细胞凋亡率。
2.6 统计学方法采用SPSS 19.0统计软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05表示差异有统计学意义。
3.1 DAP对CIA-FLS增殖的影响如图1所示,倒置显微镜下可观察到CIA-FLS为成纤维样生长形态,贴壁状态良好,细胞排列均匀;
经DAP作用后CIA-FLS生长状态受到抑制,细胞数量明显减少,细胞皱缩变形且贴壁能力下降。经DAP作用后CIAFLS细胞活力明显下降,并与DAP作用浓度呈剂量依赖性。当DAP浓度为40 mg/L时,CIA-FLS细胞活力在50%左右,故后续实验选择此浓度继续研究。

3.2 DAP对CIA-FLS中caspase基因的影响如表1所示,经DAP(终浓度为40 mg/L)作用48 h后,与对照组相比,CIA-FLS的caspase-3、caspase-8、caspase-9 mRNA相对表达量明显增加(P<0.05)。由此可见,DAP可以激活CIA-FLS的caspase通路。
表1 DAP对CIA-FLS中caspase基因mRNA相对表达量的影响/±s
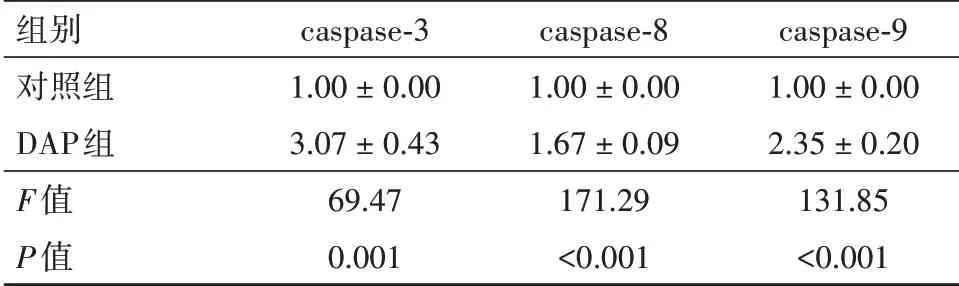
表1 DAP对CIA-FLS中caspase基因mRNA相对表达量的影响/±s
组别对照组DAP组F值P值caspase-3 1.00±0.00 3.07±0.43 69.47 0.001 caspase-8 1.00±0.00 1.67±0.09 171.29<0.001 caspase-9 1.00±0.00 2.35±0.20 131.85<0.001
3.3 caspase抑制剂不同条件预处理后,DAP对CIA-FLS增殖的影响与单独DAP作用组相比,各caspase抑制剂预处理均在不同程度上影响DAP抑制CIA-FLS增殖的效应。当Casp3-In、Casp9-In浓度为5 μmol/L,Pancasp-In浓度为20 μmol/L,预处理CIA-FLS 2 h或4 h,均可明显提高CIA-FLS细胞活力;
当Casp8-In浓度为5 μmol/L时亦可在一定程度上提高CIA-FLS细胞活力,但不如Casp3-In、Casp9-In、Pancasp-In效果明显,而当Casp8-In浓度为20 μmol/L时,CIA-FLS细胞活力却低于单独DAP作用组。见图2。

3.4 DAP对CIA-FLS凋亡形态的影响根据CCK-8实验和初期预实验,选择Casp3-In、Casp8-In、Casp9-In浓 度 为5 μmol/L,Pancasp-In浓 度 为20 μmol/L,预处理CIA-FLS 2 h,再与DAP(终浓度为40 mg/L)共处理48 h。如图3所示,对照组细胞核呈弥散均匀的蓝色荧光,细胞排列均匀,未见明显的凋亡荧光;
DAP组细胞核形状大小不一,出现较多浓染致密的颗粒状、块状荧光,细胞核固缩、碎裂明显,细胞数量明显少于对照组;
Casp3-In、Casp9-In、Pancasp-In预处理组,呈均匀蓝色荧光的正常细胞核较DAP组明显增多,但仍可见到少量散在分布的颗粒状荧光,少数细胞核碎裂;
Casp8-In预处理组与DAP组差异不明显,细胞数量较少。

3.5 DAP对CIA-FLS凋亡率的影响与对照组相比,经DAP作用后CIA-FLS凋亡率明显升高[(34.80±3.90)%比(5.68±1.35)%,P<0.05];
各caspase抑制剂预处理组CIA-FLS凋亡率均明显低于DAP组(P<0.05);
各caspase抑制剂预处理组中,Casp8-In预处理组CIA-FLS凋亡率明显高于Casp3-In、Casp9-In、Pancasp-In预 处 理 组[(29.46±2.16)%比(18.09±2.50)%、(20.41±3.53)%、(10.17±1.91)%,P<0.05]。
FLS异常增生引发的持续性滑膜炎症和软骨破坏,是RA最显著的病理特征[10]。研究表明FLS具有类肿瘤样增殖和抗凋亡的特性,增生活化的FLS产生多种促炎细胞因子与基质破坏性酶类,促进了FLS侵袭和破坏关节[11]。目前尚无根治RA的方法,临床上常用的治疗药物包括非甾体抗炎药、免疫抑制剂、糖皮质激素等,虽然具有明显对症及抗炎效果,但相应毒副作用大,不适合长期使用;
新兴生物靶向制剂如利妥昔单抗,具有一定疗效,但价格昂贵且仅对部分难治性RA有效[12]。天然植物来源的活性单体药物,具有来源广泛、易于获得、价格相对低廉、作用靶点多等优势,在临床应用方面日益受到关注,也是人类从自然界获取新药的重要途径[13]。既往文献报道中国传统中药活性成分如雷公藤多苷[14]、姜黄素[15]、白藜芦醇[16]、青藤碱[17]等,治疗RA病人或关节炎大鼠表现出较好疗效,极大拓展了学者们对RA的研究思路。鉴于FLS存在异常增生和凋亡不足的特性,利用中药活性单体成分干预来抑制FLS增殖、诱导其凋亡,有望成为一种治疗RA行之有效的临床方案[18]。
细胞凋亡是一种高度有序、受基因精细调控以及一系列酶参与的细胞自主性死亡方式,caspase家族是其中非常关键的调控因子。根据caspase在凋亡通路所处位置及执行功能的不同,可将其分为两大类,第一类是凋亡启动因子(包括caspase-2/8/9/10),第二类是凋亡效应因子(包括caspase-3/6/7)[19]。细胞凋亡主要有两条经典的介导通路,分别是死亡受体途径和线粒体途径。死亡受体途径中,死亡受体与相应配体结合后发生多聚化,募集FADD,再与caspase-8结合,形成死亡诱导信号复合体,活化procaspase-8,激活下游效应caspase-3,导致细胞凋亡[20]。线粒体途径由细胞内死亡信号如病毒、射线、化疗药物等激活,使线粒体膜通透性增加,造成Cyt-c等释放入胞质,在ATP/dATP存在情况下,Cyt-c与Apaf-1等结合形成多聚复合体,活化procaspase-9,激活下游效应caspase-3,导致细胞凋亡[21]。由此可见,caspase-8、caspase-9分别是两条凋亡途径的上游启动因子,而caspase-3是凋亡途径末端共同的效应因子。caspase贯穿这两条途径的始终,使其互相联系、彼此影响,共同调节细胞凋亡过程。为此,本研究重点聚焦于caspase通路来探讨DAP对CIA-FLS增殖与凋亡的影响。
本研究首先明确DAP对CIA-FLS增殖的影响,结合倒置显微镜下观察细胞生长状态和CCK-8试验,证实DAP能以剂量依赖性的方式降低CIA-FLS细胞活力,抑制其增殖。此外,DAP促使CIA-FLS的caspase相关基因表达增加,说明这个过程中caspase通路激活。当采用不同caspase抑制剂预处理CIAFLS后,DAP的抑制作用不同程度减弱,这与caspase抑制剂的种类、浓度、预处理时间均存在关联,特别是抑制剂种类。细胞发生凋亡时会出现一系列形态学变化,如细胞核碎裂、细胞质浓缩等,本研究利用Hoechst 33258荧光染色观察到CIA-FLS呈均匀弥散荧光,而经DAP作用后CIA-FLS细胞核形态发生明显改变,出现较多典型的凋亡荧光,Casp3-In、Casp9-In、Pancasp-In预处理组的凋亡现象较DAP组有不同程度改善。因此,我们推测DAP可能通过诱导CIA-FLS凋亡,从而抑制其增殖,这一过程中caspase通路起着重要作用。
为了进一步明确DAP诱导CIA-FLS凋亡的特性,并探讨其主要参与哪条凋亡途径,本研究还采用双染流式细胞术检测CIA-FLS凋亡率,发现各caspase抑制剂预处理组凋亡率较DAP组均明显降低,以Pancasp-In预处理组降低最为明显,但Casp8-In预处理组凋亡率却明显高于其他抑制剂预处理组。不难看出,通过荧光染色观察到的凋亡情况与流式检测结果基本一致,DAP可诱导CIA-FLS发生明显凋亡改变。当抑制caspase通路后,可有效阻断DAP诱导CIA-FLS凋亡的效应,并且抑制线粒体途径的凋亡启动因子对凋亡阻断效果,明显优于抑制死亡受体途径的凋亡启动因子,说明线粒体途径在这一过程中起着重要作用。文献报道[22]RA病人的FLS在线粒体凋亡途径中,可出现多种方式抵抗相关受体介导的凋亡,包括Bcl-2家族蛋白的功能失调、NF-κB信号转导通路失调、p53突变等,表明线粒体凋亡途径是FLS出现凋亡抵抗的重要原因,亦是天然药物诱导FLS凋亡的重要潜在靶点。
综上所述,本研究发现DAP可呈剂量依赖性地抑制CIA-FLS增殖,并通过caspase依赖的途径诱导CIA-FLS发生凋亡,其中主要涉及线粒体凋亡途径,表明DAP有望作为治疗RA的一种天然候选药物。值得注意的是,caspase通路涉及的调控基因众多,以及其他少见凋亡通路的存在,如内质网凋亡通路[23]、非caspase依赖的凋亡通路[24],故仍有待于我们后续的实验研究来进一步剖析DAP诱导CIA-FLS凋亡的精细机制,特别是线粒体途径中具体作用的分子靶位。
猜你喜欢 滑膜线粒体预处理 特发性肺纤维化中的线粒体质量控制临床肺科杂志(2022年3期)2022-11-26从线粒体动力学探讨中医药治疗心力衰竭相关机制研究世界中医药(2022年18期)2022-11-25线粒体自噬在纤维化疾病中作用的研究进展中华实用诊断与治疗杂志(2022年1期)2022-08-31KR预处理工艺参数对脱硫剂分散行为的影响材料与冶金学报(2022年2期)2022-08-10预处理对医用外科口罩用熔喷布颗粒过滤性能的影响纺织标准与质量(2022年3期)2022-08-10滑膜肉瘤中SS18-SSX和SSX免疫组化的诊断价值临床与实验病理学杂志(2022年4期)2022-06-28基于滑膜控制的船舶永磁同步推进电机直接转矩控制研究舰船科学技术(2022年10期)2022-06-17手术器械预处理在手术室的应用健康体检与管理(2022年4期)2022-05-13污泥预处理及其在硅酸盐制品中的运用建材发展导向(2021年23期)2021-03-08运动介导AMPK调控线粒体质量控制的机制研究进展中国体育科技(2018年6期)2018-12-13推荐访问:诱导性 瑞香 天冬