FeSe2纳米粒子对膀胱癌T24细胞的抑制作用及其机制
来源:优秀文章 发布时间:2022-12-05 点击:
张健峰 张鹏飞 牛海涛
(青岛大学附属医院泌尿外科,山东 青岛 266003)
全球范围内男性膀胱癌的发病率和死亡率均较高[1],同时膀胱癌也是我国最常见的泌尿系统恶性肿瘤[2],具有易转移、易复发的特点[3],目前常用的化疗、免疫治疗等疗效也不理想,相关治疗药物存在特异性低、毒副作用大和半衰期短的问题[4-5]。纳米材料因其对肿瘤组织穿透性强[6]、免疫原性低[7]和在血液中循环时间长[8]等特性,逐渐在肿瘤治疗中得以应用,也是目前研究的新方向之一。FeSe2是一类重要的过渡金属二卤代物,具有优异的磁性和近红外区的高吸收率的特点,是目前肿瘤光热治疗领域的研究热点[9-11]。本研究拟设计合成一种能够降解谷胱甘肽(GSH)、选择性抑制肿瘤细胞的FeSe2纳米粒子,并比较该粒子对膀胱癌细胞和正常膀胱上皮细胞的抑制作用,为膀胱癌临床治疗提供新的可能的方式。
1.1 材料和仪器
人膀胱移行细胞癌细胞T24细胞株、人膀胱上皮永生化细胞SV-HUC-1细胞株均购自中国科学院上海生命科学研究院细胞所。硒粉购于天津光复精细化工研究所,氯化亚铁、乙醇胺、5,5′-二硫代双(2-硝基苯甲酸)(DTNB)购于上海麦克林生化科技有限公司,活性氧(ROS)检测试剂盒购于上海碧云天生物技术有限公司,GSH购于国药集团化学试剂有限公司,DMEM高糖基础培养基购于武汉普诺赛生命科技有限公司。
1.2 细胞培养及处理
将T24细胞和SV-HUC-1细胞培养于含体积分数0.10胎牛血清和含10 g/L青霉素-链霉素的DMEM高糖培养基中,并置于37 ℃、含有体积分数0.05 CO2的细胞培养箱内常规培养,待细胞培养至对数生长期时进行后续实验。
1.3 FeSe2纳米粒子的制备
取1 mmol硒粉和1 mmol氯化亚铁分别溶解于15 mL乙醇胺中,均剧烈磁力搅拌1 h后,将两者混合,混合物再剧烈磁力搅拌12 h后置于100 mL聚四氟乙烯的反应釜中,烘箱中180 ℃反应12 h,后自然冷却至室温。将混合物以8 000 r/min离心10 min,收集沉淀物并分别用无水乙醇和双蒸水各洗涤3次,冷冻干燥后得到FeSe2纳米粒子粉末[12],取1 mg FeSe2纳米粒子溶于1 mL的磷酸盐缓冲液(PBS)中,制备成浓度为1 g/L的FeSe2母液用于后续实验。
1.4 实验方法
1.4.1FeSe2纳米粒子表征观察 采用JEM-2100F型透射电子显微镜(TEM)观察FeSe2的形貌表征,放大倍数200 000。采用D8 Advance型X射线衍射仪检测FeSe2的晶体结构表征,扫描范围为20°~80°,速率为1°/min,步长为0.02°。
1.4.2噻唑蓝(MTT)法检测FeSe2对T24细胞和SV-HUC-1细胞活性的影响 取处于对数生长期的T24细胞和SV-HUC-1细胞,胰酶消化后接种于96孔板中,每孔约8 000个细胞,待细胞完全贴壁后,分别加入FeSe2母液使其终浓度为0、10、25、50、75、100、200 mg/L。培养箱孵育24 h后,每孔加入20 μL的MTT(5 g/L),再放入培养箱中继续孵育4 h,吸掉上清液后每孔加入150 μL的二甲基亚砜(DMSO),震荡混匀后置于酶标仪上测定490 nm波长处各孔的吸光度值。计算FeSe2对细胞活性的抑制率。
1.4.3DTNB法检测FeSe2与GSH共孵育后GSH含量的变化 在1.5 mL EP管当中加入300 μL的GSH(1 mmol/L),再分别加入0、10、20、30、40、50、60、80 μL的FeSe2母液(1 g/L),然后使用PBS(0.1 mol/L,pH 7.4)补至1 mL,使FeSe2终浓度分别为0、10、20、30、40、50、60和80 mg/L,于37 ℃共孵育4 h;
同样,在1.5 mL EP管当中加入300 μL的GSH(1 mmol/L),再加入50 μL的FeSe2母液,用PBS(0.1 mol/L,pH 7.4)补至1 mL,使FeSe2终浓度50 mg/L,于37 ℃共孵育不同时间(0、2、4、6 h)。孵育完成后在体系中加入10 μL的DTNB乙醇溶液(1.0 g/L),震荡混匀室温下孵育5 min,采用Lambda 950型紫外分光光度计测定412 nm波长处的紫外吸光度值。
1.4.44′,6-二脒基-2-苯基吲哚(DAPI)与2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)双染检测T24细胞内ROS水平 取处于对数生长期的T24细胞,胰酶消化后接种于12孔板中,每孔约1×106个细胞,待细胞完全贴壁后,每孔加入终浓度5 mg/L的DAPI染料,分别进行如下两组实验:①每孔分别加入0、25、50和100 mg/L的FeSe2孵育4 h;
②每孔分别加入50 mg/L的FeSe2孵育0、2、4、6 h。孵育结束后弃掉上清液,每孔再分别加入1 mL无血清的DMEM培养基稀释的DCFH-DA荧光探针(10 μmol/L),置于培养箱中孵育20 min,用无血清DMEM洗涤后,再加入1 mL无血清DMEM,最后置于倒置荧光显微镜下,观察各组T24细胞的荧光强度。
1.4.5Ferrostatin-1与FeSe2共处理对T24细胞活性的影响 取处于对数生长期的T24细胞,胰酶消化后接种于96孔板中,每孔大约8 000个细胞,待细胞完全贴壁以后,将细胞分为5组,分别为细胞对照组(A组)、FeSe2组(B组)、FeSe2+Ferrostatin-1100 nmol/L组(C组)、FeSe2+Ferrostatin-1 200 nmol/L组(D组)、FeSe2+Ferrostatin-1 400 nmol/L(E组)。培养箱孵育24 h后,每孔加入20 μL的MTT(5 g/L),再放入培养箱中继续孵育4 h,吸掉上清液后每孔加入150 μL DMSO,震荡混匀后置于酶标仪上测定490 nm波长处各孔的吸光度,计算C、D、E组细胞活性对比B组细胞活性的相对逆转率。相对逆转率=(C、D、E组吸光度值-B组吸光度值)/ B组吸光度值×100%。
1.5 统计学方法
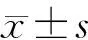
2.1 合成的FeSe2纳米粒子的表征
TEM观察显示合成的FeSe2纳米粒子直径为10~20 nm(图1A),X射线衍射谱图(XRD)显示,FeSe2结晶度高,在θ为34.9°、36.3°和48.2°处有明显的特征衍射峰(图1B)。
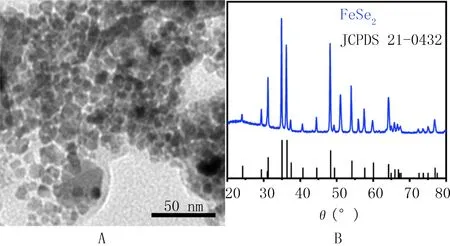
A:TEM观察结果,B:XRD显示结果
2.2 FeSe2对T24细胞和SV-HUC-1细胞的抑制作用
两因素析因设计的方差分析显示,FeSe2的浓度、细胞类型和FeSe2浓度与细胞类型的交互作用对T24细胞活性均具有显著影响(F浓度=111.30,F细胞=868.60,F浓度*细胞=41.47,P<0.05)。单独效应分析显示,FeSe2对T24细胞的抑制作用强于对SV-HUC-1细胞的抑制作用(F=35.09~294.71,P<0.05),FeSe2对T24细胞与SV-HUC-1细胞的抑制作用则均随着FeSe2浓度的增高而增强(F=142.74、10.04,P<0.05)。详见表1。

表1 FeSe2对T24细胞和SV-HUC-1细胞的抑制率(χ/%)Tab.1 Inhibitory rate of FeSe2 on T24 cells and SV-HUC-1 cells (χ/%)
2.3 FeSe2对GSH的降解作用
DTNB法检测结果显示,将50 mg/L FeSe2与GSH共孵育0、2、4、6 h后,吸光度值分别为0.558±0.017、0.410±0.036、0.167±0.008、0.052±0.011,随着孵育时间延长,GSH含量逐渐减少,差异具有显著性(F=240.50,P<0.05)。0、10、20、30、40、50、60和80 mg/L浓度的FeSe2与GSH共孵育4 h后,吸光度值分别为0.616±0.036、0.485±0.024、0.448±0.021、0.414±0.018、0.359±0.011、0.185±0.013、0.151±0.016、0.130±0.011,并随着FeSe2浓度的增大,GSH含量逐渐减少,差异均具有显著意义(F=153.60,P<0.05)。
2.4 FeSe2对T24细胞内ROS水平的影响
DAPI与DCFH-DA双染结果显示,DAPI进入细胞后定位于细胞核内,使用405 nm激光激发后发出蓝色荧光,DCFH-DA进入细胞后与ROS反应生成2′,7′-二氯荧光素(DCF),使用488 nm激光激发后发出绿色荧光(图2)。图中显示,不同时间和不同浓度处理的T24细胞内均可见蓝色荧光和绿色荧光,且随着FeSe2浓度增高或作用时间延长,蓝色荧光逐渐减弱,绿色荧光逐渐增强。
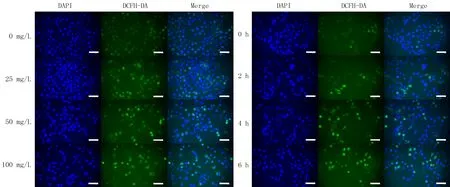
DAPI与DCFH-DA双染,40倍,标尺=50 μm图2 不同浓度和不同时间FeSe2对T24细胞内ROS水平的影响Fig.2 Effect of FeSe2 with different concentrations and treatment times on ROS level in T24 cells
2.5 Ferrostatin-1与FeSe2共处理对T24细胞活性的影响
MTT检测结果显示,A、B、C、D、E组吸光度值分别为0.470±0.027、0.184±0.008、0.215±0.013、0.247±0.014、0.274±0.011,各组细胞的吸光度值比较差异具有显著性(F=194.80,P<0.05)。其中A组与B组比较、B组与C、D、E组间比较,差异均有显著性(P<0.05)。FeSe2和Ferrostatin-1共处理的C、D、E组细胞活性对比B组细胞活性的相对逆转率分别为22.28%、34.24%、48.91%,随着Ferrostatin-1浓度的升高,对FeSe2作用于T24细胞抑制作用的逆转率也越高(F=43.81,P<0.05)。
膀胱癌是泌尿系统最常见的恶性肿瘤,占我国泌尿生殖系肿瘤发病率的第1位,在西方其发病率仅次于前列腺癌[1]。膀胱癌分为肌层浸润性膀胱癌(MIBC)和非肌层浸润性膀胱癌(NMIBC)[13-14]。目前膀胱癌的治疗仍以手术为主,或同时联合其他方式的综合治疗[15],但70%~80%的NMIBC患者在术后5年内复发或进展[16],10%~20%的患者进展为MIBC或远处转移性疾病[17];
放疗及化疗的副作用较大,缺乏选择性[4-5];
目前新兴的二线治疗如免疫治疗和靶向治疗,则因价格昂贵和患者反应率低,而不能被广泛接受[18-20]。
纳米材料因穿透肿瘤组织能力强、免疫原性低和在血液中循环时间长等特性,成为肿瘤治疗的新方向之一。ROS是指在生物体内与氧代谢有关的、含氧自由基和易形成自由基的过氧化物的总称。低浓度的ROS在调节信号通路、消除病原体、调节炎症以及促进细胞增殖等方面具有重要作用,然而当ROS浓度较高时则可能破坏核酸、蛋白质或细胞膜,从而导致细胞的死亡[21]。GSH是细胞内最重要的抗氧化物之一,其能够保护细胞免受ROS损伤[19-20]。肿瘤细胞的ROS水平往往高于正常细胞,导致体内如GSH的抗氧化剂水平适应性升高,使ROS和GSH在高水平保持动态平衡,且倾向于呈现为氧化应激的状态[22-23]。
本研究以乙醇胺为溶剂,用氯化亚铁和硒粉一步水热法合成了FeSe2纳米粒子,该粒子TEM表征显示直径为10~20 nm,符合纳米药物的尺寸要求;
XRD表征显示,在θ为34.9°、36.3°和48.2°处有特征衍射峰,与FeSe2的JCPDS 21-0432数据一致,表明成功合成FeSe2晶体。通过MTT法比较FeSe2对T24细胞和SV-HUC-1细胞活性的抑制作用,结果显示,FeSe2针对T24细胞活性的抑制作用强于对SV-HUC-1细胞活性的抑制作用。为进一步探究可能的机制,将FeSe2与GSH共孵育,以DTNB检测GSH含量,结果显示FeSe2可降解GSH,且降解量随着浓度的增加或时间的延长而增加。DAPI与DCFH-DA双染结果显示,随着FeSe2浓度增高或作用时间延长,蓝色荧光逐渐减弱,表明FeSe2可抑制T24细胞活性,与MTT结果相符;
绿色荧光逐渐增强,表明FeSe2能够诱导T24细胞ROS升高,且ROS水平与FeSe2的浓度和作用时间均呈正相关。因此FeSe2对膀胱癌T24细胞的抑制作用可能与降解GSH导致细胞内ROS的水平升高密切相关。FeSe2对T24细胞活性的抑制作用明显强于对SV-HUC-1细胞的抑制作用,则可能是因为肿瘤细胞的ROS浓度明显高于正常细胞,使用外源性试剂增加氧化应激对肿瘤细胞的破坏性比对正常细胞的破坏性更大。即肿瘤细胞中本身固有的ROS浓度较高,当肿瘤细胞和正常细胞都暴露于相同量的外界ROS时,肿瘤细胞内的ROS水平将更容易达到触发细胞死亡的阈值;
而正常细胞固有的ROS浓度低,因此能够缓冲一定量的ROS而不至于触发细胞死亡[24]。
铁死亡是铁依赖性的,由过度脂质过氧化引起,是伴随GSH耗竭和ROS爆发的一种细胞死亡方式[25]。Fe2+在铁死亡过程中起着重要推动作用,当它与H2O2混合并发生反应时,可以产生自然界中氧化性仅次于氟的羟基自由基[26]。本研究中合成的FeSe2含有Fe2+,能够降解GSH,产生ROS,因此很可能参与了铁死亡介导细胞死亡的过程。肿瘤细胞的H2O2水平高于正常细胞[27],因此相同浓度的FeSe2能够产生更多的羟基自由基,这也可能是导致FeSe2对肿瘤细胞和正常细胞抑制作用不同的原因。进一步的实验证明,随着Ferrostatin-1浓度增大,逆转FeSe2对T24细胞抑制作用的效应逐渐增强,提示FeSe2可能是通过触发铁死亡从而导致对T24细胞活性的抑制作用。
综上所述,FeSe2可以消耗胞外GSH,诱导细胞内ROS产生,可能参与铁死亡的过程,从而抑制T24细胞的活性,有望用于膀胱癌治疗。而这还需进一步的动物实验和前瞻性临床研究来进行验证。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest:
All authors disclose no relevant conflicts of interest.
作者贡献:牛海涛、张鹏飞、张健峰参与了研究设计;
牛海涛、张健峰参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions:
The study was designed byNIUHaitao,ZHANGPengfei, andZHANGJianfeng. The manuscript was drafted and revised byNIUHaitaoandZHANGJianfeng. All the authors have read the last version of the paper and consented submission.