艳山姜精油挥发成分分析及其抑制肿瘤细胞增殖作用研究
来源:优秀文章 发布时间:2022-12-05 点击:
廖良坤 杨胜涛 袁源 查云盛 和桂芳 肖鱼
(1.中国热带农业科学院农产品加工研究所/农业农村部热带作物产品加工重点实验室 广东湛江524001;
2.怒江绿色香料产业研究院 云南怒江 673200)
艳山姜为姜科山姜属植物艳山姜[(Alpinia zerumbet(Pers.)Burtt.et Smith)]的干燥成熟果实,是贵州、云南少数民族常用的民族药材,具有温中燥湿、行气止痛、截疟之功效,主治心腹冷痛、胸腹胀满、消化不良、呕吐腹泻等,目前已有 200多年的栽培历史[1]。艳山姜挥发油是从艳山姜的干燥成熟果实中提取得来,具有广泛的生物活性,包括抗炎、抗氧化以及防治心血管系统疾病等[2]。研究表明,艳山姜叶子的水提物和二氯甲烷提取物在体外有抗增殖活性,水醇提取物和二氯甲烷提取物对白血病和肺肿瘤细胞系显示出抗增殖作用,表明艳山姜具有作为抗肿瘤药物的潜质[3]。目前关于艳山姜精油的活性研究主要集中于对心血管系统疾病和抗炎方面[4],在艳山姜精油抑制癌细胞增殖方面研究较少。
本研究通过提取艳山姜精油,分析其挥发组分,并利用HepG2人肝癌细胞实验,分析精油诱导癌细胞凋亡、抑制癌细胞增殖的效果,揭示其抗肿瘤作用。
1.1 材料
1.1.1 试剂艳山姜,采自云南怒江州;
HepG2人肝癌细胞系,购于上海中国科学院细胞库;
DMEM培养基,美国Gibco;
胎牛血清,美国Gibco;
DMSO,美国sigma;
CCK-8试剂盒,美国Sigma;
多功能酶标仪,美国 Thermo Fisher;
Annexin V-PE/7-AAD流式试剂盒,中国三箭;
一抗:Caspase-3(兔来源)、Caspase-9(兔来源)、p53(兔来源)、PCNA(兔来源),英国Abcam;
内参一抗β-actin(兔来源),英国Abcam;
RNA提取试剂盒,日本takara;
气相色谱质谱仪,日本岛津。
1.1.2 设备二氧化碳培养箱,日本三洋;
低速台式离心机,上海安亭;
倒置显微镜,Nikon,日本;
流式细胞仪,美国BD;
垂直板电泳转移装置,美国Bio-Rad;
Trans-Blot转膜装置,美国Bio-Rad;
凝胶成像系统,中国 Tanon;
StepOnePlus实时荧光定量PCR仪,美国ABI;
激光共聚焦显微镜,日本Nikon。
1.2 方法
1.2.1 艳山姜精油 GC-MS分析将水蒸气蒸馏获得的艳山姜精油10 μL溶解于1 mL甲醇中,利用0.22 μm尼龙膜过滤后,进行GC-MS分析。色谱条件:色谱柱HP-5 MS(30 m×250 μm×0.25 μm);
升温程序为初始温度50℃保持5 min,以5℃/min的速率升温至50℃,再以8℃/min的速率升温至230℃保持5 min,以20℃/min的速率升温至280℃,保持5 min。载气为He;
载气流量为1 mL/min,进样口温度290℃;
进样量1 μL;
分流比为10∶1。质谱条件:EI离子源,电子能量70 eV,传输线温度250℃,离子源温度230℃,质谱扫描范围为 35~550 m/z[5]。
1.2.2 HepG2细胞培养细胞为人类肝癌细胞HepG2,其培养基为威廉姆斯E(WME)全培养基,其中包含5%胎牛血清(FBS)、2 mmol/L谷氨酸盐、10 mmol/L 4-羟乙基哌嗪乙磺酸缓冲液、0.05 μg/mL氢化可的松、5 μg/mL胰岛素、100 μg/mL庆大霉素、50 μg/mL链霉素和 50 units/mL青霉素,将HepG2细胞在37℃、5%CO2条件下进行培养,实验使用的细胞代数为14~35代[6]。
1.2.3 不同浓度艳山姜精油处理HepG2细胞模型建立吸取250 μL艳山姜精油,质量为0.229 4 g,计算密度为0.917 6 g/mL,因此吸取435.9 μL艳山姜精油,质量为 0.4 g,加入无水乙醇 2 mL,得艳山姜精油母液浓度为0.2 g/mL。用胰酶消化细胞,计数调整细胞浓度至1×104个/mL,分别接种于96孔板中,每孔100 μL,每组细胞3个重复;
将96孔板移入培养箱中培养(37℃,5% CO2),待细胞贴壁后,利用不同精油处理细胞[7]。
1.2.4 CCK 检测分别往上述96孔板培养的细胞中加入 400、200、100、50、25、0 μg/mL 的艳山姜精油,培养12、24、48 h;
每孔加入10 μL CCK-8溶液,于培养箱内孵育 1~4 h,用酶标仪测定波长450 nm处的吸光度值;
设置空白孔(培养基、CCK8),对照孔(未经处理的细胞、培养基、CCK8)[8]。
细胞抑制率=[A对照组-A实验组]/[A对照组-A空白组]×100%
A实验组:具有经过处理的细胞的CCK8溶液的吸光度值;
A空白组:具有培养基和CCK8溶液而没有细胞的孔的吸光度值;
A对照组:具有未经过处理的细胞的CCK8溶液的吸光度值。
1.2.5 流式细胞分析用6孔板培养细胞,待细胞生长达到60%~70%,加入相应浓度的精油处理HepG2细胞,继续培养24 h;
收集细胞培养基上清和沉淀,以2 000 r/min离心5 min;
用PBS洗涤细胞2次,以2 000 r/min离心5 min,收集(1~5)×105个细胞;
在 50 μL 的 Binding Buffer中加入5 μL 7-AAD染液,混匀;
收集细胞中加入上述7-AAD染液,混匀;
室温、避光、反应5~15 min;
加入 450 μL的 Binding Buffer混匀,加入 1 μL AnnexinV-PE混匀;
室温、避光、反应5~15 min;
1 h内,进行流式细胞仪检测。Annexin V-PE的橙红色荧光,激发波长Ex=488 nm,发射波长Em=578 nm;
7-AAD红色荧光,激发波长Ex= 546 nm,发射波长Em=647 nm[9]。
1.2.6 qPCR按照RNA提取试剂盒步骤,提取RNA,用分光光度仪测定浓度后用反转录试剂盒按照步骤将其反转录为 cDNA,根据浓度稀释适当倍数,然后利用qPCR仪进行mRNA检测。PCR扩增条件:95℃ 5 min,95℃ 10 s,60℃ 30 s,95℃ 15 s,60℃ 60 s,95℃ 15 s,共计 40 个循环[10]。基因表达定量采用△Ct的方法,引物由Western Biotechnology公司合成,见表1。

表1 引物名称和序列
1.2.7 数据处理实验数据利用 Excel处理,显著性采用SPSS方差分析,实验重复3次,p<0.05为差异具有统计学意义。
2.1 艳山姜精油GC-MS分析
将艳山姜精油按 1.2.1条件进行 GC-MS分析,得到艳山姜精油挥发性成分,用 NIST14质谱数据库检索匹配,定性分析出50个挥发性成分(表1),分别为烯烃类25个、醇类13个、醛类6个、酮类3个、其他芳烃化合物3个,共占总挥发组分的96.35%。艳山姜精油挥发组分主要为α-蒎烯、β-蒎烯、β-水芹烯、石竹烯、δ-杜松烯、桉叶油醇等烯烃和醇类化合物;
挥发组分中,烯烃占63.88%、醇类占19.52%、醛类占3.95%、酮类占2.99%。

表1 艳山姜精油挥发组分分析
2.2 艳山姜精油对细胞抑制率
艳山姜精油对HepG2癌细胞的抑制作用如图1所示。由图1可看出,艳山姜精油对HepG2细胞的抑制作用呈剂量依赖性,当精油浓度在 25~200 μg/mL时,随着精油浓度的升高,对 HepG2细胞的抑制作用增强,在200 μg/mL浓度下孵育12、24和48 h的细胞抑制率分别为21.4%、38.6%和56.8%;
当精油浓度在25~100 μg/mL时,孵育时间对精油的抑制率影响较小,孵育 12、24和48 h后,相同精油浓度条件下不同孵育时间的抑制率差异不显著(p>0.05),但当精油浓度为200 μg/mL时,不同孵育时间对精油的抑制率影响显著(p<0.05)。

图1 艳山姜精油对HepG2细胞抑制作用

续表1 艳山姜精油挥发组分分析
2.3 细胞凋亡分析
为探究艳山姜精油是否通过诱导细胞凋亡来抑制HepG2肿瘤细胞的活性,采用流式细胞术测定不同浓度艳山姜精油处理引起的细胞凋亡,其中无精油处理时,细胞凋亡率为2.56%(图2);
精油浓度为50 μg/mL时,细胞凋亡率为3.2%;
精油浓度为200 μg/mL时,细胞凋亡率为6.2%,相较于未利用精油处理的细胞,凋亡率提升了2.5倍。艳山姜精油引起的HepG2细胞凋亡如图3所示。

图2 不同浓度艳山姜精油下HepG2的凋亡率
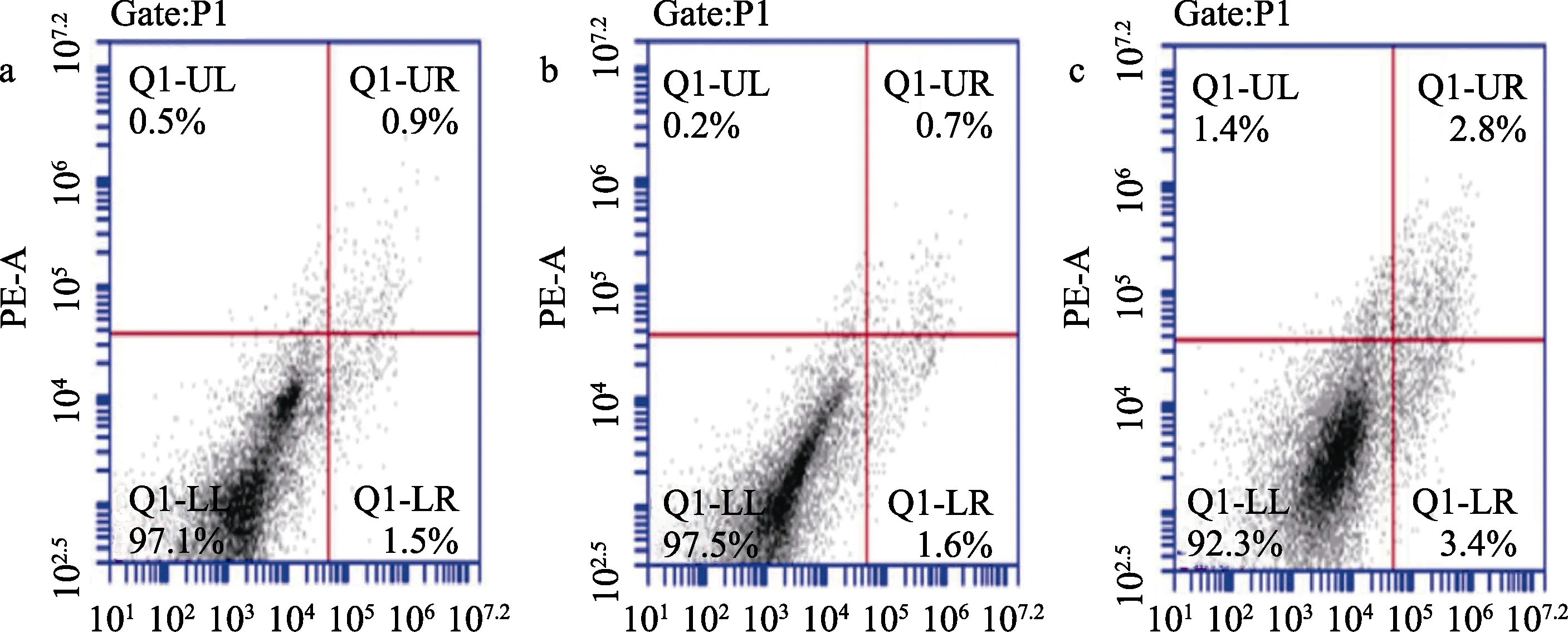
图3 艳山姜精油对HepG2细胞凋亡的影响
2.4 基因表达分析
Caspase-3、Caspase-9、p53、PCNA的激活与细胞凋亡有关[11-12],通过 qPCR检测经艳山姜精油处理的HepG2细胞每24 h的mRNA表达水平。如图4所示,艳山姜精油在不同浓度下Caspase-3、Caspase-9、p53三种基因 mRNA 表达水平均提高,PCNA基因mRNA表达水平降低;
在艳山姜精油浓度为200 μg/mL时,Caspase-3、Caspase-9、p53的mRNA基因表达水平分别提高至对照组的2.57、1.74、1.50倍,PCNA的 mRNA表达水平降低至对照组的0.45倍。caspase-3是细胞凋亡过程中最主要的终末剪切酶[13],在细胞凋亡中起着不可替代的作用,caspase-3基因表达显著提升(p=0.05),表明艳山姜精油具有促进HepG2细胞凋亡的作用。Caspase 9是参与启动细胞程序性死亡的蛋白酶,可以引起细胞死亡,经艳山姜精油处理后,Caspase 9基因表达提升了 1.74倍,说明艳山姜精油能促进 HepG2细胞程序性死亡。p53介导的细胞信号转导途径在调节细胞正常生命活动中起重要作用,是重要的肿瘤抑制基因,能使癌细胞凋亡,从而防止癌变[14]。HepG2细胞经 200 μg/mL的艳山姜精油处理后,p53基因表达提高了1.50倍,表明精油的处理促进了p53途径作用的发挥,有利于癌细胞凋亡。PCNA与细胞 DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的良好指标[15];
经精油处理后,PCNA的表达显著降低(p<0.05),表明癌细胞的增殖受到较好的抑制。

图4 艳山姜精油对基因表达的影响
本研究利用水蒸气蒸馏法,提取艳山姜精油,通过 GC-MS分析可知,精油组分主要包含烯烃类和醇类物质,分别占挥发组分的 63.88%、19.52%。同时,利用人体肝癌细胞HepG2系,研究了艳山姜精油抑制肿瘤细胞增殖功效,通过CCK法分析精油对细胞增殖的影响,表明精油为200 μg/mL时,处理48 h后对细胞增殖的抑制率达到 56.8%。利用流式细胞术分析艳山姜精油对细胞凋亡的影响,200 μg/mL的精油处理24 h,细胞凋亡率较对照提高了2.5倍。利用QPCR分析精油处理后细胞凋亡相关基因表达,结果表明,促进细胞凋亡的基因Caspase-3、Caspase-9、p53表达量均提升,而促进细胞增殖的PCNA基因表达显著降低。本研究表明艳山姜精油能抑制HepG2增殖,促进细胞凋亡,为开发艳山姜健康食品提供了科学支撑。
猜你喜欢 抑制率孵育精油 双酶水解鱼鳞蛋白制备ACE抑制肽的工艺优化研究现代农村科技(2022年1期)2022-01-21全血标本孵育时间及温度对糖化血红蛋白检测结果的影响中国药学药品知识仓库(2021年11期)2021-11-25蔬菜使用不同处理方式对农药残留影响的研究食品界(2021年7期)2021-07-19用课程“孵育”会“发光”的教室中小学德育(2020年11期)2020-03-18为自己调香,造一座精油芳香花园中国化妆品(2018年6期)2018-07-09刺果瓜甲醇提取物对植物化感作用的研究杂草学报(2016年4期)2017-05-31军事电子专业研究生创新能力的孵育与拓展教育界·上旬(2016年12期)2017-05-25补骨脂提取物对黄瓜炭疽病菌的抑制活性江苏农业科学(2016年1期)2017-05-172100年,帝企鹅会走向灭绝?环球人文地理(2016年10期)2016-11-24焕“发”光彩女友·家园(2014年12期)2014-12-20推荐访问:精油 增殖 挥发