一氧化氮合成酶的基因克隆与功能鉴定
来源:优秀文章 发布时间:2022-12-05 点击:
罗希帆,周灵美,谢晓东,陈帅君,杨红澎,吴疆
一氧化氮合成酶的基因克隆与功能鉴定
罗希帆,周灵美,谢晓东,陈帅君,杨红澎,吴疆通信作者
(天津农学院 农学与资源环境学院,天津 300392)
一氧化氮(NO)作为一种极其重要的生物信息分子,其合成依赖于一氧化氮合成酶(NOS),因此NOS在动植物体内发挥着不可替代的作用。本研究通过克隆海洋细菌JM-2的一氧化氮合成酶基因,利用HⅠ和Ⅲ 对目的基因和载体进行双酶切和连接,然后用热激转化法将目的基因转到大肠杆菌Top 10和BL-21中,使其成功表达,得到转化菌株,再利用IPTG诱导蛋白表达并进行蛋白纯化,最后对该蛋白的活性进行测定和分析。结果表明,当培养基中IPTG的最佳浓度为0.1 mmol/L、诱导时间为5 min时,NOS活性最大。
基因克隆;
蛋白纯化;
一氧化氮合成酶;
活性测定
一氧化氮合成酶(NOS)是迄今为止可知的最大、最复杂的酶系之一,由于其活力较低,稳定性差,受多种因素调节,难以测定其活性[1-2]。研究发现,一氧化氮(NO)在生物体各组织中均有分布,它是一种新型的细胞信使,是分子较小的生物自由基,结构简单,极不稳定,在水中呈微溶性,但脂溶性很强,能够透过生物膜快速扩散,NO的生成离不开NOS[3-4]。研究表明,NO对于动物的神经、免疫、呼吸等均有重要影响[5],对于植物的生长发育及其逆境胁迫调控方面也有至关重要的作用[6-7]。NO还能降低植物气孔开放,具有抗氧化胁迫能力,增强植物的抗旱性,使其在缺水时仍能正常进行光合作用。NO类生物自由基可以直接改变蛋白质、酶活性、基因转录和翻译后修饰,有利于植物在干旱环境中生长[8-9]。
在有关NO的研究中,NO的合成途径始终是焦点。研究发现,在细菌、真菌、动植物体内均存在NOS,动植物体内NO的生物作用完全依赖于NOS活性[10]。在研究初期,NOS的活性只在内皮细胞中有所发现,后随研究的不断深入,发现NOS在动植物体内存在着广泛的应用[11]。由于NOS稳定性差,活性较难测定,特别是NO具有复杂的理化特性和生物学特性,因此,关于NO的研究仍处于初步阶段[12]。基于此,深入研究测定NOS活性以及NO在动植物体内的功能,将成为研究的热点。本研究通过从全基因组中克隆NOS基因,采用热激转化法将该基因转入大肠杆菌中并使其成功表达,然后加入IPTG低温诱导,对目标蛋白的活性进行测定和分析,以明确NOS异源表达的催化功能,为NO在植物中进一步应用提供有益参考。
1.1 试验菌株与质粒
大肠杆菌Top 10与BL-21、pet-28a。
1.2 试验仪器
基因扩增仪(BIO RAD)、离心机(Anke TGL-16C)、恒温培养箱(DHP-9052)、恒温振荡培养器(PH050A)、三用紫外分析仪(WFH-203B)、超声细胞粉碎机(JY88-Ⅱ)、高速冷冻离心机(Aida TGL 16A)、紫外分光光度仪(PGENERAL)。
1.3 主要试验药品与试剂
HⅠ、Ⅲ,ThermoFisher;
10×PCR Master Mix、DNA Marker Ⅲ、RapiLigation Mix、普通DNA产物纯化试剂盒、质粒小提试剂盒,天根生化科技(北京)有限公司;
GeneGreen核酸染液、IPTG、Agarose、Tris、SDS-PAEG Loading Buffer、卡那霉素、考马斯亮蓝R250,北京鼎国昌盛生物技术有限责任公司。
1.4 试验方法
1.4.1 基因组的克隆与纯化
模板1 μL、上下游引物(序列号见表1)各0.5 μL、去离子水10.5 μL、Mix 12.5 μL,总体系为25 μL。轻弹混匀放入PCR仪中进行扩增,完成后进行琼脂糖凝胶电泳验证,拍照并记录结果。以基因扩增产物为模板,按PCR扩增程序将基因扩增至200 μL,用纯化试剂盒纯化该产物[7]。
表1 引物序列
引物引物名称序列号 上游引物(5′-3′)petNO1FCGCGGATCCATGAATCTGTATGAACAAGC 下游引物(5′-3′)petNO1RCCCAAGCTTGCCTTTCAATTCCTCTTTTACC
1.4.2 质粒提取
取50 mL含卡那霉素的LB液体培养基于锥形瓶中,加入含pet-28a质粒的菌株摇床过夜培养,使用质粒小提试剂盒进行质粒提取。
1.4.3 基因与质粒的双酶切
为使基因与质粒连接,对该基因进行双酶切,以产生黏性末端。总体系为200 μL,其中:酶(H I、Ⅲ)各2 μL、10×Fast Digest Green Buffer 10 μL、基因(质粒)40 μL、去离子水138 μL。
将配制完成的反应体系离心,充分混匀放入37 ℃恒温培养箱中培养3 h,使用普通DNA产物纯化试剂盒对该基因(质粒)进行纯化,并采用琼脂糖凝胶电泳验证,然后将该酶切产物储存于-4 ℃冰箱中。
1.4.4 基因与载体的连接
利用RapiLigation Mix将质粒与上述基因产物连接,总体系为10 μL,其中:RapiLigation Mix (2×)5 μL、目的基因4 μL、载体1 μL,轻弹混匀离心,取出,静置反应20 min。
1.4.5 大肠杆菌Top 10的转化与验证
Top 10主要用于重组质粒的扩增,它没有表达外源蛋白的生物学功能,但能大量复制导入的外源质粒,在正式转入目的菌株前,要先转入至大肠杆菌Top 10中。本试验采用热激转化的方法将重组质粒转入大肠杆菌中。
(1)将连接产物转入50 μL Top 10感受态细胞中,轻弹混匀,冰浴后置于42 ℃水浴锅中,冰浴30 min,42 ℃热激90 s,后立即放入冰水混合物3 min。
(2)吸取少量LB液体培养基(不含卡那霉素)于离心管中,160 r/min,37 ℃培养45 min,离心,吸出多余上清液,直至离心管中剩余少量液体,用移液枪将菌体沉淀吹起,涂布在含有卡那霉素的LB固体培养基上,37 ℃培养过夜。
(3)取多个EP管分别加入1 mL含有卡那 霉素的LB液体培养基,挑取相对较大的单菌落于各EP管中,160 r/min,37 ℃ 培养过夜,然后进行菌液PCR验证转化。将过夜培养的菌液与40%甘油按1∶1的比例加入到EP管里,标明菌种及日期,-80 ℃冰箱保存。
1.4.6 大肠杆菌BL-21的转化与验证
大肠杆菌BL-21具有完整表达外源基因产物的生物学功能,因此要将重组质粒转入到大肠杆菌BL-21中,使目的基因得到表达。转入前要先对Top 10中的重组质粒进行提取,然后采用热激转化法将重组质粒转入到BL-21中,方法参见1.4.5中Top10的转化。转化后放入恒温培养箱内过夜培养,选取相对较大的单菌落进行扩大培养,之后进行菌液PCR验证,方法参见1.4.5中Top10验证。菌种保存方法同上。
1.4.7 目标蛋白的诱导
将上述验证过的大肠杆菌BL-21接种到含有卡那霉素的LB液体培养基中进行扩大培养,之后加入IPTG低温诱导使其产生蛋白。为优化蛋白表达的最佳条件,本试验设置了诱导时间与IPTG浓度两个变量。
(1)第一组设置时间变量,第二组设置浓度变量。分别向两组锥形瓶中各加入10 mL含有卡那霉素的LB培养基,时间梯度为0.5、1.0、2.0、3.0、4.0、5.0 h,IPTG梯度浓度为0.1、0.2、0.3、0.4、0.5、0.6 mmol/L。
(2)将含有目的基因的BL-21菌株分别接 入这两组锥形瓶中,时间组锥形瓶中添加相同浓度(0.1 mmol/L)的IPTG。
(3)28 ℃、160 r/min摇床培养4 h,培养结束后,各管取16 μL进行SDS-PAGE凝胶电泳,选用12%分离胶与5%浓缩胶分离蛋白。将已转入重组质粒的大肠杆菌扩大培养,加入IPTG低温诱导,用组氨酸亲和镍柱蛋白提取试剂盒将蛋白纯化,结束后将流穿液与洗脱峰用SDS-PAGE凝胶电泳验证。
1.4.8 目标蛋白活性的测定
(1)取大肠杆菌BL-21感受态细胞,加入100 mL LB液体培养基中,37 ℃,160 r/min过夜培养。
(2)挑取大肠杆菌BL-21非诱导的单菌落,分别加入到两瓶100 mL含卡那霉素的LB液体培养基中,37 ℃,160 r/min过夜培养。
(3)取100 mL过夜培养的全菌BL-21,加入IPTG进行诱导。
(4)将上述3瓶菌液离心后倒掉上清液,加入等体积的细菌裂解液,超声裂菌后离心,倒掉上清液。按照试剂盒说明书进行操作,作时间梯度,然后利用紫外分光光度仪测定其值。轻晃使其混匀,在530 nm波长下,双蒸水调零,分别测定其吸光值。按公式(1)计算总NOS活性。

式中:Z——总NOS测定值;
B——空白值;
反——反应液体积;
取——取样量;
——比色光径;
——反应时间;
——呈色物纳摩尔消光系数。

式中:——NOS浓度,mol/L;
——比色池长度,cm。

式中:1——入射光强度;
2——透射光强度。
2.1 基因克隆产物的验证
以带有目的基因的质粒为模版,petNO1F、petNO1R为引物,2×Master Mix为酶,进行PCR反应,结果如图1所示。由图1可见,左边第一泳道为DNA Marker,最亮条带大小为1 200 bp,后面四条泳道均为目的基因PCR扩增产物。该DNA Marker产品共有7条DNA条带,从下到上依次为200、500、800、1 200、2 000、3 000、4 500 bp,目的基因大小为1 077 bp。说明克隆相应产物试验成功,该基因GenBank号为CP001615.1。

图1 基因克隆电泳图
采用HⅠ和Ⅲ对基因和Pet-28a载体进行双酶切,使目的基因和载体产生相同的黏性末端,以便成功连接。如图2所示,左边Maker后第一条带为质粒,第二条带为质粒PCR,第三条带为基因酶切,说明基因酶切成功。

图2 基因酶切电泳图
2.2 转化至Top 10中的验证
图3为基因转化至Top 10感受态细胞中的电泳结果图,图中可以明显看到亮带,说明转化成功。选取其中条带较亮的几组菌液作扩大培养。

图3 重组Top 10电泳图
2.3 转化至BL-21中的验证
图4为基因转化至BL-21 中的验证结果图,图中可明显看出亮带,说明转化成功。选取其中条带较亮的几组菌液做扩大培养。
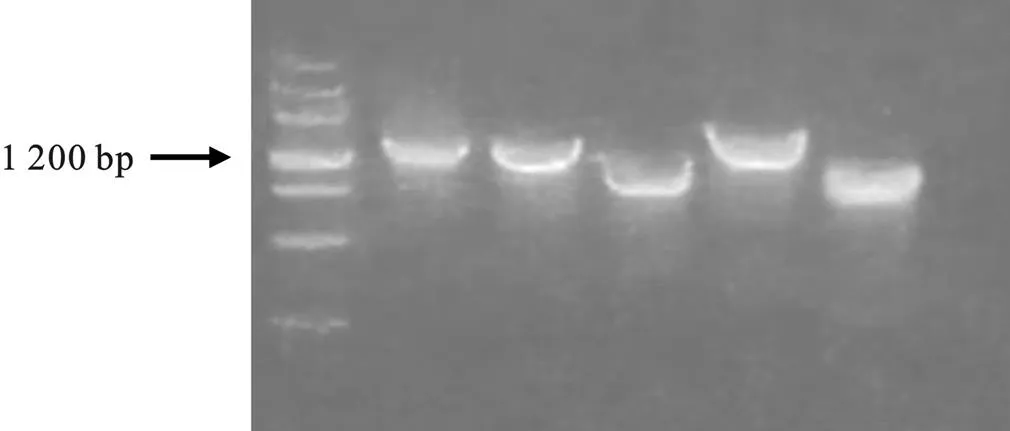
图4 重组BL-21的电泳图
2.4 不同浓度IPTG对目标蛋白的影响
由图5可以看出,随着IPTG浓度的不断增加,目标蛋白的含量却逐渐降低。当IPTG浓度为0.1 mmoL/L时,目标蛋白含量相比较高。说明当IPTG浓度为0.1 mmol/L时,目标蛋白被诱导的效果最好,因此后续试验选择IPTG浓度为0.1 mmol/L。
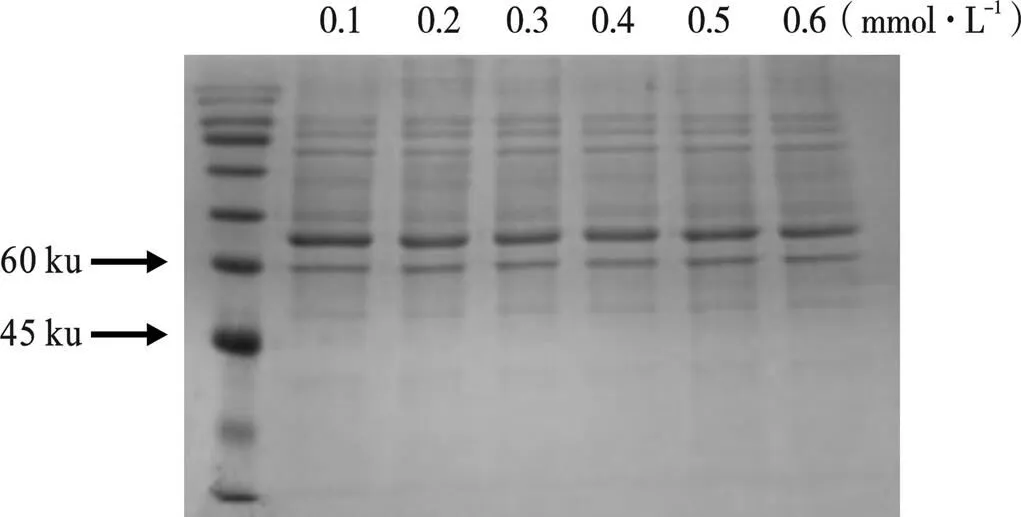
图5 不同IPTG浓度诱导蛋白SDS-PAGE凝胶电泳图
2.5 IPTG诱导时间对目标蛋白的影响
由图6可看出,随着时间慢慢增加,目标蛋白的含量逐渐增大,表明随着诱导时间的延长,IPTG诱导该蛋白的作用不断增强。

图6 不同诱导时间的目标蛋白SDS-PAGE凝胶电泳图
2.6 目标蛋白的镍柱纯化
由图7可以看出,诱导菌液中的目标蛋白含量比非诱导菌液的目标蛋白含量高,除目标蛋白外,流穿液中还含有较多杂蛋白,而洗脱峰中的目标蛋白含量纯度较高。

图7 蛋白纯化效果图
注:1为全菌诱导;
2为全菌非诱导;
3为流穿液;
4~9为洗脱液
2.7 目标蛋白活性测定
由图8可以看出,大肠杆菌BL-21感受态细胞活性随时间增加而降低,在5~15 min内急剧下降,15 min后下降速度变慢。BL-21非诱导的全菌蛋白在5~15 min内下降稍快,而15 min后下降缓慢。BL-21诱导的蛋白在5~10 min有上升趋势,10 min之后随时间增加而降低。由此可见,NOS蛋白活性在5 min时最大。

图8 一氧化氮合成酶活性测定图
植物受到盐胁迫时,由于光合作用效率下降,生长发育受到抑制,细胞膜结构被破坏,NO作为一种重要的小分子信号物质,在植物抵抗NaCl胁迫过程中起到重要作用。樊怀福[4]对外源NO在黄瓜受到NaCl胁迫过程中起的作用进行了深入研究,认为NO通过提高抗坏血酸过氧化物酶和谷胱甘肽还原酶的活性,减轻了盐离子对细胞膜的伤害,提高了黄瓜耐受盐胁迫的能力。本研究通过克隆NOS基因,对提高植物细胞NO水平,进而提高植物耐受盐胁迫的能力提供了一种备选基因。
本研究中设置了不同浓度的IPTG对目标蛋白进行诱导,确定最佳浓度后,再以最佳浓度为基础,筛选出最佳诱导时间,使目标蛋白的诱导效果达到最佳。从电泳图谱及试险数据可以看出,利用IPTG诱导目标蛋白,IPTG的最佳浓度为0.1 mmol/L,随着诱导时间的不断増加,诱导作用也会不断增强。测定NOS蛋白活性时,发现NOS活性随时间增加而降低,5 min时活性最大。分析NOS活性测定图可以看出,非诱导情况下目标蛋白的活性比诱导之后目标蛋白的活性高。这是由于加入诱导剂后,诱导剂抑制了菌体的生长,诱导状态下菌体浓度不如非诱导状态下菌体浓度高,因此目标蛋白的含量也比非诱导低,但诱导与非诱导条件下目标蛋白的活性都较高。
[1] 张新波,黄海鹭,张灵芝,等. 一氧化氮合成酶(NOS)活性的测定及其应用[J]. 北京医科大学学报,1994,26(增刊):173-174.
[2] 马春伟,李禹志. 运动与外周器官一氧化氮及其合成酶关系的研究进展[J]. 文体用品与科技,2013(6):144,154.
[3] 张胜根. 点带石斑鱼组织中一氧化氮合成酶活性及免疫反应性研究[D]. 天津:天津农学院,2011.
[4] 樊怀福. 外源NO缓解黄瓜幼苗盐胁迫伤害的生理基础研究[D]. 南京:南京农业大学,2007.
[5] 邱建华,尹逊河. 一氧化氮及其合成酶的研究进展[J]. 山东畜牧兽医,2003,27(18):37-38.
[6] 雷娅伟. 外源NO对野生早熟禾耐寒性的调控机制[D]. 兰州:甘肃农业大学,2014.
[7] 李典格. 大肠杆菌O114基因簇中β-1-3半乳糖基转移酶基因的功能表征[D]. 天津:南开大学,2013.
[8] SANTISREE P,BHATNAGAR-MATHUR P,SHARMA K. NO to drough-multifunctional role of nitric oxide in plant drought:Do we have all the answers? [J]. Plant Science,2015,239:44-45.
[9] 孟威,何晨阳,文景芝. 一氧化氮合成酶(NOS)研究方法及其在植物中的应用[J]. 东北农业大学学报,2007,38(2):247-252.
[10] KITHAS A C,BROXTERMAN R M,TRINITY J D,et al. Nitric oxide synthase inhibition with N(G)-monomethyl- L-arginine:Determining the window of effect in the human vasculature[J]. Nitric Oxide,2020,104/105:51-60.
[11] 刘巍. 一氧化氮、一氧化氮合成酶及其抑制剂在缺血性脑损伤研究中的进展[J]. 实验动物科学与管理,2006,23(3):42-46.
[12] 蔡维. 一氧化氮在水稻开花及非生物胁迫应答中的功能研究[D]. 武汉:武汉大学,2015.
Gene cloning and functional identification of nitric oxide synthase
Luo Xifan, Zhou Lingmei, Xie Xiaodong, Chen Shuaijun, Yang Hongpeng, Wu JiangCorresponding Author
(College of Agronomy and Resource Environment, Tianjin Agricultural University, Tianjin 300392, China)
As an extremely important biological information molecule, the synthesis of nitric oxide depends on nitric oxide synthase, so nitric oxide synthase plays an irreplaceable role in animals and plants, especially in the growth and development of plants. In this study, the nitric oxide synthase gene of marine bacteriumJM-2 was cloned, the target gene and vector were digested and ligated byHⅠandⅢ, and then by heat shock transformation method the target gene was transferred toTop 10 and BL-21, which was successfully expressed to obtain transformed strains. Then IPTG was used to induce protein expression and purify the protein, and finally the activity of the protein was determined and analyzed. The results showed that when the optimum concentration of IPTG in the medium was 0.1 mmol/L and the induction time was 5 min, the activity of nitric oxide synthase was the highest.
gene cloning; purification of protein; nitric oxide synthase; activity determination
1008-5394(2022)02-0013-05
10.19640/j.cnki.jtau.2022.02.003
Q786
A
2020-11-05
天津市大学生创新创业训练计划项目(202010061098);
天津市科技计划项目(20ZYCGSN00390)
罗希帆(1999—),男,本科在读,主要从事植物转基因方面的研究。E-mail:luoxifan9902@163.com。
吴疆(1976—),男,副教授,博士,主要从事植物分子生物学方面的研究。E-mail:wujiangjack@tjau.edu.cn。
责任编辑:宗淑萍
猜你喜欢 菌液一氧化氮质粒 ——一道江苏高考题的奥秘解读和拓展">农杆菌转化法中的“Ti质粒转化载体系统”的简介——一道江苏高考题的奥秘解读和拓展中学生物学(2022年7期)2022-09-07全基因组测序后质粒的组装与鉴定研究进展*成都医学院学报(2022年4期)2022-08-19不同浓度深色有隔内生真菌浸种对玉米幼苗生长的影响种子(2022年6期)2022-08-03新生儿持续性肺动脉高压应用吸入一氧化氮治疗的临床疗效观察中国典型病例大全(2022年7期)2022-04-22运动凭什么能让血管变年轻家庭医药·快乐养生(2022年4期)2022-04-18运动能让血管变年轻文萃报·周二版(2022年10期)2022-03-19开发新方法追踪植物病害的全球传播(2020.6.7 iPlants)三农资讯半月报(2020年11期)2020-06-21光合细菌在种植业上的应用研究进展江苏农业科学(2020年8期)2020-06-01小鼠转录因子STATl真核表达质粒的构建及生物学功能分析江苏农业学报(2019年1期)2019-09-10假单胞菌HYS菌株对油菜种子发芽的影响湖北农业科学(2017年7期)2017-05-13推荐访问:氧化氮 克隆 基因