色素上皮衍生因子通过调控巨噬细胞极化改善心肌梗死小鼠心功能*
来源:优秀文章 发布时间:2022-12-03 点击:
陆小宁, 王永亮, 王昆, 臧其威
色素上皮衍生因子通过调控巨噬细胞极化改善心肌梗死小鼠心功能*
陆小宁, 王永亮, 王昆, 臧其威△
(宿迁市第一人民医院,江苏 宿迁 223812)
探究色素上皮衍生因子(pigment epithelium-derived factor, PEDF)对心肌梗死(myocardial infarction, MI)小鼠心功能的影响及其机制。将雄性C57BL/6J小鼠分为假手术(sham)组、模型组(MI组)、MI+PEDF过表达对照(MI+vehicle)组和MI+PEDF过表达(MI+PEDF)组。通过左冠状动脉前降支结扎手术构建MI模型。qRT-PCR和Western blot检测小鼠心肌组织PEDF表达;
超声心动图、TTC染色及Masson染色评估小鼠心肌结构变化和心肌损伤情况;
HE染色、免疫组织化学染色及ELISA评估小鼠心肌炎症;
Western blot和流式细胞术评估M1型和M2型巨噬细胞极化;
Western blot检测过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ, PPAR-γ)和核因子κB(nuclear factor-κB, NF-κB)相关蛋白水平。与sham组比较,MI组心肌组织PEDF表达显著降低,心功能出现障碍,心肌炎症程度显著升高,M1型巨噬细胞标志物及NF-κB相关蛋白表达均显著上调,M2型巨噬细胞标志物及PPAR-γ蛋白水平均显著下调(<0.05)。而当PEDF慢病毒载体干预后,PEDF表达显著升高,心功能障碍得到缓解,心肌炎症程度显著降低,M1型巨噬细胞标志物及NF-κB相关蛋白表达均显著下调,M2型巨噬细胞标志物及PPAR-γ蛋白水平均显著上调(<0.05)。PEDF通过上调PPAR-γ和抑制NF-κB促进巨噬细胞M2型极化,从而改善MI小鼠心功能。
色素上皮衍生因子;
心肌梗死;
巨噬细胞;
炎症
由冠状动脉暂时性或永久性血栓形成引起的心肌梗死(myocardial infarction, MI)在全球有较高的发病率和死亡率。MI后心肌组织的病理变化依次为炎症、增殖和坏死[1-2]。在MI的炎症期间,坏死的心肌细胞释放损伤相关蛋白,刺激先天免疫通路和巨噬细胞组织浸润,从而驱动炎症和心肌重塑[3]。在MI的增殖期间,巨噬细胞可通过激活抗炎程序诱导成纤维细胞分化,进而导致梗死区域细胞外基质蛋白的沉积[4]。以上说明,巨噬细胞是一种参与调控MI炎症反应的重要细胞类型。据报道,巨噬细胞M1型与M2型极化的转变在MI中具有重要作用,其中由M1型巨噬细胞调控的过度炎症在MI的发生和发展中具有关键作用,而抗炎性的M2型极化则可有效减轻MI后的炎症反应[5]。然而,介导巨噬细胞参与调控MI的相关机制仍有待探究。
色素上皮衍生因子(pigment epithelium-derived factor, PEDF)是50 kD的内源性分泌多功能蛋白,属于丝氨酸蛋白酶抑制剂超家族[6]。PEDF通常在正常组织中表达,并与许多心血管疾病有关[7]。作为心脏环境的重要调节剂,PEDF在心脏血管的增殖和发育中起重要作用。早期研究显示,PEDF通过上调PPAR-γ来抑制心脏血管生成[8]。然而,MI后PEDF调控过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ, PPAR-γ)对巨噬细胞极化引发的炎症反应的调节作用仍不清楚。因此,本研究通过构建MI小鼠模型,并在其心肌中过表达PEDF,探究PEDF过表达对MI心功能、巨噬细胞极化以及炎症反应的调节机制,以期为PEDF改善MI后的心功能提供新的参考。
1 实验对象
8~10周龄雄性C57BL/6J小鼠购自北京科宇动物养殖中心公司,生产许可证号为SCXK(京)2017-0002。
2 试剂
PEDF慢病毒载体及其病毒颗粒对照(vehicle)购自上海吉玛(GenePharma)制药技术有限公司;
TRIzol试剂(R0016)和cDNA合成试剂盒(D7170L)购自上海碧云天(Beyotime)生物技术有限公司;
SuperReal PreMix Plus (SYBR Green,FP205)购自天根(TIANGEN)生化科技(北京)有限公司;
PEDF抗体(ab227295)、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)抗体(ab178945)、白细胞介素12(interleukin-12, IL-12)抗体(ab133751)、精氨酸酶1(arginase-1,Arg-1)抗体(ab233548)、树突状细胞相关C型凝集素1(dendritic cell-associated C-type lectin-1, dectin-1)抗体(ab140039)、PPAR-γ抗体(ab272718)、核因子κB(nuclear factor-κB, NF-κB) p65抗体(ab207297)、磷酸化NF-κB(phosphorylated NF-κB, p-NF-κB) p65抗体(ab239882)、IκBα抗体(ab32518)、磷酸化IκBα(phosphorylated IκBα, p-IκBα)抗体(ab133462)、GAPDH抗体(ab8245)、CD86抗体(ab239075)、F4/80抗体(ab16911)、CD16抗体(ab246222)和CD206抗体(ab270647)均购自Abcam;
2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)染色液(SH-0451)购自北京凯诗源生物科技有限公司;
Masson染色液(WLA045a)和HE染色试剂盒(WLA051a)购自沈阳万类生物科技有限公司;
肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) ELISA试剂盒(70-EK282/3)和IL-6 ELISA试剂盒(70-EK206/3-24)购自杭州联科生物技术有限公司。
3 方法
3.1MI小鼠模型构建和分组MI小鼠模型根据先前公布的左冠状动脉前降支(left anterior descending coronary artery, LAD)结扎手术法[9]构建,以小鼠活动减弱、左心室前壁颜色变白和心电图V2导联显示ST段抬高为判定造模成功的标准。简而言之,在麻醉后,将小鼠胸腔左侧第3、4肋间隙切开一个长约5 mm的切口;
打开心包后,用7-0普里林缝合线结扎LAD。假手术小鼠除未结扎LAD,其余程序均相同。及时对造模失败或死亡的小鼠补齐。
所有动物实验均经本医院动物护理和使用委员会的批准。将小鼠分为以下4组:假手术(sham)组、模型组(MI组)、MI+PEDF过表达对照(MI+vehicle)组和MI+PEDF过表达(MI+PEDF)组。除了sham组之外的其余小鼠在MI模型构建成功后均分为3组,每组24只。MI+vehicle组和MI+PEDF组采用心肌直接注射的方法,分别于MI的第7~28天每隔一天在梗死边缘通过30号针头将vehicle或PEDF(10 mg/kg)注射到心肌内。闭合肋间伤口,将胸腔负压抽取后缝合切口,等到小鼠可以自主呼吸后拔出气管插管。实验结束后,将小鼠麻醉并实施安乐死,随后收集心肌组织。
3.2qRT-PCR检测使用TRIzol试剂提取各组小鼠心肌组织总RNA,并通过cDNA合成试剂盒合成cDNA。使用GeneAmp 7700型荧光定量PCR仪(Applied Biosystems)通过SYBR Green将cDNA用于qRT-PCR检测。内参照为GAPDH。采用2-ΔΔCt法对目的基因的相对表达水平进行计算。PEDF正向引物序列为5"-CTACGATCTGTACCGCCTGA-3",反向引物序列为5"-GTTCAGCTCCCAGAGAAAGG-3";
GAPDH正向引物序列为5"-AACTTTGGCATTGTGGAAGG-3",反向引物序列为5"-ACACATTGGGGGTAGGAACA-3"。
3.3Western blot分析从各组小鼠心肌组织提取总蛋白,通过SDS-PAGE将蛋白质分离后转移到PVDF膜上,将蛋白质与Ⅰ抗(PEDF、iNOS、IL-12、Arg-1、dectin-1、PPAR-γ、p-NF-κB p65、NF-κB p65、p-IκBα、IκBα和内参照GAPDH抗体,均以1∶1 000稀释)在4 ℃下孵育过夜。孵育Ⅱ抗后通过ECL发光试剂显影并由ChemiDoc MP成像系统(Bio-Rad)捕获图像。
3.4超声心动图评估如前人所述[10],对小鼠进行胸超声心动图检测。1.5%异氟醚麻醉小鼠,使用10 MHz线性阵列超声转换器进行超声心动图检测以获得M型超声心动图数据。获取左心室舒张末期内径(left ventricular end-diastolic diameter, LVEDd)和左心室收缩末期内径(left ventricular end-systolic diameter, LVESd),计算左心室射血分数(left ventricular ejection fraction, LVEF)和左心室短轴缩短率(left ventricular fractional shortening, LVFS)。每组至少6只小鼠接受胸超声心动图检查。
3.5组织学分析如文献所述[10],各组小鼠随机取6只小鼠,经静脉注射1% TTC后处死并取出心脏组织,将心脏组织包埋并切成1 mm厚的切片,固定后通过显微镜观察评估MI小鼠心肌梗死面积。心肌梗死面积(%)=切片白色梗死面积/切片总面积×100%。
接受胸超声心动图检查6只小鼠的6个心脏组织用多聚甲醛固定后包埋在石蜡中,切成5 μm切片后进行Masson染色,蓝色区域表示瘢痕,通过ImageJ软件对左心室的瘢痕周长进行测量。同时对组织切片(4 μm)进行HE染色,在光学显微镜下观察炎症细胞浸润,并进行组织病理学评分。瘢痕周长(%)=切片蓝色瘢痕周长/切片总周长×100%。以炎症细胞浸润来评估组织学得分:无浸润为0分,<5%为1分,5%~25%为2分,25%~50%为3分,50%~75%为4分,>75%为5分。
对巨噬细胞进行CD86免疫组织化学染色:切片脱水后在高温高压下进行抗原修复,使用8%山羊血清封闭;
将切片与CD86抗体(1∶100)一起孵育过夜。使用Ⅱ抗孵育后通过DAB试剂盒进行着色。统计每组切片中CD86的细胞数量(每个切片6个视野)。
3.6ELISA分析收集各组心肌组织,匀浆后收集上清液,应用TNF-α和IL-6相应的ELISA试剂盒检测二者的表达情况。
3.7流式细胞术将从各组小鼠(每组6只)中取出的心肌组织切成小块,并添加含100 mg/L胶原酶IV的PBS消化。经过5次消化后,样品通过100 µm尼龙细胞过滤器过滤、离心并重新悬浮。用红细胞裂解液(600 µL)去除红细胞,然后用10 mL FACS缓冲液洗涤细胞,收获细胞并用含有3%牛血清白蛋白封闭30 min,并用F4/80、CD16和CD206抗体及相应Ⅱ抗孵育。随后上流式细胞仪进行检测,使用ExpressPlus程序。用FITC同种型和PE同种型孵育的细胞以排除荧光抗体的非特异性结合。M1型巨噬细胞定义为F4/80+和CD16+;
M2型巨噬细胞定义为F4/80+和CD206+。
4 统计学分析
实验数据使用均数±标准差(mean±SD)表示。组间差异通过单因素方差分析和Turkey检验进行分析。<0.05表示差异有统计学意义。
1 PEDF在MI小鼠心肌组织中的表达情况
如图1所示,MI组心肌组织中PEDF的表达水平明显低于与sham组(<0.05),而PEDF慢病毒载体转染后PEDF的表达水平明显增高(<0.05)。
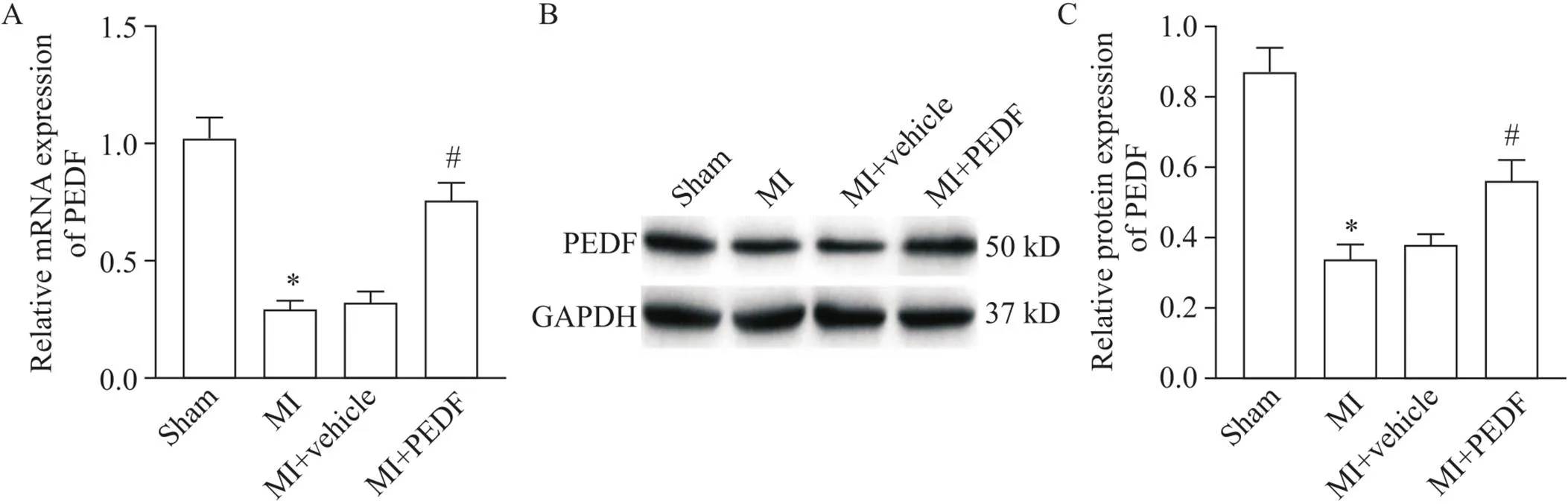
Figure 1. The mRNA (A) and protein (B) expression of PEDF in myocardial tissue of MI mice. Mean±SD. *P<0.05 vs sham group;
#P<0.05 vs MI+vehicle group.
2 PEDF过表达改善小鼠MI后的心功能障碍
如表1和图2所示,MI模型小鼠的心功能明显降低,主要体现在LVEDd和LVESd显著增加,LVEF和LVFS显著降低,同时心肌梗死面积和瘢痕周长均显著增加(<0.05);
PEDF慢病毒载体转染后,小鼠心功能明显改善,即LVEDd和LVESd显著减小,LVEF和LVFS显著升高,且心肌梗死面积和瘢痕周长均显著减少(<0.05)。

表1 PEDF过表达可减少小鼠MI后的心功能不全
*<0.05 vs sham group;
#<0.05 vs MI+vehicle group.

Figure 2. Effects of PEDF overexpression on infarction area (A;
TTC staining) and scar circumference (B;
Masson staining) in myocardial tissue of MI mice. Mean±SD. n=6. *P<0.05 vs sham group;
#P<0.05 vs MI+vehicle group.
3 PEDF过表达减轻小鼠MI后的心肌炎症
如图3和表2所示,sham组小鼠心肌组织排列整齐,细胞核染色均匀,大小均一;
而MI模型小鼠心肌组织出现大量炎症细胞浸润,心肌细胞排列紊乱,细胞核破坏严重;
MI+vehicle组与之相似,而MI+vehicle组中小鼠的心肌病理损伤较MI组明显减轻。具体表现为:与sham组相比,MI组组织学评分显著升高,CD86标记的巨噬细胞数量显著增多,且炎症细胞因子TNF-α和IL-6水平显著上调(<0.05);
与MI+vehicle组相比,MI+PEDF组组织学评分显著降低,CD86标记的巨噬细胞数量显著减少,且炎症细胞因子TNF-α和IL-6水平显著下调(<0.05)。
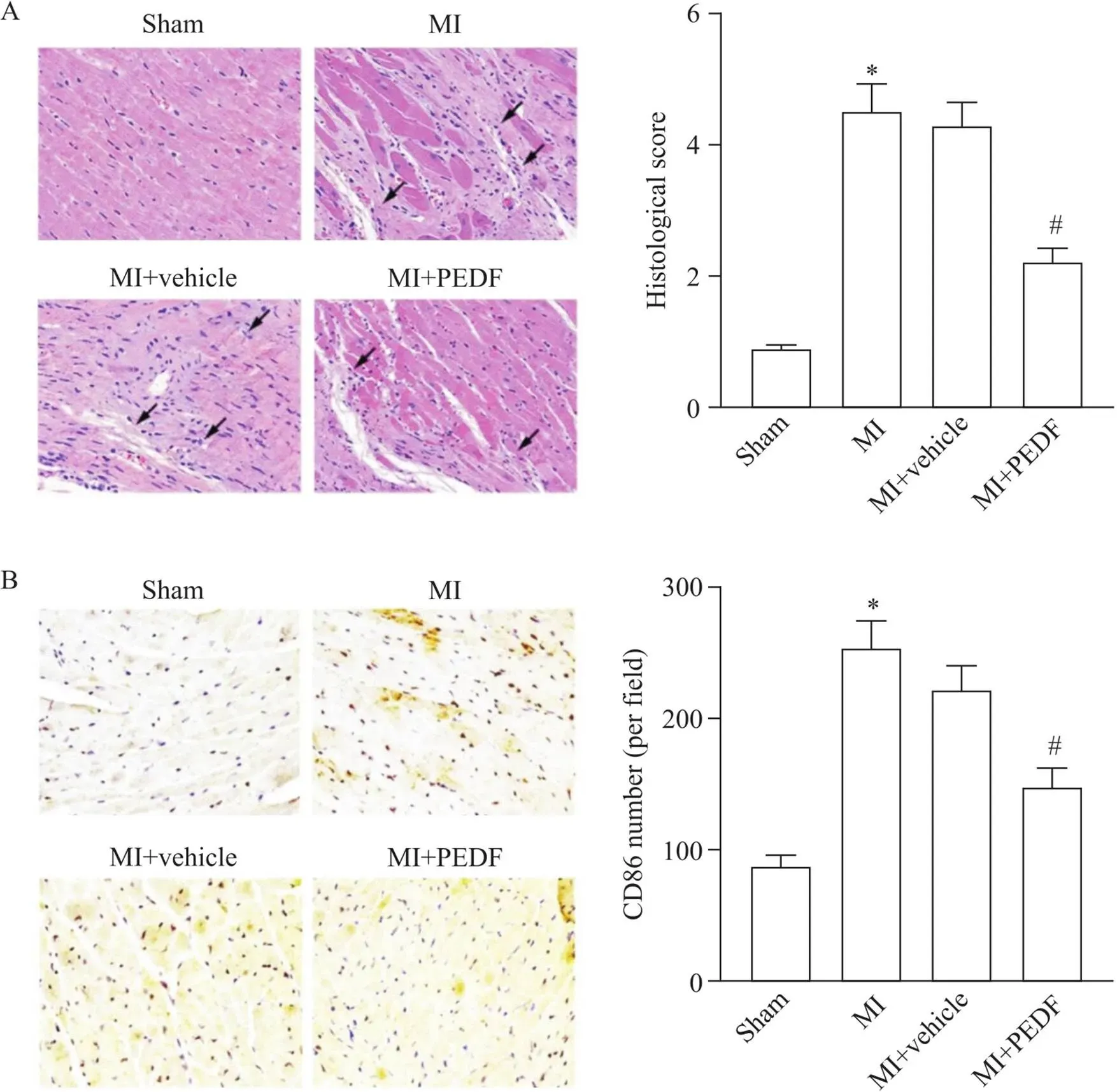
Figure 3. Effect of PEDF overexpression on inflammation in myocardial tissue of MI mice. A:
HE staining of mouse myocardial tissue (arrows indicate lesion areas;
×200);
B:
immunohistochemical staining for CD86 in mouse myocardial tissue (×200). Mean±SD. n=6. *P<0.05 vs sham group;
#P<0.05 vs MI+vehicle group.

表2 PEDF过表达可降低MI小鼠心肌组织炎症细胞因子水平
*<0.05sham group;
#<0.05MI+vehicle group.
4 PEDF过表达促进M1型巨噬细胞向M2型转化
如图4所示,与sham组相比,MI组巨噬细胞M1极化标志物iNOS和IL-12表达及CD16+细胞比例均显著升高,巨噬细胞M2极化标志物Arg-1和dectin-1表达及CD206+细胞比例均显著降低(<0.05);
与MI+vehicle组相比,MI+PEDF组iNOS和IL-12表达及CD16+细胞比例均显著降低,Arg-1和dectin-1表达及CD206+细胞比例均显著升高(<0.05)。

Figure 4. Overexpression of PEDF promoted polarization of M2 macrophages from M1 macrophages. A:
the protein levels of iNOS, IL-12, Arg-1 and dectin-1 were detected by Western blot;
B:
the expression levels of CD16 and CD206 were detected by flow cytometry. Mean±SD. n=6. *P<0.05 vs sham group;
#P<0.05 vs MI+vehicle group.
5 PEDF过表达上调PPAR-γ的表达,抑制NF-κB的激活
如图5所示,与sham组相比,MI组心肌组织中PPAR-γ表达显著下调,而p-NF-κB p65和p-IκBα表达均显著上调(<0.05);
与MI+vehicle组比较,MI+PEDF组心肌组织中PPAR-γ表达显著上调,而p-NF-κB p65和p-IκBα表达均显著下调(<0.05)。
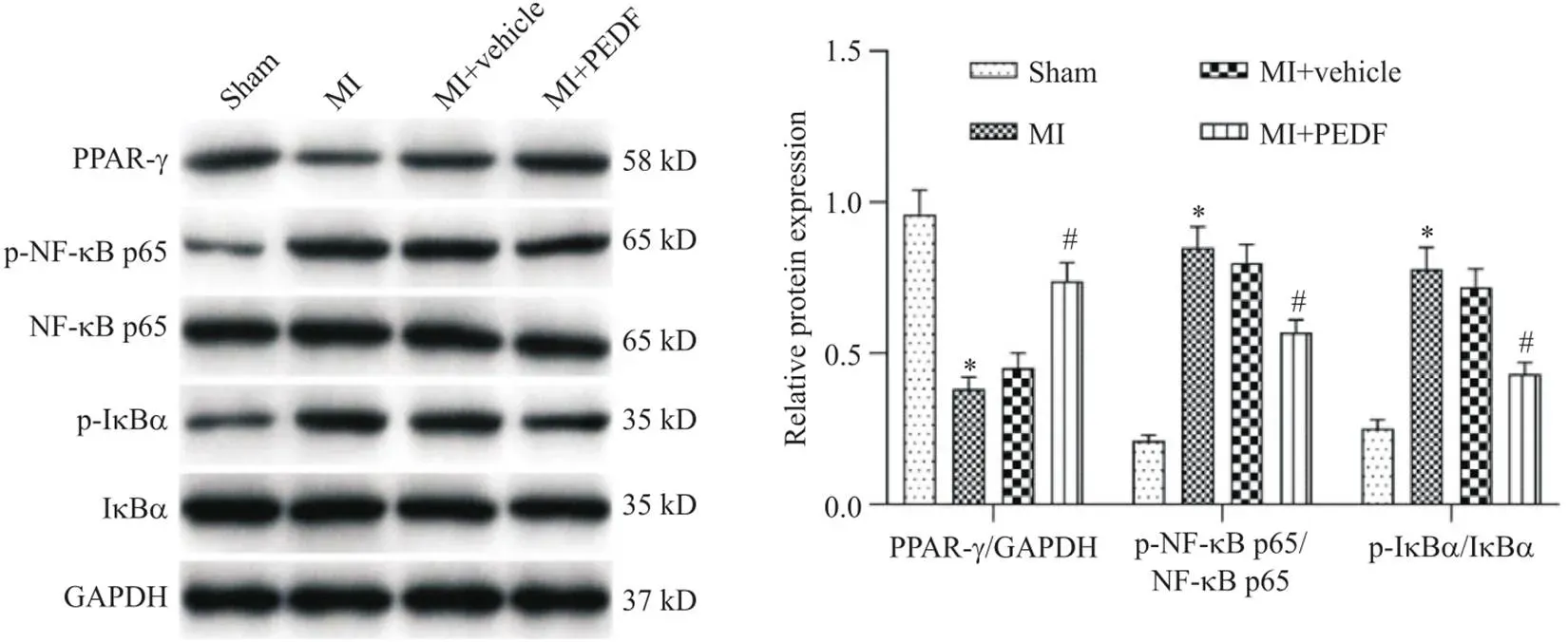
Figure 5. The effect of PEDF overexpression on the expression of PPAR-γ and NF-κB detected by Western blot. Mean±SD. n=6. *P<0.05 vs sham group;
#P<0.05 vs MI+vehicle group.
由先天免疫系统导致的炎症反应在MI后的心功能障碍过程中具有重要作用,MI后的先天免疫系统和炎症反应可通过调节心功能的稳态来进行心脏修复。然而,过度的炎症反应会使心功能恶化,进而发生不良的重塑[11]。巨噬细胞已被公认为MI后炎症和纤维化的重要调节剂和参与者[12]。本研究结果显示,MI后PEDF表达下调,暗示PEDF可能对心功能恶化具有促进作用。进一步研究显示,巨噬细胞的M2型极化和PPAR-γ介导的抑炎信号是PEDF在MI中发挥心功能保护作用的重要机制。本研究揭示了PEDF在MI的病理过程中发挥的作用及相关机制。
PEDF是丝氨酸蛋白酶抑制剂超家族的非抑制性成员,在多种人体组织中广泛表达,尤其是在心脏组织中[13]。以往研究表明,PEDF在正常心脏和梗死心肌中均显示出多种生物学效应。据报道,PEDF可以通过抗氧化机制改善缺血性心功能,保护培养的H9c2细胞和原代心肌细胞在缺氧条件下免于凋亡和坏死性凋亡[14]。Zhang等[15]研究表明,PEDF可以通过减少细胞凋亡、抑制血管通透性和限制MI后梗死面积来改善小鼠心功能。本研究结果显示,在MI后过表达PEDF可有效改善心功能,表明PEDF在MI后发挥心脏保护作用。另外,模型组中出现了部分梗死,分析可能的原因是在饲养过程中由于环境或饮食引发部分小鼠出现其他引发梗死病变的疾病,如冠心病、动脉粥样硬化等,但具体造成这种情况的原因还需进一步分析。正常情况下,LVEDd越大、LVESd越小,说明心肌舒张和收缩功能越好。而在本研究中MI模型中出现了LVEDd和LVESd共同增大,猜测其可能的原因是出现了小鼠扩张性心脏病。
越来越多的证据表明,炎症反应是愈合过程和心肌梗死后重塑的重要事件。MI后的心脏修复由强烈的组织炎症启动,然后是主动抑制或消退[16]。许多细胞或分子因素影响MI后伤口的愈合和修复。组织再生高度依赖于巨噬细胞的表型或极化状态[17]。此外,巨噬细胞通常分为2种表型:M1(促炎)和M2(抗炎)。M1型巨噬细胞分泌各种促炎细胞分子,如TNF-α、IL-6、IL-12和iNOS等,所有的这些都会导致炎症的发生;
相比之下,M2型巨噬细胞下调促炎因子,上调抗炎细胞因子等[18]。本研究结果显示,MI后小鼠心肌组织中炎症水平升高,心肌组织中巨噬细胞以促炎的M1型细胞为主;
而在PEDF过表达后,促炎因子(TNF-α和IL-6)及M1型相关因子(IL-12、iNOS和CD16)表达均被明显抑制,而M2型相关因子(Arg-1、dectin-1和CD206)表达被显著促进,表明PEDF可通过促进巨噬细胞向M2型转化进而降低炎症反应。然而,PEDF是如何调控巨噬细胞M2型极化尚未可知。
已有研究证实,PEDF上调PPAR-γ抑制心脏血管生成[8]。于是,推测PPAR-γ可能在PEDF调控巨噬细胞极化中发挥重要作用。PPAR-γ是核受体PPAR亚家族的成员,在包括心肌在内的多种组织中广泛表达[19]。研究显示,激活PPAR-γ可通过调节巨噬细胞极化进而减轻肝纤维化[20]。Zhou等[21]研究证实,上调PPAR-γ可减轻MI后的病理性心脏重构。另外,PPAR-γ可以通过与NF-κB相互作用来调节炎症反应[22]。且有研究证实,在MI后激活PPAR-γ表达,抑制NF-κB表达有助于改善心功能[23]。本研究结果显示,MI后的心肌组织中PPAR-γ表达降低,NF-κB通路相关蛋白(p-NF-κB p65和p-IκBα)的表达均升高,而PEDF过表达可明显逆转MI模型中PPAR-γ和NF-κB的表达情况。表明PEDF可通过激活PPAR-γ,抑制NF-κB信号转导进而调节巨噬细胞极化,对MI小鼠心功能发挥保护作用。
综上所述,本研究证明PEDF可通过激活PPAR-γ促进M1型巨噬细胞向M2型巨噬细胞转化,进而改善MI小鼠心功能。本研究为MI后心功能障碍的预防和治疗提供了一个有前景的分子靶点。
[1] Markwerth P, Bajanowski T, Tzimas I, et al. Sudden cardiac death-update[J]. Int J Legal Med, 2021, 135(2):483-495.
[2]刘畅, 程晓丹, 孙家安, 等. 丹酚酸B通过调控Cx43抑制铁死亡对心肌梗死大鼠模型的保护机制研究[J]. 中国病理生理杂志, 2022, 38(6):1032-1039.
Liu C, Cheng XD, Sun JA, et al. Salvianolic acid B inhibits ferroptosis through Cx43 in myocardial infarction rat model[J]. Chin J Pathophysiol, 2022, 38(6):1032-1039.
[3] Daseke MJ, Tenkorang-Impraim MAA, Ma Y, et al. Exogenous IL-4 shuts off pro-inflammation in neutrophils while stimulating anti-inflammation in macrophages to induce neutrophil phagocytosis following myocardial infarction[J]. J Mol Cell Cardiol, 2020, 145(42):112-121.
[4] Wang Y, Li C, Zhao R, et al. CircUbe3a from M2 macrophage-derived small extracellular vesicles mediates myocardial fibrosis after acute myocardial infarction[J]. Theranostics, 2021, 11(13):6315-6333.
[5] Qu D, Guo H, Xu Y. Effects of tranilast on inflammasome and macrophage phenotype in a mouse model of myocardial infarction[J]. J Interferon Cytokine Res, 2021, 41(3):102-110.
[6] Miller I, Bar-Joseph H, Nemerovsky L, et al. Pigment epithelium-derived factor (PEDF) negates hyperandrogenic PCOS features[J]. J Endocrinol, 2020, 245(2):291-300.
[7] Riabinska A, Zille M, Terzi MY, et al. Pigment epithelium-derived factor improves paracellular blood-brain barrier integrity in the normal and ischemic mouse brain[J]. Cell Mol Neurobiol, 2020, 40(5):751-764.
[8] Zhang H, Wei T, Jiang X, et al. PEDF and 34-mer inhibit angiogenesis in the heart by inducing tip cells apoptosis via up-regulating PPAR-γ to increase surface FasL[J]. Apoptosis, 2016, 21(1):60-78.
[9] Xie S, Deng W, Chen J, et al. Andrographolide protects against adverse cardiac remodeling after myocardial infarction through enhancing Nrf2 signaling pathway[J]. Int J Biol Sci, 2020, 16(1):12-26.
[10] Cheng XJ, Li L, Xin BQ. MiR-124 regulates the inflammation and apoptosis in myocardial infarction rats by targeting STAT3[J]. Cardiovasc Toxicol, 2021, 21(9):710-720.
[11] Mentkowski KI, Euscher LM, Patel A, et al. Monocyte recruitment and fate specification after myocardial infarction[J]. Am J Physiol Cell Physiol, 2020, 319(5):C797-C806.
[12] Kim Y, Nurakhayev S, Nurkesh A, et al. Macrophage polarization in cardiac tissue repair following myocardial infarction[J]. Int J Mol Sci, 2021, 22(5):2715-2726.
[13] Yang X, Wang L, Zhang Z, et al. Ginsenoside Rb1enhances plaque stability and inhibits adventitial vasa vasorum via the modulation of miR-33 and PEDF[J]. Front Cardiovasc Med, 2021, 8:654670.
[14] Zhao Q, Liu Z, Huang B, et al. PEDF improves cardiac function in rats subjected to myocardial ischemia/reperfusion injury by inhibiting ROS generation via PEDF‑R[J]. Int J Mol Med, 2018, 41(6):3243-3252.
[15] Zhang H, Wang Z, Feng SJ, et al. PEDF improves cardiac function in rats with acute myocardial infarction via inhibiting vascular permeability and cardiomyocyte apoptosis[J]. Int J Mol Sci, 2015, 16(3):5618-5634.
[16] 冯康尼, 孟平, 张敏, 等. IL-24调控巨噬细胞极化介导气道炎症在过敏性哮喘小鼠中的作用[J]. 中国病理生理杂志, 2022, 38(7):1201-1209.
Feng KN, Meng P, Zhang M, et al. Role of IL-24 in regulating macrophage polarization and airway inflammation in allergic asthmatic mice[J]. Chin J Pathophysiol, 2022, 38(7):1201-1209.
[17] Whitehead AJ, Engler AJ. Regenerative cross talk between cardiac cells and macrophages[J]. Am J Physiol Heart Circ Physiol, 2021, 320(6):H2211-H2221.
[18] Han H, Dai D, Du R, et al. Oncostatin M promotes infarct repair and improves cardiac function after myocardial infarction[J]. Am J Transl Res, 2021, 13(10):11329-11340.
[19] Zhang XD, Sun GX, Guo JJ, et al. Effects of PPARγ agonist pioglitazone on cardiac fibrosis in diabetic mice by regulating PTEN/AKT/FAK pathway[J]. Eur Rev Med Pharmacol Sci, 2021, 25(2):812-819.
[20] Chen Q, Bao L, Lv L, et al. Schisandrin B regulates macrophage polarization and alleviates liver fibrosis via activation of PPARγ[J]. Ann Transl Med, 2021, 9(19):1500-1516.
[21] Zhou Y, Yin T, Shi M, et al. Nobiletin attenuates pathological cardiac remodeling after myocardial infarction via activating PPARγ and PGC1α[J]. PPAR Res, 2021, 19(21):994-1013.
[22] Lu J, Guan H, Wu D, et al. Pseudolaric acid B ameliorates synovial inflammation and vessel formation by stabilizing PPARγ to inhibit NF-κB signalling pathway[J]. J Cell Mol Med, 2021, 25(14):6664-6678.
[23] Lv FH, Yin HL, He YQ, et al. Effects of curcumin on the apoptosis of cardiomyocytes and the expression of NF-κB, PPAR-γ and Bcl-2 in rats with myocardial infarction injury[J]. Exp Ther Med, 2016, 12(6):3877-3884.
Pigment epithelium-derived factor improves cardiac function in mice with myocardial infarction by regulating macrophage polarization
LU Xiao-ning, WANG Yong-liang, WANG Kun, ZANG Qi-wei△
(,223812,)
To explore the effect of pigment epithelium-derived factor (PEDF) on cardiac function in mice with myocardial infarction (MI) and its mechanism.Male C57BL/6J mice were randomly divided into sham group, model group (MI group), MI+PEDF overexpression control (MI+vehicle) group and MI+PEDF overexpression (MI+PEDF) group. The MI model was constructed by ligation of the left anterior descending coronary artery. The expression of PEDF in mouse myocardial tissues was detected by qRT-PCR and Western blot. Cardiac structural changes and myocardial injury in mice were assessed by echocardiography, TTC staining and Masson staining. Myocardial inflammation in mice was assessed by HE staining, immunohistochemical staining and ELISA. Western blot and flow cytometry were used to assess M1 and M2 macrophage polarization. The levels of peroxisome proliferator-activated receptor-γ (PPAR-γ) and nuclear factor-κB (NF-κB)-related proteins were detected by Western blot.Compared with sham group, the expression of PEDF in the myocardial tissue of the mice in MI group was significantly decreased, the cardiac function was impaired, and the degree of myocardial inflammation was significantly increased. The expression levels of M1 macrophage markers and NF-κB-related proteins were significantly up-regulated, while the expression levels of M2 macrophage markers and PPAR-γ protein were significantly down-regulated (<0.05). After the intervention of PEDF lentiviral vector, the expression of PEDF in the myocardial tissue was significantly increased, the cardiac dysfunction was relieved, and the degree of myocardial inflammation was significantly reduced. The expression levels of M1 macrophage markers and NF-κB-related proteins were significantly down-regulated, while the expression levels of M2 macrophage markers and PPAR-γ protein were significantly up-regulated (<0.05).Overexpression of PEDF promotes M2 macrophage polarization via up-regulating PPAR-γ and inhibiting NF-κB, thus improving the cardiac function in MI mice.
Pigment epithelium-derived factor;
Myocardial infarction;
Macrophages;
Inflammation
1000-4718(2022)09-1600-08
2022-05-20
2022-08-07
18012186865;
E-mail:
jssqzqw@163.com
R542.2+2;
R363.2
A
10.3969/j.issn.1000-4718.2022.09.009
[基金项目]宿迁市科技计划项目(No. K202008)
(责任编辑:卢萍,罗森)
猜你喜欢 极化切片心肌 活跃在高考中的一个恒等式民族文汇(2022年23期)2022-06-10极化雷达导引头干扰技术研究航天电子对抗(2022年2期)2022-05-24超声诊断心肌淀粉样变性伴心力衰竭1例中国典型病例大全(2022年10期)2022-05-10心肌桥是什么病?保健与生活(2021年11期)2021-06-10新局势下5G网络切片技术的强化思考科学与财富(2020年15期)2020-07-045G网络切片技术增强研究移动通信(2020年4期)2020-05-07查出“心肌桥”怎么办家庭医药(2019年8期)2019-08-27网络切片标准分析与发展现状移动通信(2019年4期)2019-06-25极低场核磁共振成像系统中预极化线圈的设计智富时代(2018年5期)2018-07-18极低场核磁共振成像系统中预极化线圈的设计智富时代(2018年5期)2018-07-18推荐访问:心肌梗死 小鼠 极化