m6A甲基转移酶METTL3介导miR-127调控非小细胞肺癌细胞系自噬的机制研究
来源:优秀文章 发布时间:2022-12-03 点击:
伍义文,曹健斌,黄维佳,何凌云(柳州市人民医院心胸外科,广西柳州 545006)
非小细胞肺癌(non small cell lung cancer cells,NSCLC)是肺癌中最常见的类型,是根据肿瘤主体的生物学特性和对治疗的敏感性来进行区分的,大约占肺癌的80%~85%[1]。早期肺癌的发病人群大多是男性,但近年来研究发现,女性非小细胞肺癌的发病比例也逐年增加,并逐渐趋于年轻化[2]。因此,探索非小细胞肺癌靶向分子标志物,阐明其发生发展机制,对于临床治疗非小细胞肺癌具体方案的制定有十分重要的意义。甲基转移酶3(methyltransferase-like 3,METTL3)是哺乳动物N6 腺苷甲基转移酶复合体的关键组成部分,在mRNA,tRNA,rRNA,microRNA 前体和长非编码RNA等多种基因中对N6甲基腺苷(m6A)进行修饰,可作为m6A甲基化的编码器,通过不同的调控途径参与肿瘤的发生发展[3-4]。有研究发现METTL3可以通过甲基化CCNE1 mRNA 3’非翻译区(UTR)中的m6A 位点来促进直肠癌细胞增殖,下调METTL3和相关细胞周期蛋白cyclin E1的表达来抑制细胞增殖,阻滞细胞周期,是治疗直肠癌的一种有效策略[5]。miR-127 作为具有调控作用的非编码微小RNA,与多种疾病的发生密切相关[6]。如研究百令胶囊通过下调miR-127 抑制巨噬细胞的增殖和吞噬作用,减少炎性细胞因子TNF-α,IL-1和IL-6的释放,从而减轻狼疮性肾炎的进一步发展[7]。目前,关于METTL3和miR-127 在非小细胞肺癌中的表达及调控关系鲜有报道,故本研究着重分析了METTL3和miR-127 在非小细胞肺癌细胞系中的表达及它们之间的关系,探讨METTL3介导miR-127对非小细胞肺癌自噬的调控机制。
1.1 研究对象 正常肺上皮细胞BEAS-2B,非小细胞肺癌细胞HCC827,A549和H460(均购自中国科学院细胞库)。
1.2 试剂与仪器 RPMI1640 培养液、胎牛血清(Gibico 公司);
PCR 引物(上海生工生物工程公司合成);
RNA 提取盒,RNA 逆转录试剂盒(北京全式金生物技术有限公司);
吖啶橙,Lyso-Tracker Red(上海碧云天生物技术有限公司);
PTEN,p-AKT,p-mTOR,ULK1,Beclin-1抗体(Cell signaling technology 公司);
LipofectAMINE 2000 细胞转染试剂(美国Invitrogen 公司)。
1.3 方法
1.3.1 细胞培养:BEAS-2B,HCC827,A549和H460 细胞均用10ml/dl 胎牛血清配置的RPMI1640培养液,培养于37 ℃ 5ml/dl CO2孵育箱中,用80%的细胞密度进行传代,待细胞长至取对数生长期后,进行后续实验。
1.3.2 qRT-PCR 检测各细胞系中METTL3和miR-127的表达:分别取对数生长期的各组细胞,严格按照试剂盒相关步骤进行总RNA的提取,提取结束后吸取2 μl RNA 样品用来检测其纯度,A260nm/A280nm的比值一般在1.6~1.8 之间即可;
使用反转录试剂盒合成第一链cDNA ,反应体系20 μl ,逆转录反应条件:37℃ 15 min(反转录反应),85℃ 5 s(反转录酶的失活反应);
用逆转录合成的cDNA作为模板进行RT-PCR 扩增,扩增体系为20 μl,其中SYBR Premix ExTaq Ⅱ(2×)10 μl,cDNA 2 μl,上下游引物各1 μl,ROX Reference Dye Ⅱ(50×)0.5 μl,ddH2O 5.5 μl,实时PCR 条件:94 ℃ 5 min,94℃ 30 s,60℃ 30 s,72℃ 20 s,循环35 次,4℃保存备用;
采用荧光定量PCR 仪进行实时荧光PCR 检测,分别以β-actin和U6 作为METTL3和miR-127 内参,根据RT-PCR 反应结果中的Ct值,采用2-ΔΔCt相对定量法分析目的基因相对表达。
1.3.3 METTL3和miR-127 相关性研究:利用Linked Domic 数据库查找在肺癌中与miR-127表达具有相关性的靶基因,分析其与METTL3 间的相关性。检索文献筛选出miR-127与自噬相关的下游因子,构建METTL3介导miR-127调控非小细胞肺癌自噬的通路。
1.3.4 细胞转染:取对数生长期的H460 细胞接种于6 孔板,待细胞生长至融合时,随机分为三组,即转染沉默载体(METTL3-siR 组)、阴性表达载体(NC-siR 组)及空白对照(Control 组),按LipofectAMINE 2000 转染试剂说明书进行瞬时转染,转染6 h 后换新鲜的培养液继续培养,转染48h后采用qRT-PCR 法验证转染情况。
1.3.5 抑制METTL3表达对细胞自噬的影响:吖啶橙染色:取对数生长期的H460 细胞接种于6 孔板,培养48 h 后,弃去培养液,加入用PBS 稀释至0.01%的吖啶橙染液,室温避光染色5 min,荧光显微镜下520 nm 激发光观察酸性自噬小体并拍照。Lyso-Tracker Red 染色:取对数生长期的H460 细胞接种于6 孔板,培养48 h 后,弃去培养液,加入50nmol/L的Lyso-Tracker Red 染料,37℃条件下避光染色1 h,PBS 润洗2 次后,加入Hoechst 33342染液避光复染20 min,PBS 清洗后荧光显微镜观察自噬溶酶体数量并拍照。
1.3.6 Western blot 检测自噬相关蛋白的表达:取对数生长期各组细胞,加入细胞裂解液充分裂解后,4℃,12 000 r/min 离心取上清液,BCA 试剂盒检测样品中蛋白浓度。若蛋白浓度相差过大,需要将样品的蛋白浓度调至一致。将调整后样品加入loading buffer,混匀煮沸10 min,恢复至室温后离心,配置8%分离胶,在分离胶上面距顶端3 cm 处加入浓缩胶,加入蛋白样品后,80 V 浓缩,120 V分离,电泳结束后转NC 膜2 h,脱脂奶粉室温封闭2 h,PBST 洗膜、加入一抗4℃孵育过夜,PBST 洗膜三次后加入二抗,室温孵育2 h,PBST 漂洗3 次后采用化学发光法进行显色,凝胶成像仪观察拍照,并用Image-J 软件分析各组蛋白相对表达。
1.4 统计学分析 应用SPSS 22.0分析数据,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验;
相关性分析用Pearson 法。以P<0.05 为差异有统计学意义。
2.1 正常肺上皮细胞和非小细胞肺癌细胞系中METTL3和miR-127表达情况 qRT-PCR 检测显示,非小细胞肺癌细胞系HCC827,A549和H460中METTL3相对表达分别为1.35±0.17,1.54±0.11,1.78±0.21,较正常肺上皮细胞BEAS-2B 中表达(0.91±0.11)显著升高,差异有统计学意义(F=34.037,P=0.002)。HCC827,A549,H460 细胞系中miR-127 相对表达分别为1.56±0.21,1.85±0.19和2.11±0.25,较正常肺上皮细胞BEAS-2B 中表达(1.02±0.20)亦显著升高,差异有统计学意义(F=28.152,P=0.005)。
2.2 METTL3和miR-127 相关性研究 见图1。经Linked Domics 数据库筛选发现,METTL3与miR-127在肺癌中表达呈正相关性(r=0.452,P<0.001)。
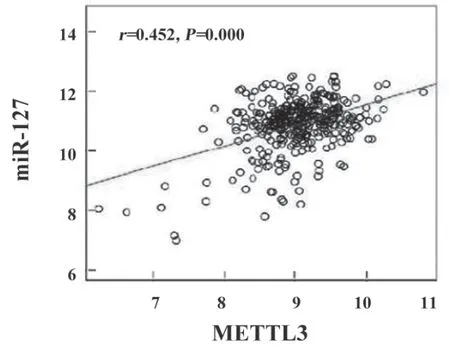
图1 肺癌中METTL3和miR-127表达相关性
2.3 细胞转染效果验证 转染METTL3 抑制剂培养48 h 后,qRT-PCR 验证发现,METTL3-siR 组METTL3 基因表达水平为0.61±0.15,较Control组(1.71±0.28)和NC-siR 组(1.65±0.19)显著下降,差异有统计学意义(F=78.357,P<0.001)。METTL3-siR 组细胞中miR-127表达水平为0.48±0.15,较Control 组(2.02±0.33)和NC-siR 组(1.97±0.25)miR-127表达水平显著下降,差异有统计学意义(F=105.216,P<0.001),说明转染成功,并且抑制METTL3表达可下调miR-127表达水平。
2.4 抑制METTL3表达对细胞自噬的影响 吖啶橙染色发现,细胞内绿色荧光减弱,红色荧光增强,说明抑制METTL3表达,使得自噬小泡增多,见图2A;
Lyso-Tracker Red 染色结果发现,METTL3-siR 组出现红色荧光,说明自噬小体与细胞内溶酶体结合,形成的自噬溶酶体增多见图2B。

图2 抑制METTL3表达对细胞自噬的影响
2.5 METTL3介导miR-127 对自噬相关蛋白表达的影响 Western blot 检测表明,与Control 组和NC-siR 组相比,METTL3-siR 组细胞中PTEN,ULK1,Beclin1蛋白表达水平显著升高,差异有统计学意义(F=62.420~175.615,均P<0.001),p-AKT和p-mTOR 蛋白表达水平显著下降,差异均有统计学意义(F=148.781,87.147,均P<0.001),见图3和表1。
表1 抑制METTL3 对miR-127 下游自噬蛋白表达的影响(±s)

表1 抑制METTL3 对miR-127 下游自噬蛋白表达的影响(±s)
注:各时间点③组与①②组比较,差异均有统计学意义P <0.05;
①②组比较差异均无统计学意义(P >0.05)。
类别Control①NC-siR 组②METTL3-siR 组③FP PTEN0.59±0.0170.62±0.0211.17±0.009112.165<0.001 p-AKT1.20±0.0231.14±0.0170.60±0.012148.781<0.001 p-mTOR0.95±0.0260.91±0.0280.53±0.01987.147<0.001 ULK10.63±0.0270.68±0.0311.22±0.030175.615<0.001 Beclin10.44±0.0120.50±0.0150.87±0.02662.420<0.001

图3 Western blot 检测自噬相关蛋白表达
据统计,非小细胞肺癌的发病率和死亡率位列所有癌症首位,由于其早期症状与普通肺炎相似,不易被重视,诊断时往往已经发展成中晚期,导致错失最佳治疗时间,术后5年生存率较低,严重威胁着患者的预后[8-9]。METTL3 作为RNA甲基转移酶,控制m6A的修饰以影响mRNA的生物合成、衰变和翻译,迄今为止已经有许多研究证实了METTL3 调控miRNA 参与肿瘤进程[10]。BI等[11]探讨了METTL3介导的miR-126-5p 在卵巢癌进展中的调控作用,结果发现敲低METTL3 抑制了miR-126-5p 上调PTEN的作用,阻止了PI3K/Akt/mTOR 途径的激活,从而抑制了卵巢癌的发展,这些发现突出了未来卵巢癌治疗的潜在目标以及m6A 修饰介导的致瘤机制。ZHA 等[12]研究发现METTL3 过表达以微处理器蛋白质DGCR8 依赖性的方式增加了RPE 细胞中miR-25-3p的水平,此外PTEN 可能受到miR-25-3p的负调控,而METTL3的过表达通过靶向miR-25-3p/PTEN 轴而增加了磷酸化的Akt(p-Akt)水平引起级联反应,共同拯救了高糖处理的RPE 细胞中的细胞活力。SUN等[13]研究了METTL3 在胃癌中对非编码RNA的作用机制,结果发现METTL3 在胃癌患者中呈高表达,且预后差、恶性程度高,其机制可能是依赖于m6A/DGCR8的途径促进了miR-17-92的加工,进而通过靶向PTEN 激活了AKT/mTOR 通路。
miR-127 作为miRNA的一员,在肿瘤细胞信号转导,细胞分化、凋亡和自噬等过程中发挥着重要作用[14]。有研究发现,miR-127 在肺癌组织和肺癌细胞中均异常高表达,其过表达可以促进癌细胞迁移、侵袭及上皮间质细胞转化,其调控机制可能是miR-127 作用于NF-κB 通路,影响肺癌的发生发展[15]。ZHANG 等[16]研究了新生儿缺血缺氧损伤中miR-127 引起异常自噬的作用机制,通过体外实验发现,miR-127-3p 敲除的新生儿损伤皮质中自噬相关蛋白ATG12,P62,Beclin-1和LC3II的表达显着降低,自噬液泡消失;
此外miR-127-3p 对自噬过程中另一个至关重要的分子CISD1表达具有特定的调节作用,CISD1的过表达有效抑制了损伤脑中的自噬细胞死亡和生理功能障碍,靶向CISD1信号的miR-127-3p 可能被认为是预防和治疗新生儿缺血缺氧损伤的新策略。还有学者发现PTEN 是miR-127的直接结合位点,miR-127 高表达可以负向调控PTEN表达,进而对其下游因子AKT 起到活化作用,AKT/mTOR 通路作为细胞自噬的经典途径,对癌症的发生发展起到催化作用,因此通过降低miR-127表达来诱导癌细胞自噬和凋亡,可能是一种更特异、更有效治疗癌症的新方法[17]。
本研究通过体外实验发现,METTL3和miR-127 在非小细胞肺癌细胞系中表达水平显著升高,两者在肺癌中呈正性共表达,提示METTL3和miR-127与非小细胞肺癌发生发展密切相关,扮演促癌基因角色。经转染介导敲低METTL3表达,发现METTL3和miR-127表达水平均显著下降,说明利用脂质体2000 转染非小细胞肺癌细胞是安全可行的,并且抑制METTL3 确实可以下调miR-127,进一步说明两者之间存在一定的介导关系。另有研究通过吖啶橙染色和Lyso-Tracker Red 染色发现METTL3-siR 组细胞内自噬小体增多,与溶酶体结合形成的自噬溶酶体也增多,提示抑制METTL3表达可以促使细胞发生自噬,诱导凋亡。同时还发现,METTL3-siR 组PTEN表达升高,原因可能与PTEN作为miR-127的直接结合位点有关,抑制METTL3导致miR-127 下调,进而上调PTEN表达;
AKT 作为PTEN的下游因子,激活PTEN 可以抑制AKT 磷酸化水平,进而下调p-mTOR,ULK1和Beclin1 是mTOR 下游的自噬蛋白,表达水平与p-mTOR 呈负相关,提示通过抑制METTL3表达来下调miR-127,进而激活PTEN/AKT/mTOR 通路是促进细胞发生自噬的重要途径。
综上所述,METTL3和miR-127 在非小细胞肺癌中起到促癌作用,抑制METTL3表达可以下调miR-127,促使癌细胞发生自噬,其调控机制可能与激活PTEN/AKT/mTOR 信号通路有关。但本研究还存在一定的局限性,首先只做了体外实验,METTL3和miR-127 在体内实验的表达水平及调控机制还有待进一步验证;
其次miR-127 是否还通过其他途径来调控非小细胞肺癌的发生发展还需进行深入研究,以期为非小细胞肺癌的治疗提供更可靠的实验依据。