气相色谱-质谱法测定沙格列汀中的3种甲磺酸酯类杂质
来源:优秀文章 发布时间:2022-12-03 点击:
刘小琼,曹杰永,刘春亮,堵伟锋(.安徽省药品审评查验中心,合肥 005;
.合肥合源药业有限公司,合肥 0088;
.滁州市食品药品检验中心,安徽 滁州 9000;
4.安徽省食品药品检验研究院,合肥 005)
沙格列汀是一种强效降糖药,其生产工艺是起始物料Ⅰ与甲磺酸反应得到中间体,中间体再与起始物料Ⅱ经过多步反应后生成。在生产过程中,中间体上的甲磺酸基团可能会与甲醇、乙醇、异丙醇等生成甲磺酸甲酯(MMS)、甲磺酸乙酯(EMS)、甲磺酸异丙酯(IMS)等甲磺酸酯类化合物,如图1。甲磺酸酯类是一类典型的基因毒性物质,能破坏服用者体内的DNA 结构,产生致癌物质,为了保证药品的安全性,药品监管系统不断完善基因毒性杂质控制的指导细则[1-3],药物研发以及药品生产企业不断探索甲磺酸酯类杂质的检验方法[4-6]。目前已报道的甲磺酸酯类的检验方法有气相色谱-质谱(GC-MS)法、液相色谱-质谱(LC-MS)法等,但运用GC-MS 法检测沙格列汀中的基因毒性杂质尚未见报道,仅有GC 法[7]测定的研究,可这种方法存在灵敏度低、检测限高的问题,对小剂量的沙格列汀制剂来说存在漏检出甲磺酸酯类杂质的可能,本文利用GC-MS 对沙格列汀的甲磺酸酯类杂质进行检测,该法检测限更低,灵敏度和准确度更高,能更有效评价沙格列汀的安全性。
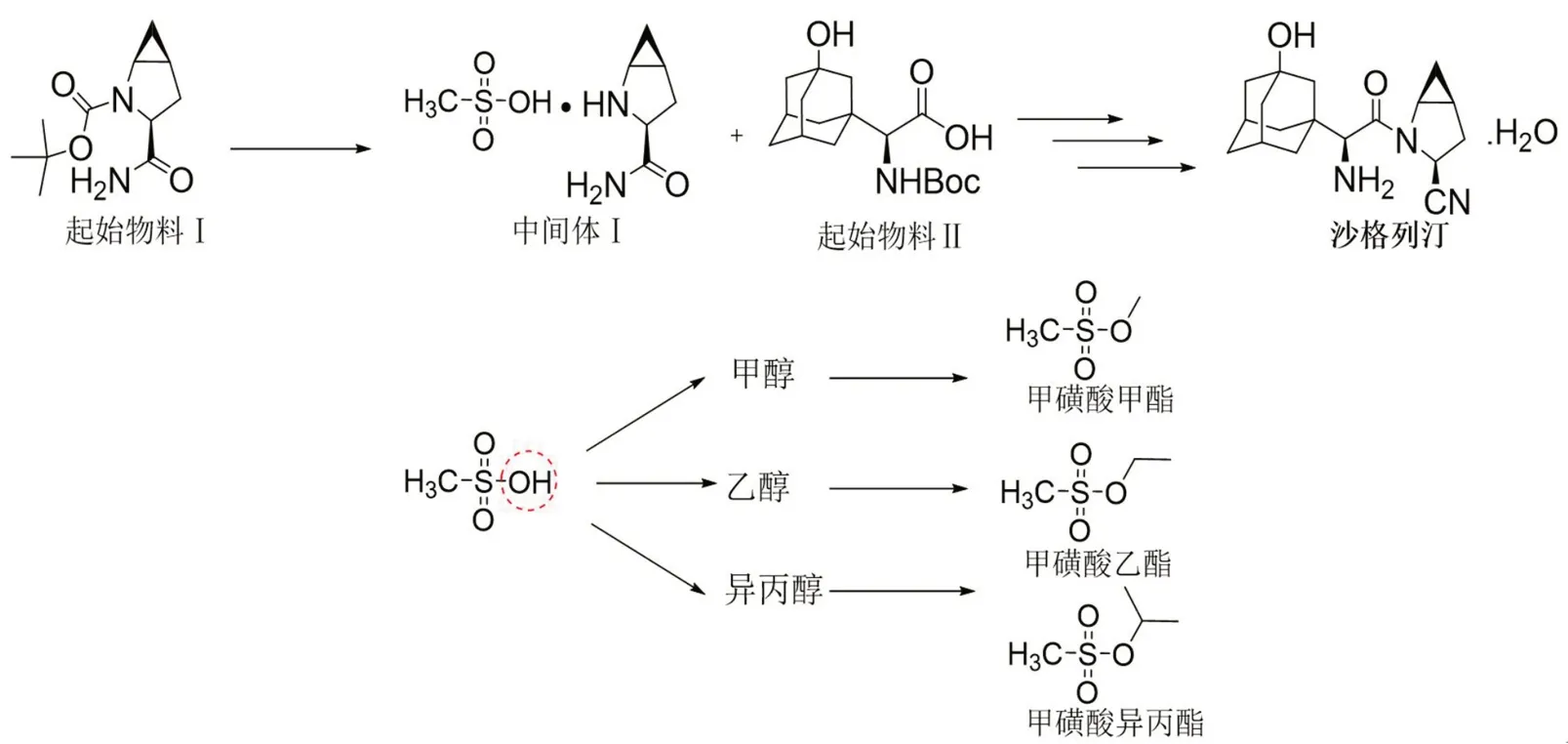
图1 沙格列汀反应步骤及甲磺酸酯类的结构Fig 1 Reaction of saxagliptin,and structure of methanesulfonates
GCMS-QP2010 Plus 型气质联用仪(日本岛津公司),XS-105 型电子天平、MS105DU 型电子天平(精度:0.01 mg,瑞士梅特勒公司),KQ-500超声清洗器(昆山市超声仪器有限公司),MMS对照品(批号:I2009166,纯度:98.57%,上海阿拉丁生化科技股份有限公司),EMS 对照品(批号:AQX836,纯度:97.00%,上海毕得医药科技有限公司),IMS 对照品(批号:D8NRR0ED,纯度:99.06%,安徽泽升科技有限公司),沙格列汀(批号:SG-190801R1、SG-190901R1、SG-190902R1、SG-200401、SG-200402、SG-200403,合肥合源药业有限公司)。
2.1 色谱条件
毛细管色谱柱(CP-SIL 8 CB,30.0 m×0.32 mm,1.0 μm);
质谱检测器;
氦气作为载气。
参数设定情况:
起始柱温60 ℃, 以10 ℃·min-1的速率升温至150 ℃,保持1 min,再以30 ℃·min-1速率升温至200 ℃,保持13 min;
柱流速设定为2.0 mL·min-1;
进样口温度设定为200 ℃;
分流比设定为5∶1;
进样量为1.0 μL。
2.2 质谱条件
EI 离子源(设定为70.0 eV);
SIM 检测模式。离子源的温度设定为200 ℃,接口温度设定为240 ℃;
线性模式;
MMS 的质荷比(m/z)设定为80,EMS 的m/z设定为79,IMS 的m/z为123。
2.3 溶液的制备
混合对照品溶液:精密称取3 种甲磺酸酯类对照品各适量置同一量瓶中,用甲醇溶解定容,制备成3 种杂质的质量浓度均为0.51 μg·mL-1的溶液。同时用作系统适用性溶液。
混合对照品母液:称取对照品MMS、EMS和IMS 约10 mg,精密称定,置同一量瓶中,用甲醇溶解定容至100 mL,再从量瓶中精密量取10.0 mL 置200 mL 量瓶中,用甲醇稀释定容即可。
供试品溶液的制备:取待测供试品沙格列汀,用甲醇溶解并稀释定容成质量浓度为1.7 mg·mL-1的溶液。
2.4 方法学考察
2.4.1 专属性考察 分别取空白溶剂(甲醇)、系统适用性溶液1.0 μL 进样,以SIM 模式采集,记录质谱图,结果如图2,质谱图显示空白溶剂对3种甲磺酸酯类杂质的检测没有影响,专属性较好。

图2 SIM 质谱图Fig 2 SIM mass spectra
2.4.2 准确度考察 精密称取3 份批号为SG-200402 的沙格列汀原料药170 mg,分别置于3个100 mL 量瓶中,再分别向不同量瓶中移入5.0、10.0 以及15.0 mL 混合对照品母液,加甲醇溶解并定容,摇匀,即得到50%、100%、150%限度浓度供试品溶液,每个浓度平行制备3 份。精密量取1.0 μL 上述限度浓度供试品溶液以及混合对照品溶液,进样,计算。结果显示MMS 在各限度浓度的平均回收率分别是96.51%、98.45%、97.98%,RSD均小于2.0%;
EMS 在各限度浓度的平均回收率分别是95.21%、98.91%、98.50%,RSD均小于2.5%;
IMS 在各限度浓度的平均回收率分别是94.48%、96.45%、95.83%,RSD均小于2.0%。表明本方法的准确度好。
2.4.3 重复性考察 吸取1.0 mL 混合对照品母液置10 mL 量瓶中,用甲醇定容,摇匀作为备用液;
向10 mL 量瓶中加入17 mg 批号为SG-200402 的沙格列汀原料药,用甲醇溶解并定容,摇匀,作为不加杂质的样品;
向10 mL 量瓶中加入17 mg 同批次沙格列汀原料药和1.0 mL 混合对照品母液,用甲醇溶解并定容,摇匀,作为加限度浓度杂质的样品(相当于100%限度浓度供试液)。取上述备用液、6 份不加杂质的样品和加限度浓度杂质的样品各1.0 μL,进样,计算。结果在不加杂质的情况下,样品中3 种甲磺酸酯类未检出;
在样品中加入限度浓度杂质后,3 种甲磺酸酯类的平均检出量分别为0.030%、0.029%和0.029%,RSD分别为2.4%、2.4%和3.0%,表明本方法的重复性较好。
2.4.4 稳定性考察 取“2.4.2”项下100%限度浓度供试品溶液作为稳定性考察溶液,室温放置,分别于4、8、12、16、20、24 h 后,进样测定,记录图谱,结果放置不同时间后的3 种甲磺酸酯类杂质含量的RSD值分别为2.8%、2.6%、3.3%,表明24 h 内供试品溶液中杂质含量波动较小,溶液较稳定。
2.4.5 检测限与定量限考察 用甲醇逐级稀释混合对照品母液配制成不同浓度的溶液,分别精密量取上述浓度溶液各1.0 μL,进样,按S/N为3∶1 计算MMS、EMS 和IMS 的检测限分别为6.21、6.14、6.17 ng·mL-1;
按S/N为10∶1 计算MMS、EMS 和IMS 的定量限分别为0.0261、0.0255 和0.0255 μg·mL-1。
2.4.6 线性考察 分别精密量取混合对照品母液1.0、1.5、2.5、5.0、8.0、10.0 mL,置于6 个50 mL 量瓶中,用甲醇稀释至刻度,摇匀,作为系列浓度对照品溶液。精密量取上述溶液各1.0 μL,分别进样,记录图谱,计算,结果见表1。MMS、EMS 和IMS 分别在0.1045 ~1.0448、0.1019 ~1.0185 和0.1020 ~1.0203 μg·mL-1的质量浓度范围内与峰面积呈良好的线性关系。
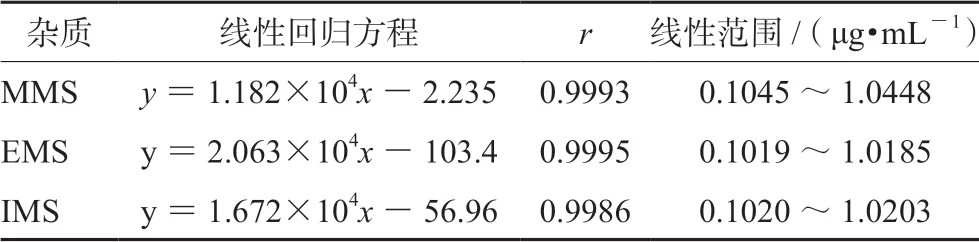
表1 线性关系考察结果Tab 1 Linearity
2.4.7 耐用性考察 按照“2.4.3”项下备用液、不加杂质的样品和加限度浓度杂质样品的制法制备耐用性考察所需的测试溶液,单因素考察初始柱温、分流比、柱流速、离子源温度以及控制模式对测定结果的影响(见表2)。精密量取上述测试溶液1.0 μL,进样,计算。本方法耐用性考察情况见表3。通过实验可以发现,在变动色谱条件后,不加杂质的样品依然未检出;
加限度浓度杂质样品中的3 种甲磺酸酯类的RSD在3.9%~6.6%,备用液的峰面积稳定,峰面积RSD的最大值为5.0%,小于限度要求的10%。表明色谱条件的变动不会影响检测结果,本检验方法的耐用性良好。

表2 色谱参数变动情况Tab 2 Changes of chromatographic conditions
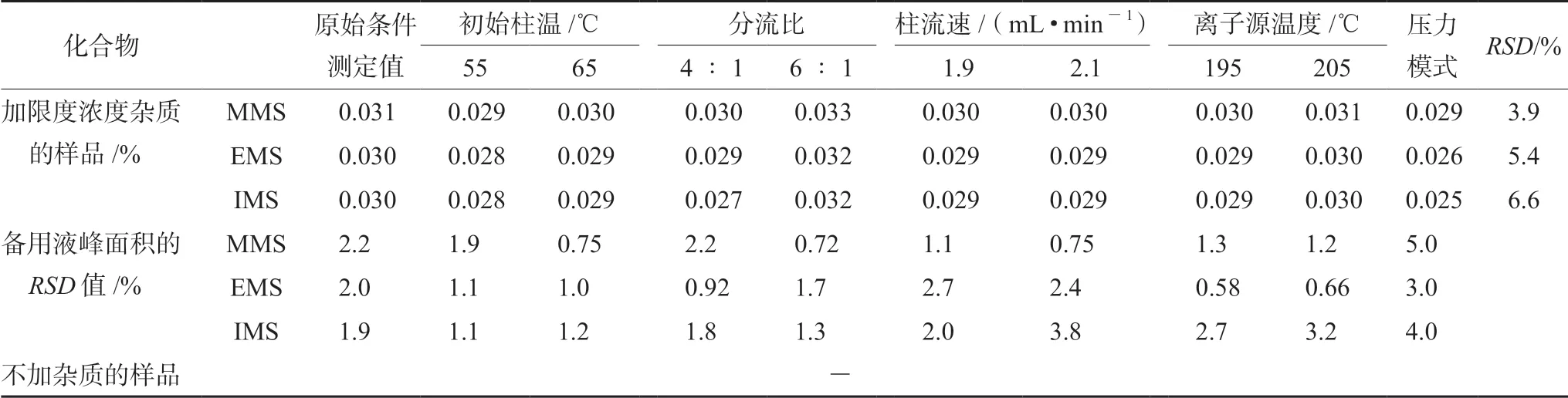
表3 耐用性考察情况Tab 3 Durability test
2.5 样品检测
对6 批次沙格列汀原料药进行处理,按要求配制相应的供试品溶液,各取1.0 μL 的混合对照品溶液和供试品溶液进样,结果见图3。6 批次沙格列汀原料药中均未检出3 种甲磺酸酯类杂质,满足杂质含量小于0.03%的限度要求。

图3 混合对照品溶液(A)和供试品溶液(B)的质谱图Fig 3 Mass spectra of mixed reference(A)and test solution(B)
3.1 升温程序的确定
由于沙格列汀原料药中需要检测的基因毒性杂质较多,杂质间的差异性较大,为了更好地分离出被测组分,明确采取系统程序升温法开展实验。经过摸索[8-9],发现按照“起始柱温60 ℃,以10 ℃·min-1的速率升温至150 ℃,保持1 min,再以30 ℃·L-1速率升温至200 ℃,保持13 min”的程序进行升温,分离效果最好。
3.2 质谱定量离子的确定
本实验采用SIM 监测模式,通过对空白溶液和系统适用性溶液进行质谱采集,观察采集图谱可以看出MMS、EMS 在m/z80 和m/z79 处有最高丰度,故选定其作为相应杂质的定量离子;
IMS 在m/z43 处有最高丰度,由于此处的检测结果容易受到系统及溶剂的影响,故选择丰度仅次于最高处的m/z123 作为定量离子[10]。
3.3 基因毒性杂质限度的确定
TTC 法是常用的基因毒性杂质限度制订方法,企业为了收紧和方便控制原料药中的基因毒性杂质,统一设定TTC 值为1.5 μg·d-1,按照沙格列汀片的最大日剂量是5 mg 计算,可得出基因毒性杂质的控制限度应为0.03%[11-12]。本方法选择样品的质量浓度为1.7 mg·mL-1,若杂质达到控制上限0.03%时,对照品质量浓度是本方法选定的0.51 μg·mL-1,可直接比对样品和对照品中对应的甲磺酸酯类峰面积判定基因毒性杂质是否超出限度。
本文采取的检验方法具有灵敏度高、准确度好等优势,运用GC-MS 法检测沙格列汀原料药中的基因毒性杂质甲磺酸酯类,可大大提高药品的使用安全系数,降低患者的用药风险。
猜你喜欢 酯类沙格列汀限度 沙格列汀联合二甲双胍治疗初发老年2型糖尿病的疗效及总胆固醇水平影响评价健康体检与管理(2022年4期)2022-05-13How to Get Slim?考试与评价·高一版(2021年4期)2021-08-14指责也该有限度语文世界(初中版)(2020年8期)2020-10-27吹扫捕集/气相色谱-质谱法测定水中酯类化合物环境与发展(2019年6期)2019-08-06沙格列汀联合二甲双胍在初发2型糖尿病中的应用糖尿病新世界(2017年11期)2017-10-20延缓硝酸酯类耐药性的三项对策家庭医学(2017年3期)2017-05-27沙格列汀治疗老年糖尿病的用药效果评估与研究糖尿病新世界(2017年1期)2017-05-11毛细管气相色谱法分析白酒中的甲醇和酯类现代农业科技(2016年20期)2016-12-20沙格列汀联合阿卡波糖治疗初诊老年2型糖尿病的效果观察中国实用医药(2016年7期)2016-03-17话说“出差”海外英语(2013年6期)2013-08-27推荐访问:色谱 杂质 气相