牛坏死杆菌白细胞毒素PL2蛋白单克隆抗体的制备及鉴定
来源:优秀文章 发布时间:2022-11-19 点击:
郭东华,肖佳薇,王丽娜,汪锋锋,贺显晶,蒋剑成,孙东波
黑龙江八一农垦大学动物科技学院 黑龙江省牛病防制重点实验室,黑龙江 大庆 163319
坏死杆菌是一种革兰阴性无芽孢厌氧菌,属于梭菌属[1-2],是人及动物体内广泛存在的细菌,主要分布于呼吸道、消化道等黏膜处,可独立引起机体感染,也可协同其他细菌感染引起动物肝脓肿、腐蹄病、奶牛乳房炎、子宫内膜炎,上述疾病在临床上极大地增加了反刍动物淘汰率。
坏死杆菌侵入机体后,首先外膜蛋白黏附宿主细胞[3],随后其关键毒力因子白细胞毒素(leukotoxin)迅速标记白细胞表面相关抗原[4],刺激机体细胞免疫及体液免疫,损伤机体白细胞,导致坏死杆菌及其他协同感染细菌持续增殖,机体因此失去相应抵抗能力。天然白细胞毒素相对分子质量较高,约为336 000[5],且属于分泌型毒素,通过激活多形核白细胞(polymor-phonuclear leukocyte,PMN)和诱导牛免疫效应细胞凋亡以及对反刍动物PMN的细胞毒性来调节宿主免疫系统[5-6],坏死杆菌白细胞毒素具有强致病力,在严格厌氧条件下,9 h达到上清最大分泌量[7]。由于坏死杆菌天然白细胞毒素目的片段大且易降解,目前普通的蛋白提纯方案可行性较低,因此,应用坏死杆菌白细胞毒素重组蛋白制备单克隆抗体经亲和层析提纯白细胞毒素具有一定的可行性。
目前对于坏死杆菌天然白细胞毒素的致病机制尚不明确,由于坏死杆菌白细胞毒素与其他细菌毒素无序列相关性,可作为特异性抗体用于坏死杆菌病ELISA检测试剂盒的开发。2007年,本课题组克隆了坏死杆菌H05菌株白细胞毒素基因lktA全长,截短表达了5段重组蛋白(PL1、PL2、lktA3、PL4、PL5)[8],在此基础上,本研究选择其中免疫效果较好的PL2蛋白制备单克隆抗体,为进一步研究坏死杆菌白细胞毒素的提纯及致病机制奠定基础。
1.1 细胞、质粒及菌种SP2/0细胞、E.coli BL21(DE3)感受态细胞和pGEX-6p-1载体由黑龙江八一农垦大学兽医分子病理学实验室保存;
坏死杆菌白细胞毒素重组蛋白PL2阳性质粒为本实验室保存;
坏死杆菌A25菌株购自ATCC(Fusobacterium necrophorum,Fnn亚种,ATCC 25286)。
1.2 实验动物SPF级BALB/c小鼠,6~8周龄,雌性,体重(20±1)g,购自哈尔滨医科大学,动物许可证号:SCXK(吉)-2018-0007。本实验均以科研为目的对BALB/c小鼠进行养殖和使用,且按照黑龙江八一农垦大学动物伦理相关规定进行(DWKJXY-2022014)。
1.3 主要试剂 弗氏完全佐剂、弗氏不完全佐剂、PEG-1500、HAT、HT和RPMI1640培养基购自美国Sigma公司;
胎牛血清购自加拿大WISENT公司;
SBA ClonotypingTMSystem/HRP抗体亚类鉴定试剂盒购自美国Southern Biotech公司;
SDS-PAGE凝胶制备试剂盒和Giemsa染色试剂盒购自北京索莱宝科技有限公司;
青链霉素混合液和HRP标记的山羊抗鼠IgG(IgG-HRP)购自安徽biosharp公司;
GST标签蛋白购自金克隆(北京)生物技术有限公司;
BCA蛋白浓度检测试剂盒购自碧云天生物技术有限公司;
鼠阴性血清为本实验室制备;
纯化的坏死杆菌白细胞毒素重组蛋白PL2、lktA3、PL4、PL5[8]为本实验室冻存。
1.4 免疫原制备 将坏死杆菌白细胞毒素重组蛋白PL2阳性质粒转化至E.coli BL21(DE3)感受态细胞中,阳性菌于37℃恒温,190 r/min摇床培养至A600值为0.6~0.8时,加入终浓度为1 mmol/L的IPTG,37℃,190 r/min诱导4 h。6 010×g离心10 min,收集菌体沉淀,加入裂解液进行超声破碎,6 010×g离心20 min,收集上清及沉淀,12% SDSPAGE分析PL2蛋白的表达情况,同时设置pGEX-6p-1空载体和重组菌未诱导对照,将破碎后上清或沉淀进行蛋白切胶纯化。大量制备PL2阳性菌液,在超声破碎后沉淀中加入适量的PBS缓冲液,蛋白上样缓冲液,100℃水浴10~15 min,同时制备1.5 mm,12% SDS-PAGE蛋白胶,上层胶插入一孔梳,加入500~700 μL处理后的蛋白样品;
完成电泳后,目的条带放入0.3 mol/L 4℃预冷的KCl中,作用5~10 min;
将目的条带切下,碾碎胶条,加入少量PBS,经液氮和4℃条件反复冻融3次,4℃,6 010×g离心10 min,吸取上清,即为纯化后PL2蛋白,使用BCA蛋白浓度检测试剂盒检测蛋白浓度。
1.5 动物免疫 将切胶纯化后的PL2蛋白与弗氏完全佐剂等比例混合,经腹腔免疫BALB/c小鼠,15 d后断尾采血,分离血清,隔天进行第2、3次免疫,均使用弗氏不完全佐剂与PL2蛋白等比例混合,每次免疫间隔15 d,次日采血分离血清,采用间接ELISA法检测抗体效价。每次每只小鼠免疫量为50 μg。融合前3 d,取抗体效价达12 800以上的小鼠进行加强免疫,每只小鼠100 μg,加强免疫后3~5 d内融合。
1.6 间接ELISA检测方法的建立 方阵法筛选间接ELISA的抗原包被量及一抗工作浓度。将纯化的PL2蛋白2倍系列稀释(浓度梯度为4、2、1、0.5、0.25 μg/mL)及混合碳酸盐包被液加入96孔酶标板中,100 μL/孔,4℃包被过夜;
PBST洗涤3次,300 μL/孔,每次3 min,加入5%脱脂乳,37℃封闭2 h;
PBST振荡洗涤3次,加入鼠阴性血清、PL2阳性血清(稀释比例为1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800),37℃孵育1 h,同时设空白对照;
PBST洗涤3次,加入HRP标记的山羊抗鼠IgG(1∶5 000稀释),37℃避光孵育1 h;
PBST振荡洗涤3次,加入TMB单组分显色液,100 μL/孔,常温避光显色15 min;
加入2 mol/L H2SO4终止反应,100 μL/孔,于酶标仪波长450 nm下读取吸光度值。判定标准:以阳性值(P)大于1.0,阴性值(N)小于0.2,P/N值最高,确定最佳单抗筛选条件。
1.7 细胞融合及杂交瘤细胞筛选 阳性小鼠无菌取脾后与SP2/0细胞在PEG作用下,按(5~9)∶1进行常规融合,融合后细胞用HAT选择培养基重悬,加入预先铺好饲养层的96孔板,100 μL/孔,37℃,5% CO2条件下培养,5 d后倒置显微镜观察细胞生长情况,9~10 d进行全换液,隔2 d后利用1.6项建立的间接ELISA法筛选阳性孔。将阳性孔换液,每孔加入200 μL细胞培养液,间隔2 d复检,同时包被相同浓度的GST标签蛋白进行复检,将PL2蛋白检测为阳性且GST标签蛋白检测为阴性的细胞利用有限稀释法进行3~4次亚克隆,克隆时更换HT培养液,每次亚克隆均选择单细胞团进行克隆,获得稳定分泌抗PL2蛋白单克隆抗体的阳性杂交瘤细胞株,液氮-196℃冻存。
1.8 腹水制备 取8周龄雌性BALB/c小鼠,经腹腔注射弗氏不完全佐剂或液体石蜡,300~500 μL/只;
复苏阳性杂交瘤细胞,传代3次,3 d后,将培养于25 cm2细胞培养瓶中生长状态良好,60%~70%铺满瓶底的细胞弃上清,加入无双抗和血清的RPMI-1640培养基混匀,每只小鼠注射400~500 μL。7 d左右吸取腹水,3 968×g离心5 min,吸取澄清液体,-80℃冻存。
1.9 单克隆抗体的初步鉴定
1.9.1 抗体效价检测 将阳性杂交瘤细胞培养上清进行2倍系列稀释(1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600),腹水进行10倍系列稀释(1∶102、1∶103、1∶104、1∶105、1∶106、1∶107、1∶108、1∶109、1∶1010),检测杂交瘤细胞培养上清及腹水的抗体效价。设阴性对照(细胞培养基)和阳性对照(阳性鼠血清)。
1.9.2 抗体亚类鉴定 应用SBA ClonotypingTMSystem/HRP(Southern Biotech 5300-05)抗体亚类鉴定试剂盒鉴定单克隆抗体的亚类。
1.9.3 Westernblot鉴定 取纯化的坏死杆菌白细胞毒素重组蛋白PL2、lktA3、PL4、PL5[9]、坏死杆菌浓缩上清、GST标签蛋白,经12% SDS-PAGE分离蛋白后,转印至NC膜上,以含5%脱脂乳的PBST室温封闭2 h;
PBST洗涤3次,加入杂交瘤细胞上清(1∶1 000稀释),室温孵育1 h;
PBST洗涤3次,每次10 min,加入HRP标记的山羊抗鼠IgG(1∶5 000稀释),室温孵育1 h;
PBST洗涤3次,每次10 min,进行成像分析。
1.9.4 杂交瘤染色体分析 将杂交瘤细胞传代至6孔细胞培养板中培养,待细胞处于对数生长期,铺满孔底70%~80%时,加入终浓度为0.05 μg/mL的秋水仙素,37℃,5% CO2培养箱培养4 h;
收集细胞,94×g离心10 min,弃上清,沉淀混匀至5 mL 37℃预热的0.075 mol/L KCl低渗溶液中,37℃水浴20 min;
按甲醇∶冰乙酸=3∶1的比例配制固定液,加入低渗处理的细胞悬液中,混匀,94×g离心10 min,弃上清;
加入固定液5 mL,混匀,静置15 min,94×g离心10 min,弃上清;
加入固定液5 mL,静置15 min,94×g离心10 min,弃上清;
加入400 μL固定液,混匀,每张载玻片遇冷2 h后,滴加2~3滴细胞悬浮液,滴片高度30 cm,火焰固定;
应用Giemsa染色试剂盒进行染色,观察染色体形态,并计数。
2.1 重组蛋白PL2的鉴定12% SDS-PAGE分析显示,重组蛋白PL2以包涵体形式在沉淀中表达,大小约为60 000,与预期相符,见图1;
纯化的重组蛋白PL2在相对分子质量约60 000处可见单一目的条带,见图2。

图1 重组蛋白PL2表达的SDS-PAGE分析Fig.1 SDS-PAGE profile of expressed recombinant PL2 protein
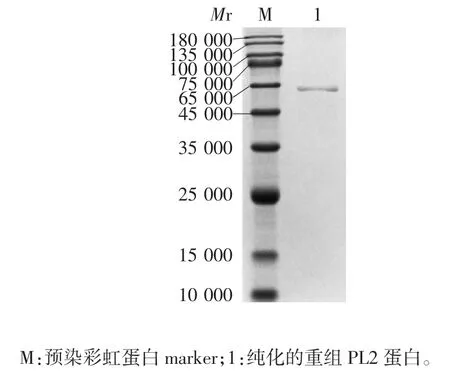
图2 纯化重组蛋白PL2的SDS-PAGE分析Fig.2 SDS-PAGE profile of purified recombinant PL2 protein
2.2 间接ELISA检测方法的建立 经方阵法筛选,确定PL2阳性杂交瘤细胞筛选的间接ELISA法的最佳抗原包被量为2 μg/mL,血清最佳稀释比例为1∶1 600,见表1。

表1 最佳抗原包被量和血清稀释比例的筛选(P/N)Tab.1 Optimization of coating concentration of antigen and dilution of serum(P/N)
2.3 阳性杂交瘤细胞的筛选 经1次GST标签蛋白筛选和4次亚克隆,获得稳定分泌抗PL2蛋白单克隆抗体的杂交瘤细胞株,选取其中1株效价最高的细胞株命名为2D5。
2.4 单克隆抗体的初步鉴定
2.4.1 抗体效价 杂交瘤细胞上清和腹水的间接ELISA效价分别为1∶6 400和1∶105。
2.4.2 抗体亚类2D5细胞株分泌的PL2单克隆抗体重链为IgG3,轻链为κ链,见图3。

图3 单克隆抗体亚类鉴定结果Fig.3 Identification of subclass of McAb
2.4.3 Western blot分析2D5株细胞分泌的单克隆抗体上清能与坏死杆菌培养液浓缩上清、重组蛋白PL2特异性结合,在相对分子质量约60 000处可见特异性结合条带,不能与GST标签蛋白、坏死杆菌白细胞毒素截短蛋白lktA3、PL4、PL5结合,坏死杆菌培养液浓缩上清为反应条带大小约为110 000和45 000,均与预期相符,表明2D5株细胞分泌的单克隆抗体具有良好的特异性和反应原性。见图4。

图4 单克隆抗体的Western blot分析Fig.4 Western blotting of McAb
2.4.4 杂交瘤染色体分析2D5株杂交瘤细胞染色体数目为102条,符合BALB/c小鼠脾细胞与Sp2/0细胞染色体亲本之和,见图5。

图5 杂交瘤细胞染色体分析结果(×100)Fig.5 Analysis of chromosome of hybridoma cells(×100)
坏死杆菌在人及动物的感染过程中属于一种条件致病菌,其感染人时主要引起Lemierre综合征[9],主要症状为颈部血栓静脉炎,全球发病率为1/106[10],还能引起奶牛腐蹄病、肉牛肝脓肿,在子宫内膜炎及乳腺炎中均能分离出坏死杆菌,目前,坏死杆菌已由机会主义病原转变为普遍感染。坏死杆菌有多种毒力因子,如白细胞毒素[11]、脂多糖(lipopolysaccharide,LPS)、溶血素、血凝素[12]、真皮坏死毒素[13]、黏附素、血小板聚集因子和几种胞外酶,目前对于坏死杆菌致病机制的研究尚不明确,尤其对于其主要毒力因子白细胞毒素的研究不深入,国内外也无商品化单克隆抗体可用于其致病机制的深入研究,因此,制备坏死杆菌白细胞毒素单克隆抗体十分必要。
2007年,本课题组将坏死杆菌白细胞毒素全长基因进行截短表达,精确了其免疫保护区,并证明在羊中性粒细胞中,截短白细胞毒素能够介导其凋亡[8]。坏死杆菌白细胞毒素相比其他细菌的白细胞毒素相对分子质量更大,且无序列相关性。之后,MACHADO等[14]证明,大肠埃希菌、坏死杆菌及化脓隐秘杆菌的3种重组蛋白(FimH、LKT、PLO)联合使用能有效预防牛子宫内膜炎。孟祥玉[15]通过对坏死杆菌白细胞毒素亚单位疫苗及坏死杆菌全菌灭活疫苗免疫保护力进行对比,证明其可有效预防家兔肝脓肿。由此可知,针对坏死杆菌白细胞毒素的研究有助于深入研究其致病机制。
前期试验结果显示,重组蛋白PL2具有良好的免疫原性,利用其免疫小鼠可获得较高的血清抗体效价,制备单克隆抗体更佳[8]。本实验将重组蛋白PL2阳性质粒转化E.coli BL21(DE3),IPTG诱导表达重组蛋白并进行纯化。用纯化的蛋白免疫小鼠时,常规融合后,筛选单克隆抗体前2 d,采用全换液处理,这种处理方式针对间接ELISA法筛选单克隆抗体能够有效降低假阳性的情况,为后续亚克隆减少了一定的工作量,同时,将筛选出的阳性孔细胞进行48孔板扩大培养,并进行GST标签蛋白反向筛选,其原因是GST蛋白相对分子质量较大,在单克隆抗体制备过程中难以区分该单克隆抗体是否仅针对白细胞毒素的表位。杂交瘤细胞2D5株培养上清可与坏死杆菌培养液浓缩上清反应,条带相对分子质量大小分别约为110 000和45 000,坏死杆菌培养液浓缩上清中主要成分为天然白细胞毒素,因此,证明坏死杆菌白细胞毒素PL2单克隆抗体可与天然白细胞毒素反应,特异性较强,为后续天然白细胞毒素致病机制的研究提供了工具。
白细胞毒素作为坏死杆菌损伤机体的关键毒力蛋白,主要作用于反刍动物的中性粒细胞、巨噬细胞、肝细胞等,且在介导机体抵抗坏死杆菌感染中具有特异性免疫反应[16-17]。坏死杆菌白细胞毒素与外膜蛋白、LPS、溶血素等其他毒力因子相比,具有更强的特异性,北美及印度等国家也应用白细胞毒素特异性基因进行坏死杆菌感染的诊断[18-19]。因此,坏死杆菌白细胞毒素可作为坏死杆菌特异性抗原研究及制备ELISA检测试剂盒的首选。本研究成功制备了针对坏死杆菌白细胞毒素重组蛋白PL2的单克隆抗体,为建立临床检测坏死杆菌相关疾病试剂盒以及坏死杆菌白细胞毒素致病机制的深入研究奠定了基础。
猜你喜欢 白细胞杆菌毒素 吃不得啊红领巾·萌芽(2022年3期)2022-03-13rpoB、gyrA、cheA基因在芽孢杆菌鉴定上的应用浙江农业学报(2022年1期)2022-02-18What Makes You Tired考试与评价·高二版(2021年3期)2021-09-10心力衰竭患者白细胞介素6、CRP表达水平与预后的相关性探讨医学食疗与健康(2021年25期)2021-05-12为什么许多艳丽的蘑菇会有毒?小天使·二年级语数英综合(2020年6期)2020-12-23转基因植物历史悠久大自然探索(2020年1期)2020-02-16认识麻痹性贝类毒素食品与生活(2017年11期)2017-12-18白细胞降到多少应停止放疗人人健康(2017年19期)2017-10-20阴道乳杆菌主要种群异同与健康上海预防医学(2017年8期)2017-09-06白细胞减少是免疫力降低了吗?家庭科学·新健康(2017年7期)2017-07-14推荐访问:白细胞 杆菌 坏死