防风水提物对抗生素加重小鼠过敏性鼻炎的改善作用研究
来源:优秀文章 发布时间:2023-04-27 点击:
陈艳春 徐世影 应航宇 陈志凌
过敏性鼻炎(allergic rhinitis,AR)是人体接触过敏原,体内免疫系统异常激活,并出现鼻痒、喷嚏和流涕等临床症状的非感染过敏性疾病。AR 的发病率呈逐年上升趋势,已成为一个全球性的公共卫生问题[1]。目前研究认为,人体的微生物具有免疫调节作用,对包括AR 在内的过敏性疾病的发生起着积极的抑制作用,而过度使用抗生素可引起人体微生物改变,与AR患病风险增加有关[2-4]。通过调节免疫功能等方法治疗来改善患者AR症状目前受到临床好评[5]。防风为伞形科植物防风未抽花茎植株的干燥根部,用药历史悠久,具有增强免疫系统功能、抗炎和抗过敏作用[6]。因此,本研究通过鸡卵清白蛋白(ovalbumin,OVA)激发小鼠发生AR建立动物模型,观察进一步使用抗生素对小鼠AR症状的影响以及防风水提物改善小鼠AR症状的作用,并探讨这一作用的免疫机制。
1.1 材料
1.1.1 实验动物 40 只健康雄性Balb/c 小鼠[6 周龄,(20±2)g]购于上海灵畅生物科技有限公司[实验动物生产许可证号:SCXK(沪)2018-0003],饲养于浙江鹰旸生物科技有限公司动物中心[实验动物生产许可证号:SYXK(浙)2021-0033],饲养于(22±2)℃、50% ~60%湿度的通风环境,保证每日充足光照14 h,正常饮食。
1.1.2 实验试剂 OVA 购于美国Sigma 公司(批号:SLCH2414);
IL-2、转 化 生 长 因 子β1(transforming growth factor-β1,TGF-β1)ELISA 试剂盒购于上海酶联生物科技有限公司(批号:A00922、A91123),IL-4、IL-5、IL-6、IL-10、IL-17、TNF-α、IFN-γ ELISA 试剂盒均购于江苏酶免实业有限公司(批号:202105、202105、202106、202107、202108、202109、202109);
甲苯胺蓝染液购于中国Servicebio 公司(批号:20220228);
BCA 蛋白定量试剂盒购于中国Solarbio 公司(批号:20220228);
Toll 样受体4(toll-like receptor 4,TLR4)、TNF 受体关联因子6(TNF receptor associated factor 6,TRAF6)、核因子-κB p65(nuclear factor κB p65,NFκB p65)、NF-κB 抑制剂(inhibitor of NF-κB,IκBα)、活化IκBα(pho-IκBα,p-IκBα)、肌动蛋白(β-actin)购于美国Affinity抗体公司(批号:16c5074、27e2981、32a4053、12l8356、13s5835、12e1054)。CD4-FITC、CD25-PECy7、核转录因子Foxp3-BV421 流式抗体购自美国BD公司(批号:553055、335807、562996)。
1.1.3 实验仪器 电泳仪、电泳槽、转膜仪购自中国天能公司;
化学发光仪购自中国勤翔公司;
高速离心机购自美国Thermo 公司;
酶标仪购自美国MD 公司;
正置光学显微镜购自日本尼康公司;
病理切片机购自上海徕卡仪器有限公司;
C6流式细胞仪购自美国BD公司。
1.2 方法
1.2.1 小鼠模型制备和分组 将OVA 与0.4%质量浓度的氢氧化铝凝胶混合,配制0.2 mg/ml 浓度的OVA 致敏液;
另用0.9%氯化钠溶液稀释OVA 制备滴鼻液(25 mg/ml)。参照文献[7]方法激发小鼠AR:随机选取32 只小鼠在实验第1 天通过两后足跖(0.1 ml)、两腹股沟(0.1 ml)、背部两处(0.1 ml)和腹腔(0.2 ml)注射OVA 致敏液,在第7、14、21 天,继续通过腹腔注射0.5 ml OVA 致敏液。第22~35 天,用20 μl 滴鼻液刺激小鼠鼻腔,1 次/1 d。随后,将小鼠按随机数字表法分为模型组、抗生素组、防风水提物组、防风水提物+抗生素组,另将未经OVA 诱导的小鼠归入正常组,每组8只,给与相应干预。
1.2.2 药物制备及给药 500 g防风生药饮片由杭州市中医院药房提供。蒸馏水冲洗2次后再加2 000 ml煮沸2~3 h,过滤残渣,留取滤液,60 ℃旋转蒸发仪浓缩,冻干后最终得到25 g 防风浓缩固体。将防风浓缩固体溶于0.9%氯化钠溶液配制成5 mg/ml防风水提液。用0.9%氯化钠溶液配制质量浓度为210 mg/ml 的抗生素混合液(其中头孢羟氨苄30 mg/ml,土霉素90 mg/ml,红霉素90 mg/ml)。抗生素组、防风水提物组分别取防风水提液或抗生素混合液,稀释1 倍后,每只小鼠给予0.2 ml 灌胃,1 次/d,持续2 周。防风水提物+抗生素组小鼠给予0.1 ml的防风水提液(无需稀释)和0.1 ml的抗生素混合液(无需稀释)灌胃,1次/d,持续2周。模型组和正常组小鼠均给予0.2 ml 0.9%氯化钠溶液灌胃,1 次/d,持续2周。实验期间所有小鼠给予正常饮食。
1.2.3 小鼠AR 症状观察 最后一次给药0.5 h 后,将小鼠单独置于笼中,OVA 滴鼻液刺激小鼠,观察15 min内小鼠的打喷嚏和挠鼻次数,评价AR 症状。观察结束后用二氧化碳窒息处死小鼠,心脏取血离心获取血标本,两侧鼻腔用200 μl 无菌Hanks 平衡盐溶液灌洗并收集鼻腔灌洗液。剪开小鼠鼻腔,收集小鼠鼻中隔黏附的完整鼻黏膜组织。取出小鼠脾脏,去除表面脂肪组织,无菌保存备用。
1.2.4 小鼠血清中致敏因子(免疫球蛋白E、组胺、白三烯)、炎症细胞因子和鼻腔灌洗液中炎症细胞因子水平检测 采用ELISA 法。按照ELISA 试剂盒内的操作说明检测血清IgE、组胺、白三烯、IL-4、IL-5、TNFα、IL-2、IL-10、IFN-γ 以及鼻腔灌洗液中IL-6、IL-17、IL-4、IL-10、TGF-β1 水平。平行测定6 个复孔。
1.2.5 小鼠鼻腔灌洗液炎症细胞计数 用含1%牛血清白蛋白的PBS 悬浮灌洗液底部细胞,用血细胞计数器计数白细胞。行Wright"s-Giemsa 染色,计数嗜酸性粒细胞、中性粒细胞和淋巴细胞数量。
1.2.6 小鼠鼻黏膜组织肥大细胞浸润情况观察 将鼻黏膜组织置于4% 多聚甲醛中固定,制备石蜡切片。脱蜡至水。甲苯胺蓝染液染色10 min,95%乙醇分化。吹干切片,二甲苯透明后封片。显微镜下计数6 个高倍镜视野(×400)内肥大细胞数量,计算均值。
1.2.7 小鼠脾脏组织CD4+CD25+Foxp3+Treg 细胞、CD4+T 细胞检测 采用流式细胞术。小鼠脾脏组织清洗后剔除结缔组织,剪碎后采用匀浆机均匀粉碎,过筛后离心脾脏单核细胞,红细胞裂解液裂解沉淀的脾脏组织,用PBS 调整浓度为2×107/ml 细胞悬液。加入CD4、CD25、Foxp3 流式抗体,4 ℃避光孵育30 min,PBS 清洗2 次,PBS 重悬细胞,过筛网,重悬细胞后上流式细胞仪检测CD4+T 细胞以及CD4+T 细胞群中CD25+Foxp3+Treg 细胞,计算CD4+CD25+Foxp3+Treg/CD4+T 细胞比例,实验重复3 次。
1.2.8 小鼠鼻黏膜组织TLR4/TRAF6/IκBα/NF-κB p65通路相关蛋白表达水平检测 采用Western blot 法。剪碎小鼠鼻黏膜组织,加入蛋白质裂解液,匀浆机中进行匀浆(20 s),3 次,离心提取组织蛋白。BCA 法测定蛋白浓度。聚丙烯酰胺凝胶电泳分离蛋白。用5%脱脂奶粉封闭2 h,清洗,加入含TLR4、TRAF6、p-IκBα、IκBα、NF-κB p65 抗体的稀释液,4 ℃过夜孵育。第2 天室温震荡,吸弃多余液体,再用5%脱脂奶粉封闭,加入二抗反应液,洗膜。化学发光仪显影,Chemi Capture 软件拍照。以β-actin 为内参对照,计算各蛋白相对表达水平,实验重复3 次。
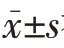
2.1 5 组小鼠AR 症状比较 5 组小鼠打喷嚏、挠鼻次数比较差异均有统计学意义(均P<0.05)。与正常组比较,模型组小鼠打喷嚏、挠鼻次数增加(均P<0.05)。与模型组比较,抗生素组小鼠打喷嚏、挠鼻次数进一步增加(均P<0.05),而防风水提物组小鼠打喷嚏、挠鼻次数减少(均P<0.05)。与抗生素组比较,防风水提物+抗生素组小鼠打喷嚏、挠鼻次数减少(均P<0.05)。见表1。

表1 5 组小鼠AR 症状比较(次)
2.2 5 组小鼠小鼠血清中致敏因子、炎症细胞因子水平比较 与正常组比较,模型组小鼠血清免疫球蛋白E、组胺、白三烯、IL-4、IL-5、TNF-α 水平均升高(均P<0.05),IL-2、IL-10、IFN-γ 水平均降低(均P<0.05)。与模型组比较,抗生素组小鼠血清疫球蛋白E、组胺、白三烯、IL-4、IL-5 水平均升高(均P<0.05),IL-2、IL-10 水平均降低(均P<0.05),IFN-γ、TNF-α水平差异均无统计学意义(均P>0.05);
而防风水提物组小鼠血清疫球蛋白E、组胺、白三烯、IL-4、IL-5、TNF-α 水平均降低(均P<0.05),IL-2、IL-10、IFN-γ水平均升高(均P<0.05)。与抗生素组比较,防风水提物+抗生素组小鼠血清IgE、组胺、白三烯、IL-4、IL-5、TNF-α 水平均降低(均P<0.05),IL-2、IL-10、IFNγ 水平均升高(均P<0.05)。见表2。
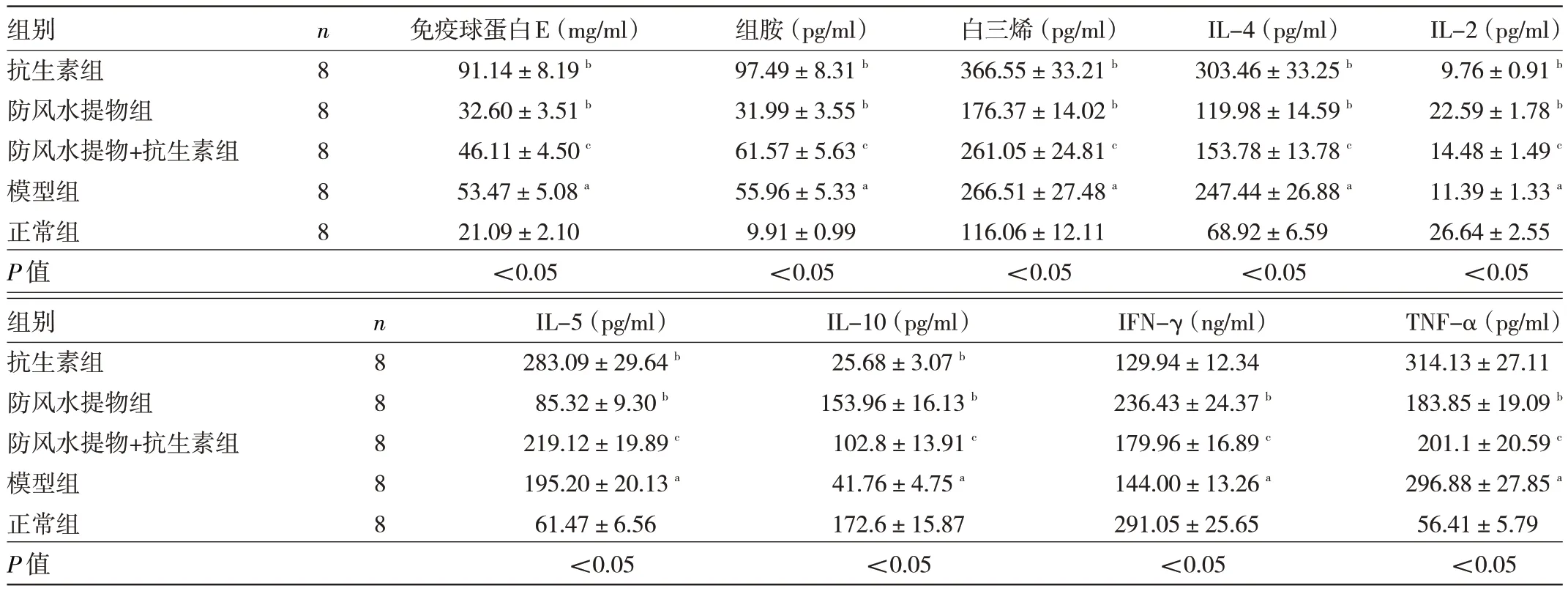
表2 5 组小鼠血清中致敏因子、炎症细胞因子水平比较
2.3 5 组小鼠鼻腔灌洗液中炎症细胞因子水平比较与正常组比较,模型组小鼠鼻腔灌洗IL-6、IL-17、IL-4水平均升高(均P<0.05),IL-10、TGF-β1 水平均降低(均P<0.05)。与模型组比较,抗生素组小鼠IL-17、IL-4 水平均升高(均P<0.05),IL-10、TGF-β1 水平均降低(均P<0.05),而IL-6 水平差异无统计学意义(P>0.05);
防风水提物组小鼠IL-6、IL-17、IL-4 水平均降低(均P<0.05),IL-10、TGF-β1 水平均升高(均P<0.05)。与抗生素组相比,防风水提物+抗生素组小鼠IL-17、IL-4 水平均降低(均P<0.05),IL-10、TGF-β1 水平均升高(均P<0.05),IL-6 水平差异无统计学意义(P>0.05)。见表3。
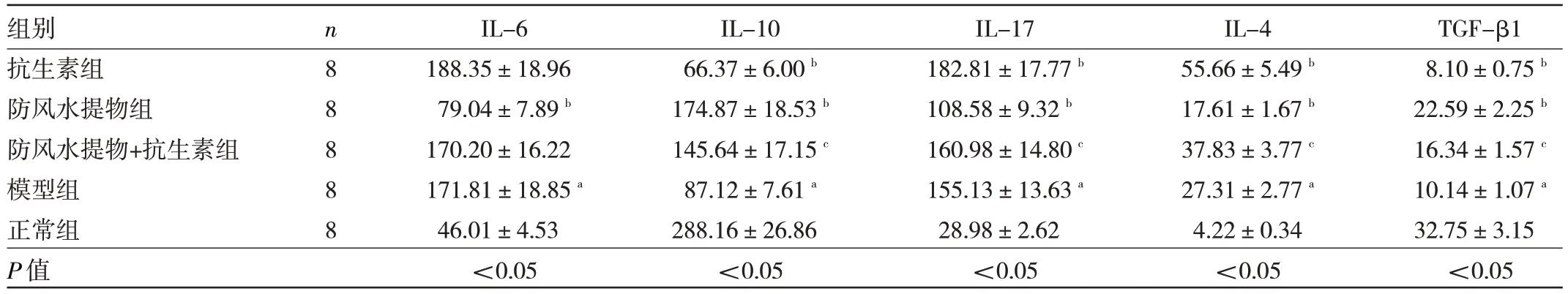
表3 5 组小鼠鼻腔灌洗液炎症细胞因子水平比较(pg/ml)
2.4 5 组小鼠鼻腔灌洗液中炎症细胞数量比较 与正常组比较,模型组小鼠鼻腔灌洗液嗜酸性粒细胞、白细胞、淋巴细胞、中性粒细胞数量均增加(均P<0.05)。与模型组比较,抗生素组小鼠嗜酸性粒细胞、白细胞、淋巴细胞、中性粒细胞数量均增加(均P<0.05);
而防风水提物组小鼠嗜酸性粒细胞、白细胞、淋巴细胞、中性粒细胞数量均减少(均P<0.05)。与抗生素组相比,防风水提物+抗生素组小鼠嗜酸性粒细胞、白细胞、淋巴细胞、中性粒细胞数量均减少(均P<0.05)。见表4。

表4 5 组小鼠鼻腔灌洗液中炎症细胞数量比较(×106/ml)
2.5 5 组小鼠鼻黏膜组织肥大细胞浸润情况比较 5组小鼠鼻黏膜组织肥大细胞浸润情况见图1(插页)。与正常组比较,模型组大鼠鼻黏膜组织肥大细胞浸润数量增加(P<0.05);
与模型组比较,抗生素组小鼠鼻黏膜组织肥大细胞浸润数量进一步增加(P<0.05),而防风水提物组小鼠鼻黏膜组织肥大细胞浸润数量减少(P<0.05)。与抗生素组相比,防风水提物+抗生素组小鼠鼻黏膜组织肥大细胞浸润数量减少(P<0.05)。见表5。

表5 5 组小鼠鼻黏膜组织肥大细胞数量比较

图1 5 组小鼠鼻黏膜组织肥大细胞浸润情况(箭头示肥大细胞;
甲苯胺蓝染色,×400)
2.6 5 组小鼠脾脏组织CD4+CD25+Foxp3+Treg/CD4+T细胞比例比较 与正常组相比,模型组小鼠脾脏CD4+CD25+Foxp3+Treg/CD4+T 细胞比例显著降低(P<0.05);
与模型组相比,抗生素组小鼠脾脏CD4+CD25+Foxp3+Treg/CD4+T 细胞比例显著降低(P<0.05),而防风水提液组小鼠脾脏CD4+CD25+Foxp3+Treg/CD4+T 细胞比例显著增加(P<0.05)。与抗生素组相比,防风水提物+抗生素组小鼠脾脏CD4+CD25+Foxp3+Treg/CD4+T 细胞比例升高(P<0.05)。见图2(插页)。
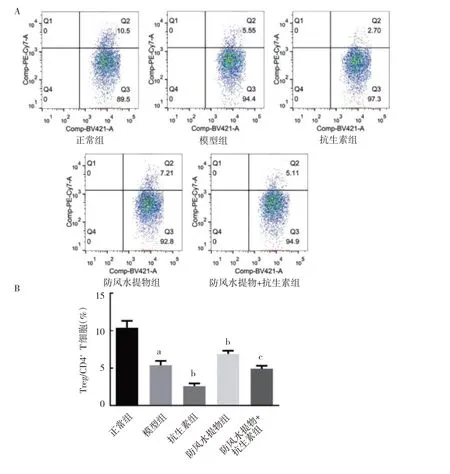
图2 5 组小鼠脾脏CD4+CD25+Foxp3+Treg/CD4+ T 细胞比例比较(A:流式细胞术检测结果;
B:Treg 细胞/CD4+T 细胞比例比较)
2.7 5 组小鼠鼻黏膜组织TLR4/TRAF6/IκBα/NF-κB p65 通路相关蛋白表达水平比较 与正常组比较,模型组小鼠鼻黏膜组织TLR4、TRAF6、p-IκBα/IκBα、NF-κB p65 蛋白表达水平均升高(均P<0.05);
与模型组比较,抗生素组小鼠鼻黏膜组织TLR4、TRAF6、p-IκBα/IκBα、NF-κB p65 蛋白表达水平均升高(均P<0.05),而防风水提液组小鼠鼻黏膜组织TLR4、TRAF6、p-IκBα/IκBα、NF-κB p65 蛋白表达水平均降低(均P<0.05)。与抗生素组比较,防风水提物+抗生素组小鼠鼻黏膜组织TLR4、TRAF6、p-IκBα/IκBα、NF-κB p65 蛋白表达水平降低(均P<0.05)。见图3。

图3 5 组小鼠鼻黏膜组织TLR4、TRAF6、p-IκBα/IκBα、NF-κB p65 蛋白表达水平比较(A:蛋白表达电泳图;
B:TLR4 蛋白表达水平比较;
C:TRAF6 蛋白表达水平比较;
D:p-IκBα/IκBα 蛋白表达水平比较;
E:NF-κB p65 蛋白表达水平比较)
从病理生理机制来看,AR 是一种全身变态反应导致鼻部气道黏膜发生持续慢性炎症的过敏性疾病,机体异常的免疫反应在AR 的发生过程中发挥作用[8]。目前研究认为,Th1/Th2 细胞免疫失衡,以及Treg 细胞生成减少为AR 发生提供了免疫环境[1]。Th1细胞通过分泌IL-2、IFN-γ 等参与细胞免疫应答,Th2细胞主要通过IL-4 参与体液免疫应答,Th1/Th2 失衡与AR 的过敏反应有关[9-10]。Treg 细胞为机体发挥负向免疫调节的细胞,可通过分泌细胞因子如IL-10、TGF-β1 等抑制异常的Th2 反应,起到维持Th1/Th2 平衡的作用[8]。临床研究表明,降低AR 患者血清Th2 型细胞因子水平,提高Treg 数量可有效缓解AR 症状[11]。而含防风的中药可降低AR 患者外周IL-4、IFN-γ 水平,提示防风具有抑制Th2 型细胞因子分泌的作用[12]。
Ren 等[13]用OVA 诱导BALB/c 小鼠后,小鼠血清OVA 特异性IgE 水平升高,脾脏CD4+CD25+Treg 细胞比例降低,Th2 型细胞因子水平升高,小鼠出现AR 症状。本研究用OVA 致敏小鼠后,小鼠鼻腔组织肥大细胞和炎症细胞浸润增加,体内致敏IgE、组胺、白三烯含量增加,Th1/Th2 因子失衡,脾脏CD4+CD25+Foxp3+Treg/CD4+T 细胞比例降低,小鼠AR 症状明显。肠道微生物可通过平衡Th1 与Th2 细胞间的活动调节机体对应变原的耐受反应[14]。冯月等[15]研究指出,抗生素的过量加重了AR 小鼠出现肠道菌群紊乱,进一步诱导了肺组织中Th1/Th2 失衡,抑制肺组织Treg 细胞的生成。本研究发现,在OVA 诱导小鼠后加用抗生素,小鼠的AR 症状进一步加重,Th1/Th2失衡,脾脏内CD4+CD25+Foxp3+Treg 细胞生成减少,小鼠体内致敏因子和炎症反应程度增加。而防风水提物则对小鼠的AR 具有改善作用,其能诱导脾脏内Treg 细胞的生成,增加Treg 型IL-10、TGF-β1 水平,并能抑制Th2 型细胞因子IL-4 的分泌,降低小鼠体内致敏因子含量和炎症反应程度,且对抗生素加重的小鼠AR 也具有显著改善作用和相同的免疫调节作用。
屈映等[16]通过网络药理学研究发现防风的免疫调节作用与抑制TLR 有关。TLR4 表达于免疫细胞表面识别包括过敏原在内的外来抗原的成分,可激发免疫细胞应答的发生,并能诱导Th2 细胞的分化[17-19]。徐琛等[20]研究表明,抑制鼻黏膜TLR4/NF-κB p65 通路的激活,可降低炎症细胞因子水平而对大鼠AR 具有治疗作用。TLR4/TRAF6/NF-κB p65 通路激活可引起Th1/Th2 细胞失衡,其作用机制为TLR4 激活后促进ARAF6蛋白表达,后者激活炎症介质关键效应转录子NF-κB信号,发挥细胞的炎症反应作用[21-22]。IκBα对NF-κB激活释放炎性因子释放十分关键,Zhu 等[23]发现抑制IκBα磷酸化表达能够减少NF-κB 介导的炎症因子IL-6、TNF-α的释放。侯道荣等[24]用脂多糖诱导细胞炎症后,细胞内TLR4、p-IκBα/IκBα、NF-κB p65 蛋白表达激活。本研究发现,TLR4、TRAF6、p-IκBα/IκBα、NF-κB p65在OVA诱导的小鼠鼻黏膜组织中显著表达,在加用抗生素后这些分子蛋白的表达更为显著,提示抗生素能够促进TLR4/TRAF6/IκBα/NF-κB p65 通路表达,进一步诱导机体免疫失衡,加重小鼠AR症状。而防风水提物干预后,小鼠鼻黏膜组织TLR4、TRAF6、NF-κB p65以及p-IκBα/IκBα的表达均下降,提示防风水提物可通过抑制小鼠鼻黏膜中激活的TLR4/TRAF6/IκBα/NF-κB p65,调节小鼠机体免疫,从而改善AR症状。
综上所述,抗生素加剧了OVA 诱导小鼠的AR 症状,而防风水提物具有改善小鼠AR 的作用,其机制可能与抑制小鼠鼻黏膜组织TLR4/TRAF6/IκBα/NF-κB p65 通路激活,改善免疫反应有关。
猜你喜欢提物风水脾脏岭南山竹子醇提物对溃疡性结肠炎小鼠的作用世界科学技术-中医药现代化(2022年3期)2022-08-22一个家庭的好风水来自哪里?海峡姐妹(2018年4期)2018-05-19飞龙掌血醇提物的抗炎镇痛作用中成药(2018年1期)2018-02-02葫芦钻水提物的抗炎镇痛作用及其急性毒性中成药(2017年5期)2017-06-13风水——环境感应心理学 换一个角度看风水(中篇)中华建设(2017年3期)2017-06-08保留脾脏的胰体尾切除术在胰体尾占位性病变中的应用临床医药文献杂志(电子版)(2017年11期)2017-05-17对诊断脾脏妊娠方法的研究当代医药论丛(2017年22期)2017-04-12养好你喜欢的女人,就是养好你自己的风水海峡姐妹(2016年2期)2016-02-27腹腔镜脾切除术与开腹脾切除术治疗脾脏占位的比较中国卫生标准管理(2015年15期)2016-01-15风水鱼小说月刊(2014年8期)2014-04-19推荐访问:小鼠 抗生素 加重推荐文章
- [高考励志:倒计时冲刺语录] 高考倒计时励志语录
- 2018江苏高考成绩查询入口,点击进入:江苏高考2018成绩查询
- [英语阅读:细数英语中那些出口的汉语]带汉语的英语阅读视频
- 双语阅读:英文吐槽“变凉”的天气_喜剧中心吐槽大会2018
- 2018年福建高考成绩查询网址:http://www.eeafj.cn/:2018福建二建成绩查询
- 小学五年级下册语文阅读理解练习题五道_5年级下册语文书人教版
- 河北教育考试院2018高考查分_福建教育考试院网2018年高考查分系统
- 2018年山西省拟录用公务员公示 [2018年浙江瑞安市各级机关公务员拟录用人员公示(五)]
- 好舌头绕口令 [英语绕口令:挑战你的舌头]
- [2018福建高考成绩什么时候可以查询] 2018中级会计成绩查询