曲妥珠单抗联合化疗对人表皮生长因子受体,-2阳性转移性,乳腺癌患者免疫功能及肿瘤标志物水平的影响
来源:优秀文章 发布时间:2023-04-16 点击:
叶惠兰
(射阳县人民医院肿瘤科,江苏 盐城 224300)
人表皮生长因子受体-2(HER-2)阳性乳腺癌为一种具有特殊生物学行为的乳腺癌,相较于其他乳腺癌,该类型乳腺癌恶性程度更高,复发和转移率也更高,患者预后较差。现阶段,化疗为治疗HER-2阳性乳腺癌的首选方式,通过多西他赛化疗可有效将肿瘤细胞杀灭,控制患者疾病进展,但单纯化疗效果不明显[1]。分子靶向药物可直接作用于癌细胞的某些位点,其中曲妥珠单抗作为一种靶向药物,通过与肿瘤细胞上的HER-2蛋白特异性结合,阻断HER-2表达,从而抑制HER-2阳性乳腺癌患者体内肿瘤细胞的增殖,具有靶向性好、耐受性好等优势[2]。基于此,本研究旨在探讨曲妥珠单抗联合化疗治疗HER-2阳性转移性乳腺癌的临床效果,现报道如下。
1.1 一般资料 按照随机数字表法将射阳县人民医院2019年1月至2022年5月收治的66例HER-2阳性转移性乳腺癌患者分为两组,各33例。参照组患者年龄40~70岁,平均(55.00±6.50)岁;
病程1~6年,平均(3.50±0.43)年。试验组患者年龄41~69岁,平均(55.00±6.45)岁;
病程2~5年,平均(3.50±0.40)年。比较两组患者年龄、病程等一般资料,差异无统计学意义(P>0.05),组间可比。纳入标准:TNM分期为Ⅲ~Ⅳ期者;
符合《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》[3]中的相关诊断标准,且经穿刺活检为HER-2阳性者;
有化疗、分子靶向治疗指征者等。排除标准:自身免疫性疾病者;
预计生存期<6个月者;
合并重要脏器病变者;
内分泌疾病者;
有化疗史者等。本研究经射阳县人民医院医学伦理委员会批准实施,所有HER-2阳性转移性乳腺癌患者均签署知情同意书。
1.2 治疗方法 给予参照组患者多西他赛注射液(辰欣药业股份有限公司,国药准字H20093647,规格:0.5 mL∶20 mg)75 mg/m2静脉滴注,治疗第1天给药, 1次/3周,持续3周为1个疗程。给予试验组患者曲妥珠单抗联合化疗:化疗方案同于参照组,并给予患者注射用曲妥珠单抗[Genentech Inc.,注册证号J20180073,规格:440 mg(20 mL) / 瓶]静脉滴注,治疗第1天给药,首次剂量为4 mg/kg体质量,之后2 mg/kg体质量,1次/周,3周为1个疗程。两组患者均治疗6个疗程后随访4周。
1.3 观察指标 ①治疗后判定临床疗效,包括完全缓解:HER-2阳性转移性乳腺癌患者病灶完全消失且维持≥ 4周;
部分缓解:HER-2阳性转移性乳腺癌患者目标病灶基线长径之和减少≥ 30%,且维持≥ 4周;
疾病稳定:HER-2阳性转移性乳腺癌患者目标病灶基线长径之和减少<30%,或者病灶基线长径之和增大<20%;
疾病进展:HER-2阳性转移性乳腺癌患者目标病灶基线长径之和增大20%及以上,或者出现新病灶[4]。计算两组患者临床总有效率,总有效率=(完全缓解+部分缓解)例数/总例数×100%。②抽取患者静脉血5 mL置于离心管中,离心取血清(3000 r/min,10 min),采用酶联免疫吸附法检测血清癌胚抗原(CEA)、糖类抗原153(CA153)、组织多肽特异性抗原(TPS)水平。③采血方法同②,应用流式细胞仪(美国贝克曼公司,型号:CytoFLEX)检测外周血CD3+、CD4+、CD8+百分比。④采血、血清制备、指标检测方法同②,对血清白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、肿瘤坏死因子-α(TNF-α)水平进行检测。⑤分别记录参照组和试验组患者白细胞计数降低、肝损害、骨髓抑制、恶心呕吐等发生情况,以评估两种方式治疗HER-2阳性转移性乳腺癌的安全性。
1.4 统计学方法 通过SPSS 22.0统计学软件对本研究数据进行计算处理,计数资料以[ 例(%)]表示,采用χ2检验;
本研究计量资料经S-W法检验均符合正态分布,以(±s)表示,采用t检验。以P<0.05为差异有统计学 意义。
2.1 两组患者临床疗效比较 两组间临床总有效率比较,试验组更高,差异有统计学意义(P<0.05),见表1。

表1 两组患者临床疗效比较[例(%)]
2.2 两组患者血清肿瘤标志物水平比较 较治疗前,治疗后两组患者肿瘤标志物水平均显著降低,且组间比较,试验组更低,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者血清肿瘤标志物水平比较( ±s)

表2 两组患者血清肿瘤标志物水平比较( ±s)
注:与治疗前比,*P<0.05。CEA:癌胚抗原;
CA153:糖类抗原153;
TPS:组织多肽特异性抗原。
组别 例数 CEA(µg/L) CA153(U/mL) TPS(µg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后参照组 33 55.28±6.55 9.83±0.87* 52.11±10.23 24.50±5.21* 24.12±2.80 19.21±3.40*试验组 33 55.32±6.61 5.59±0.72* 53.02±10.92 9.72±1.02* 25.01±2.76 13.89±3.22*t值 0.025 21.568 0.349 15.993 1.300 6.526 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者T细胞亚群比较 治疗后两组患者外周血CD3+、CD4+百分比均较治疗前显著降低,而试验组上述指标显著高于参照组,差异均有统计学意义(均P<0.05);
两组患者外周血CD8+百分比组内与组间比较,差异均无统计学意义(均P>0.05),见表3。
表3 两组患者T细胞亚群比较(%, ±s)

表3 两组患者T细胞亚群比较(%, ±s)
注:与治疗前比,*P<0.05。
组别 例数 CD3+ CD4+ CD8+治疗前 治疗后 治疗前 治疗后 治疗前 治疗后参照组 33 62.31±5.62 52.91±5.45* 31.20±4.94 23.12±5.02* 29.42±5.96 28.92±6.12试验组 33 61.98±5.65 56.21±5.52* 31.23±4.92 26.88±4.87* 29.45±5.94 29.09±6.15 t值 0.238 2.444 0.025 3.088 0.020 0.113 P值 >0.05 <0.05 >0.05 <0.05 >0.05 >0.05
2.4 两组患者炎症因子水平比较 治疗后两组患者炎症因子水平均显著低于治疗前,且组间比较,试验组更低,差异均有统计学意义(均P<0.05),见表4。
表4 两组患者炎症因子水平比较( ±s)

表4 两组患者炎症因子水平比较( ±s)
注:与治疗前比,*P<0.05。IL-6:白细胞介素-6;
IL-8:白细胞介素-8;
TNF-α:肿瘤坏死因子-α。
组别 例数 IL-6(ng/mL) IL-8(ng/mL) TNF-α(µg/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后参照组 33 41.29±5.82 28.96±4.78* 3.63±0.26 2.35±0.38* 1.74±0.26 1.26±0.25*试验组 33 42.08±5.85 21.43±4.32* 3.65±0.27 1.61±0.35* 1.75±0.24 0.87±0.18*t值 0.550 6.714 0.307 8.228 0.162 7.273 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.5 两组患者不良反应发生情况比较 两组间不良反应总发生率比较(18.18%和27.27%),差异无统计学意义(P>0.05),见表5。
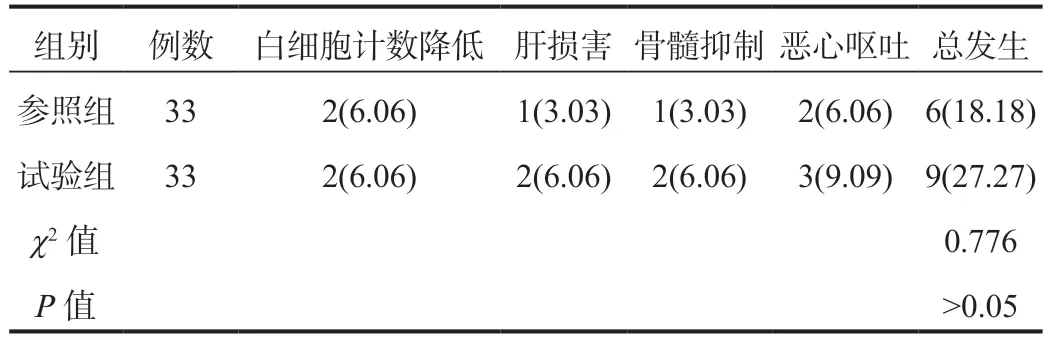
表5 两组患者不良反应发生情况比较[ 例(%)]
HER-2阳性乳腺癌与其他类型乳腺癌比较,恶性程度更高,预后更差,而该类患者若出现转移的情况,通常情况下无法进行手术切除,需采用化疗以尽可能地控制肿瘤生长。多西他赛可与游离的微管蛋白结合,促进微管双聚体装配成微管,抑制其解聚,可稳定微管状态,使细胞停滞在细胞周期的G2及M期,最终抑制癌细胞的有丝分裂与增殖,但部分患者会出现耐药、对化疗药物不敏感的问题,单纯进行化疗的效果不理想[5]。
曲妥珠单抗是靶向治疗HER-2阳性乳腺癌的单克隆抗体,主要作用于HER-2受体,通过阻断HER-2所介导的细胞增殖和细胞生存信号转导通路,消灭肿瘤细胞,缩小肿瘤体积,从而抑制血清肿瘤标志物的释放,对治疗HER-2阳性转移性乳腺癌具有特异性[6-7]。CEA是恶性肿瘤细胞膜的结构蛋白,可在乳腺癌组织中表达,并分泌于体液中,对于病情预测和疗效判定具有较高的临床价值;
CA153为乳腺癌重要的特异性标志物,多数乳腺癌患者机体内的血清CA153水平会明显升高;
TPS水平与乳腺癌组织恶性程度关系密切,肿瘤细胞增殖活跃期间其水平呈明显高表达。本研究两组临床疗效和肿瘤标志物检测结果显示,相较于参照组,治疗后试验组患者的血清CEA、CA153、TPS水平显著降低,临床总有效率显著升高,提示曲妥珠单抗联合多西他赛治疗HER-2阳性转移性乳腺癌的效果更好,可显著改善患者肿瘤标志物水平。
乳腺癌患者普遍存在免疫抑制,T淋巴细胞是反映机体免疫系统活性的细胞,T细胞亚群水平降低提示免疫功能下降[8]。IL-6、IL-8、TNF-α等炎症因子水平升高会调节细胞间黏附作用,促进肿瘤的特异性抗原表达,同时促使肿瘤新生血管的生成,参与HER-2阳性转移性乳腺癌患者体内肿瘤细胞的增殖、侵袭和转移[9]。本研究中统计学结果显示,治疗后试验组患者血清炎症因子水平低于参照组,外周血CD3+、CD4+百分比均显著高于参照组,组间不良反应总发生率比较(18.18%和27.27%),差异无统计学意义,表明结合曲妥珠单抗可减轻对患者的免疫损伤,减轻炎症反应,且不会明显增加药物不良反应。分析原因可能为,除乳腺癌患者自身存在免疫抑制外,化疗也可破坏机体的正常免疫细胞细胞,导致机体免疫力低下,而曲妥珠单抗产生的抗体依赖性细胞毒效应可促使HER-2阳性转移性乳腺癌患者体内免疫细胞聚集,从而杀死肿瘤细胞,对机体免疫功能进行改善,缓解体内炎症反应,且该药还具有高选择性、高效、低毒的特点,可以克服患者对化疗的耐受,安全性较好[10]。
综上,对于HER-2阳性转移性乳腺癌患者,应用曲妥珠单抗联合多西他赛可降低患者血清肿瘤标志物水平,抑制炎症反应,治疗效果更佳,且对机体免疫功能影响更小,药物安全性较高,值得临床推广及应用。
猜你喜欢转移性单抗标志物FOLFOXIRI联合贝伐单抗±阿替利珠单抗治疗转移性结直肠癌实用肿瘤学杂志(2022年3期)2022-11-30SPECT/CT显像用于诊断转移性骨肿瘤的临床价值医学概论(2022年3期)2022-04-24司库奇尤单抗注射液皮肤性病诊疗学杂志(2020年4期)2020-09-02脓毒症早期诊断标志物的回顾及研究进展中华老年多器官疾病杂志(2016年9期)2016-04-28耐奥沙利铂人胃癌SGC-7901细胞具有高侵袭转移性及上皮间质转化特征中国组织化学与细胞化学杂志(2016年4期)2016-02-27使用抗CD41单抗制备ITP小鼠的研究中国卫生标准管理(2015年16期)2016-01-20冠状动脉疾病的生物学标志物医学研究杂志(2015年7期)2015-06-22非远处转移性高危分化型甲状腺癌的低剂量碘-131治疗中国医学科学院学报(2015年5期)2015-03-01肿瘤标志物在消化系统肿瘤早期诊断中的应用现代检验医学杂志(2015年6期)2015-02-06MR-proANP:一种新型心力衰竭诊断标志物现代检验医学杂志(2015年5期)2015-02-06推荐访问:受体 阳性 化疗