新疆管花肉苁蓉生物活性物质及产地差异分析
来源:优秀文章 发布时间:2023-04-09 点击:
牛玉清,赵岩,于鑫淼,宋丽军
1.商丘市质量技术监督检验测试中心,河南 商丘 221000;
2.塔里木大学 生命科学学院,新疆 阿拉尔 843300;
3.河北科技师范学院 食品科技学院,河北 秦皇岛 066600
管花肉苁蓉(Cistanchetubulosa(Schrenk)Wight),又称红柳大芸[1],与荒漠肉苁蓉共同被《中华人民共和国药典》收录为肉苁蓉基源植物,2018年被国家卫健委收录于“食药同源”目录[2]。管花肉苁蓉含有多种生物活性物质,如多酚类、多糖类、苯乙醇苷类、环烯醚萜及其苷类等[3],具有抗氧化[4]、抗疲劳[5]、降血糖、降血脂[6]、免疫调节[7]、保护神经[8]、预防骨质疏松[9-10]、润肠通便[11-12]、增强记忆力[13]等多种功能活性,有“沙漠人参”之美誉。
管花肉苁蓉专性寄生于柽柳属植物的根部,在我国新疆塔克拉玛干沙漠周边的和田、喀什、阿克苏等地区均有分布。研究[14]发现,不同地理位置具有不同的光照、降雨、温度及土壤条件,会对植物的生长发育及内在品质产生不同程度的影响。
《中华人民共和国药典》主要以松果菊苷、毛蕊花糖苷含量作为评价管花肉苁蓉品质的指标[2],但管花肉苁蓉中的生物活性物质较复杂,除上述两种物质外,总多酚、总黄酮、总多糖、总三萜、总原花青素等均具有广泛的药理作用。因此,采用多指标质量评价方法能够更全面地评价管花肉苁蓉药材的品质[1]。基于此,本文拟以新疆塔克拉玛干沙漠地区管花肉苁蓉为研究对象,考查不同产地管花肉苁蓉中生物活性物质的种类、含量及其抗氧化活性,并采用相关性分析、主成分分析及系统聚类分析进行综合评价,以期明确新疆不同产地管花肉苁蓉的品质差异,为加强管花肉苁蓉及其制品的品质控制,以及促进管花肉苁蓉精深加工和综合开发利用提供理论支持和参考。
1.1 材料、试剂与仪器
1.1.1 主要材料取自塔克拉玛干沙漠6个产地(产地A—产地F)的样品均为管花肉苁蓉干燥肉质茎,详细信息见表1。每个产地取1 kg样品(15~20 cm),将样品平均分成3份后,取根部、中部、顶部,分别命名为1、2和3(图1)[15-16]。不同样品经切分、冷冻干燥后,粉碎并过50目筛,真空密封包装。
1.1.2 主要试剂乙腈、甲酸,色谱纯,德国Merck公司产;
毛蕊花糖苷标准品、松果菊苷标准品,色谱纯,上海安倍尔有限公司产。其他常规化学试剂均为分析纯,北京索莱宝公司产。

表1 管花肉苁蓉样品信息Table 1 Sample information of C.tubulosa(Schrenk) Wight

图1 管花肉苁蓉不同部位划分示意图[15-16]Fig.1 Schematic diagram of different parts of C.tubulosa (Schrenk) Wight[15-16]
1.1.3 主要仪器与设备Pilot3-6 m型冷冻干燥机,北京博医康实验仪器有限公司产;
TGL-20B型离心机,上海安亭科学仪器有限公司产;
756型紫外可见分光光度计,上海箐华科技仪器有限公司产;
LC-20AB型高效液相色谱仪,日本岛津公司产;
Synergy H1型多功能酶标仪,博腾仪器有限公司产。
1.2 生物活性物质的测定
1.2.1 总多酚含量测定参照F.H.Li等[17]的方法。样液的制备:称取0.50 g样品,以70%(如无特指,文中百分数均指体积分数)的乙醇溶液为提取溶剂,料液比为1∶40(g/mL,下同),于60 ℃、250 W超声装置中提取40 min,冷却后于4000 r/min条件下离心10 min,收集上清液并定容至50 mL,备用。取1 mL样液,加入5 mL 10%的福林酚溶液,振荡摇匀,静置15 min后,加入4 mL 质量分数为7.5%的Na2CO3溶液,振荡摇匀,避光静置20 min后,测定其吸光度(A765),结果以没食子酸当量(mg GAE/g DW)表示。
1.2.2 总黄酮含量测定参照张文叶等[18]的方法。取1 mL样液(同1.2.1)于10 mL棕色容量瓶中,加入0.3 mL 质量分数为5%的NaNO2溶液,振荡摇匀,静置15 min后,依次加入0.3 mL质量分数为10%的Al(NO3)3溶液、4 mL 质量分数为4%的NaOH溶液,用50%的乙醇溶液定容至10 mL,振荡摇匀,避光静置20 min后,测定其吸光度(A510),结果以芦丁当量(mg RE/g DW)表示。
1.2.3 总三萜含量测定参照何策等[19]的方法。取0.4 mL样液(同1.2.1),水浴使其挥发干后,依次加入新配制的0.4 mL 1.5%的香草醛-冰乙酸溶液、1.6 mL高氯酸,70 ℃水浴15 min,冷却后加入5 mL乙酸乙酯,静置10 min后,测定其吸光度(A560),结果以齐墩果酸当量(mg OAE/g DW)表示。
1.2.4 总多糖含量测定参照张雅丹等[20]的方法。样液的制备:称取1.00 g样品,以去离子水为提取溶剂,料液比为1∶30,于60 ℃、250 W超声装置中提取50 min,冷却后于4000 r/min条件下离心10 min,收集上清液,加入4倍体积95%的乙醇溶液,4 ℃条件下静置12 h后,于5000 r/min条件下离心,收集沉淀,并依次用丙酮、乙醚、无水乙醇反复清洗2次,加入适量去离子水复溶后,进行脱蛋白(Sevage法)、脱色素(活性炭法)处理,定容至10 mL,待测。取1 mL样液,依次加入0.6 mL 6%的苯酚溶液、3 mL浓H2SO4,振荡摇匀后,沸水浴10 min,冷却后,测定其吸光度(A490),结果以葡萄糖当量(mg DE/g DW)表示。
1.2.5 原花青素含量测定参照吕筱等[21]的方法。样液的制备:称取0.50 g样品,以80%的乙醇溶液为提取溶剂,料液比为1∶30,于50 ℃、250 W超声装置中提取40 min,冷却后,于4000 r/min条件下离心10 min,收集上清液,定容至50 mL,备用。取0.5 mL样液,依次加入3 mL 4%的香草醛-甲醇溶液、1.5 mL浓HCl,反应15 min后,测定其吸光度(A500),结果以原花青素当量(mg PCE/g DW)表示。
1.2.6 松果菊苷和毛蕊花糖苷含量测定参照许明君等[22]的方法。样液的制备:称取1.00 g样品,以80%的乙醇溶液为提取溶剂,料液比为1∶30,于60 ℃、250 W超声装置中提取40 min,冷却后,于4000 r/min条件下离心10 min,收集上清液,定容至50 mL,备用。色谱柱为Alltima C18柱(4.6 mm×250 mm×5 μm),流动相为0.4%的甲酸水溶液(A)-乙腈(B),柱温为25 ℃,流速为1.00 mL/min,进样量为10 μL,检测波长为330 nm。采用外标法进行定量分析。
1.2.7 体外抗氧化活性测定样液的制备:称取1.20 g样品,以60%的乙醇溶液为提取溶剂,料液比为1∶25,于60 ℃、250 W超声装置中提取40 min,冷却后,于4500 r/min条件下离心15 min,收集上清液;
取多份适量上清液,经60%的乙醇溶液稀释至样液质量浓度分别为1 mg/mL、3 mg/mL、5 mg/mL、10 mg/mL、20 mg/mL、30 mg/mL、40 mg/mL,待测。
1)DPPH自由基清除能力。参照许春平等[23]的方法。取10 μL样液,加入250 μL DPPH溶液,混匀后,加入酶标板中,室温避光25 min,以60%的乙醇溶液为空白对照,测定其吸光度(A517),按照下式计算DPPH自由基清除率。

式中:A0为60%的乙醇溶液代替样液的吸光度(空白对照);
A1为样液与DPPH溶液混合后的吸光度;
A2为无水乙醇代替DPPH溶液的吸光度。
2)ABTS自由基清除能力。参照孔钰婷等[24]的方法。ABTS母液为去离子水配制的过硫酸钾(终浓度为2.45 mmol/L)和ABTS(终浓度为7 mmol/L)的混合溶液,于25 ℃、避光条件下静置12 h。使用ABTS母液前,用去离子水稀释,使其吸光度(A734)为0.70±0.05,即为ABTS工作液。取10 μL样液(1~40 mg/mL),加入酶标板中,再加入200 μL ABTS工作液,室温避光30 min,以60%的乙醇溶液为空白对照,测定其A734,按照下式计算ABTS自由基清除率。


1.3 数据分析
所有数据均平行测定3次,结果以(平均值±标准差)表示。利用Origin 2019进行主成分分析和系统聚类分析,利用SPSS Statistics 26进行方差分析,P<0.05表示差异显著。
2.1 不同产地管花肉苁蓉生物活性物质含量分析
图2为不同产地管花肉苁蓉中生物活性物质含量,其中不同小写字母表示组间差异显著(P<0.05),下同。由图2a)可知,A、B、C、D 四产地样品中,根部总多酚含量显著高于中部和顶部;
E、F两产地样品中,顶部总多酚含量较高。各产地样品中,总多酚含量最高的是A1(28.32 mg GAE/g DW),其次是D1(26.41 mg GAE/g DW)和F3(25.69 mg GAE/g DW);
总多酚含量最低的是A3(7.45 mg GAE/g DW)。各产地样品3个部位总多酚含量的平均值顺序为:F(23.57 mg GAE/g DW)>D(19.44 mg GAE/g DW)>E(19.17 mg GAE/g DW)>C(18.67 mg GAE/g DW)>B(18.41 mg GAE/g DW)>A(16.87 mg GAE/g DW)。
由图2b)可知,A、B、C、D 四产地样品中,顶部总黄酮含量显著高于中部和根部。各产地样品中,总黄酮含量最高的是A3(14.66 mg RE/g DW),其次是A2(13.48 mg RE/g DW)。各产地样品3个部位总黄酮含量的平均值顺序为:A(13.15 mg RE/g DW)>E(11.71 mg RE/g DW)>F(6.53 mg RE/g

图2 不同产地管花肉苁蓉中生物活性物质含量Fig.2 Bioactive components content of C.tubulosa (Schrenk) Wight from different origins
DW)>B(4.88 mg RE/g DW)>C(4.83 mg RE/g DW)>D(3.93 mg RE/g DW)。
由图2c)可知,A、B、D、E 四产地样品中,根部总三萜含量较高;
C、F 两产地样品中,顶部总三萜含量较高。各产地样品中,总三萜含量最高的是F3(14.43 mg OAE/g DW)和B1(13.78 mg OAE/g DW)。各产地样品3个部位总三萜含量平均值顺序为:F(13.54 mg OAE/g DW)>A(13.01 mg OAE/g DW)>B(11.26 mg OAE/g DW)>C(10.97 mg OAE/g DW)>E(9.77 mg OAE/g DW)>D(9.30 mg OAE/g DW)。
由图2d)可知,A、B、D、E 四产地样品中,根部总多糖含量显著高于其他部位,这与杨太新等[25]的研究结果一致。各产地样品中,总多糖含量最高的是A1(32.34 mg DE/g DW),其次是E1(26.52 mg DE/g DW)和B1(25.78 mg DE/g DW);
总多糖含量最低的是D3(7.24 mg DE/g DW)。C、F两产地样品中,C3(25.4 mg DE/g DW)和F3(24.24 mg DE/g DW)总多糖含量较高。各产地样品3个部位总多糖含量的平均值顺序为:A(20.41 mg DE/g DW)>C(18.75 mg DE/g DW)>E(18.57 mg DE/g DW)>F(17.53 mg DE/g DW)>B(16.91 mg DE/g DW)>D(10.07 mg DE/g DW)。
由图2e)可知,除产地A、B之外,其他四产地样品中的顶部原花青素含量均高于其他部位,其中C3(5.56 mg PCE/g DW)、D3(5.73 mg PCE/g DW)和F3(5.93 mg PCE/g DW)原花青素含量较高。各产地样品3个部位原花青素含量的平均值顺序为:F(4.86 mg PCE/g DW)>D(4.70 mg PCE/g DW)>C(4.00 mg PCE/g DW)>A(3.99 mg PCE/g DW)>B(3.37 mg PCE/g DW)>E(3.28 mg PCE/g DW)。
由图2f)可知,A、B、E 三产地样品中,根部松果菊苷含量均较高,其中B1含量达到41.72 mg/g DW;
C、D、F 三产地样品中,顶部松果菊苷含量较高,其中C3含量高达32.88 mg/g DW,其次是F3(27.26 mg/g DW)。各产地样品3个部位松果菊苷含量的平均值顺序为:B(31.63 mg/g DW)>F(22.52 mg/g DW)>C(20.84 mg/g DW)>A(18.65 mg/g DW)>E(14.46 mg/g DW)>D(3.97 mg/g DW)。由图2g)可知,A、E 两产地样品中,根部毛蕊花糖苷含量均较高;
B、C、D、F四产地样品中,均为顶部毛蕊花糖苷含量较高,其中含量最高的是B3(9.32 mg/g DW),其次是F3(8.47 mg/g DW)和C3(7.84 mg/g DW)。各产地样品3个部位毛蕊花糖苷含量的平均值顺序为:B(7.91 mg/g DW)>F(6.12 mg/g DW)>C(5.39 mg/g DW)>A(4.92 mg/g DW)>E(4.12 mg/g DW)>D(1.65 mg/g DW)。郭雄飞等[1,15]研究了管花肉苁蓉不同部位松果菊苷和毛蕊花糖苷的含量,结果表明根部松果菊苷和毛蕊花糖苷含量显著高于其他部位;
王果平等[26]研究发现,南疆不同产地管花肉苁蓉中松果菊苷含量为0.35%~11.93%。本研究大部分样品的根部总多酚、总多糖、总三萜含量相对较高,而个别样品根部的个别成分含量较低,具体原因尚需进一步研究。
综上所述,在大部分样品的不同部位,根部的总多酚、总三萜、总多糖含量较高,顶部的总黄酮和总原花青素含量较高;
对于不同产地样品,B产地样品的毛蕊花糖苷和松果菊苷含量最高,A产地样品的总黄酮、总三萜含量较高。
2.2 不同产地管花肉苁蓉抗氧化活性分析
植物中不同生物活性物质可能会表现出协同或拮抗作用,因此测定植物样品提取物的抗氧化活性比测定单一物质的抗氧化活性更具代表性[27]。图3为不同产地管花肉苁蓉的抗氧化活性。由图3a)可知,不同产地样品对DPPH自由基的清除能力差异显著。抗氧化活性较强的样品有A1、B3、C3、D1、E1和F1,其IC50DPPH分别为0.76 mg/mL、0.55 mg/mL、0.14 mg/mL、0.57 mg/mL、1.38 mg/mL和0.69 mg/mL。各产地样品3个部位IC50DPPH的平均值分别为A(3.14 mg/mL)、B(1.40 mg/mL)、C(1.12 mg/mL)、D(3.00 mg/mL)、E(3.61 mg/mL)和F(1.05 mg/mL),均小于7.00 mg/mL。F产地样品对DPPH自由基的清除能力最强,E产地样品对DPPH自由基的清除能力最弱。

图3 不同产地管花肉苁蓉的抗氧化活性Fig.3 antioxidant activities of C.tubulosa (Schrenk) Wight from different origins
由图3b)可知,不同产地样品对ABTS自由基的清除能力差异显著。抗氧化活性较强的样品有A1、B1、C3、D1、E1和F3,其IC50ABTS分别为1.07 mg/mL、0.91 mg/mL、0.81 mg/mL、1.93 mg/mL、1.41 mg/mL和1.23 mg/mL。各产地样品3个部位IC50ABTS平均值分别为A(1.88 mg/mL)、B(1.16 mg/mL)、C(1.19 mg/mL)、D(2.33 mg/mL)、E(1.49 mg/mL)和F(1.31 mg/mL),均小于3.00 mg/mL。B产地样品对ABTS自由基的清除能力最强,D产地样品对ABTS自由基的清除能力最弱。包斌等[27]研究发现,管花肉苁蓉甲醇和乙醇提取物的IC50DPPH分别为0.142 mg/mL和0.175 mg/mL,何梦梦等[12]研究发现,肉苁蓉水提物对DPPH和ABTS自由基清除率的IC50分别为0.225 mg/mL和1.819 mg/mL,这与本文研究结果较一致,显示管花肉苁蓉具有较强的抗氧化活性。
2.3 相关性分析
通过Pearson相关性分析对不同产地管花肉苁蓉各品质指标间的相关性进行统计分析,结果见表2。由表2可知,总多酚含量与总多糖含量呈显著正相关(P<0.05);
总三萜含量与总多糖、松果菊苷及毛蕊花糖苷含量呈显著正相关(P<0.05);
总多糖含量与松果菊苷含量呈显著正相关(P<0.05);
松果菊苷含量与毛蕊花糖苷含量呈极显著正相关(P<0.01);
IC50DPPH与总多酚、松果菊苷含量呈显著负相关(P<0.05),表明管花肉苁蓉对DPPH自由基的清除能力与总多酚、松果菊苷含量密切相关;
IC50 ABTS与总多酚、总多糖、松果菊苷及毛蕊花糖苷含量呈极显著负相关(P<0.01),与IC50DPPH呈极显著正相关(P<0.01),表明管花肉苁蓉对ABTS自由基的清除能力与总多酚、总多糖、松果菊苷及毛蕊花糖苷含量密切相关。
2.4 主成分分析及品质综合评价
对管花肉苁蓉各项指标进行主成分分析,根据各主成分的特征值和贡献率提取主成分,可以提高管花肉苁蓉品质评价的效率和可靠性[28],各主成分方差贡献率结果见表3。由表3可知,提取的3个主成分其特征值均>1,方差累计贡献率为80.57%,表明提取的3个主成分能够有效代表所有指标的大部分信息,综合反映管花肉苁蓉的品质特征。
将主成分因子进行旋转处理,其载荷值可反映主成分因子与各项指标之间的关系,结果如图4和表4所示。由图4和表4可知,PC1主要与总三萜、总多糖、松果菊苷及毛蕊花糖苷含量相关,PC2主要与总多酚和总黄酮含量相关,PC3主要与总原花青素含量相关。以3个主成分的方差贡献率为权重,构建如下管花肉苁蓉品质综合评价模型:
综合评价指数=46.24%F1+19.81%F2+14.52%F3
通过该模型可计算各产地样品得分(见表5)。进一步通过主成分分析将18个样品的7种品质因子降维成3项公因子,包含了80.57%的原始信息。以各项主成分因子的方差贡献率作为权重代入上述综合评价模型,对管花肉苁蓉品质进行综合评价,综合分值越高,表明该管花肉苁蓉品质越好[29-30]。以不同产地样品根部、中部、顶部综合评价指数的平均值为依据,对不同产地管花肉苁蓉进行品质排序,结果发现,各产地管花肉苁蓉的平均得分由高到低依次为A(0.445)>F(0.313)>B(0.051)>E(-0.057)>C(-0.071)>D(-0.680)。
2.5 聚类分析
基于不同产地管花肉苁蓉3个部位品质指标的平均值,对不同产地样品进行聚类分析[31],结果见图5。由图5可知,当距离为12.5时,可将6个产地聚为3类,第1类聚集了4个产地,分别为A、E、C和F。第2类和第3类各聚集了1个产地,分别为B和D。
表6为不同聚类中各测定指标的平均值。由表6可知,类群1中总多酚、总黄酮、总三萜和总多糖的平均含量最高;
类群2中松果菊苷和毛蕊花糖苷平均含量最高,总多酚和总原花青素平均含量最低,并且对DPPH和ABTS自由基清除能力最强;
类群3中总黄酮、总三萜、总多糖、松果菊苷及毛蕊花糖苷含量较低,且对DPPH和ABTS自由基清除能力最弱。
本文对我国新疆塔克拉玛干沙漠地区不同产地管花肉苁蓉中生物活性物质和抗氧化活性进行了比较分析。结果表明,不同产地样品及不同样品部位的品质和抗氧化活性差异显著。总多酚、总黄酮、总三萜、总多糖、总原花青素、松果菊苷和毛蕊花糖苷含量最高的产地分别为:阿拉尔市、喀什伽师县、阿拉尔市、喀什伽师县、阿拉尔市、和田墨玉县、和田墨玉县。各样品IC50DPPH均小于7.00 mg/mL,IC50ABTS均小于3.00 mg/mL;
对ABTS和DPPH自由基清除能力最强的样品产地分别为阿拉尔市和和田墨玉县。主成分分析共提取3个主成分,方差累计贡献率为80.57%;
聚类分析将不同产地样品分为3类;
综合评分最高的样品产地为喀什伽师县,其次为阿拉尔市和和田墨玉县。本文研究结果将为我国管花肉苁蓉品质评价、产品开发及其标准化提供基础数据和参考。

表2 不同产地管花肉苁蓉各品质指标间的相关性分析结果Table 2 Correlation analysis results of different quality indexes of C.tubulosa (Schreak) Wight from different origins
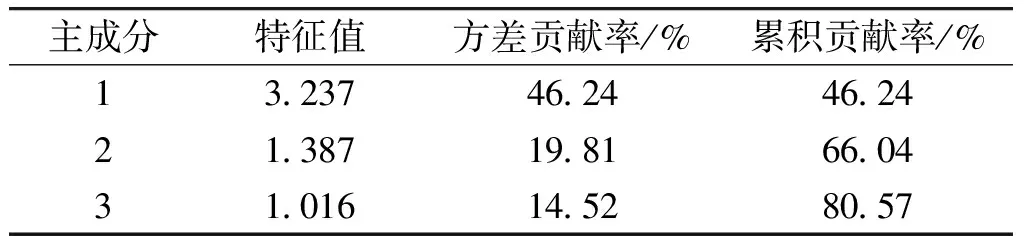
表3 各主成分方差贡献率Table 3 Percentage of variance of principal components

图4 主成分分析图Fig.4 The diagram of PCA
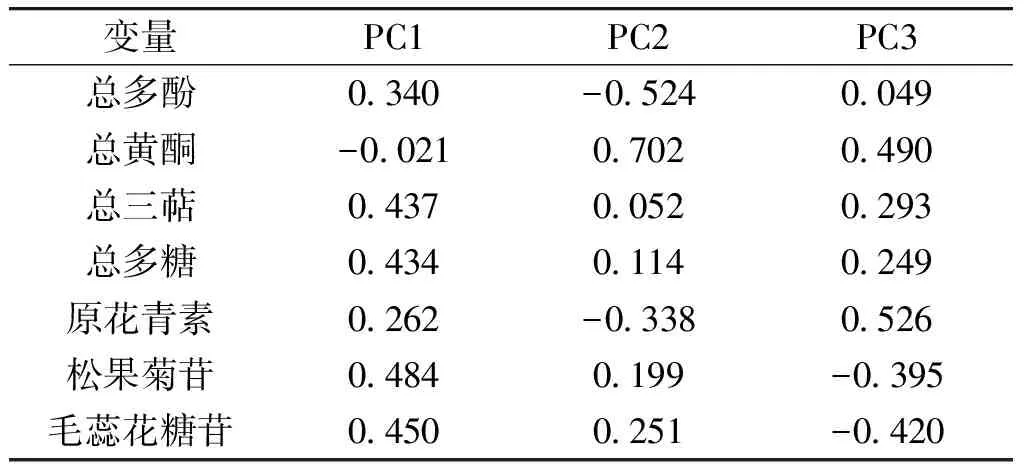
表4 各主成分因子向量载荷系数Table 4 Vector load coefficient of each principal component factor

表5 不同产地管花肉苁蓉品质预测评价结果Table 5 Quality prediction and evaluation results ofC.tubulosa (Schrenk) Wight from different origins

图5 聚类分析结果Fig.5 The result of HCA

表6 不同聚类中各品质指标的平均值Table 6 The mean values of the quality indexes in different clusters
猜你喜欢样液肉苁蓉松果工作用毛细管粘度计的不确定度商品与质量(2021年13期)2021-11-23基于网络药理学探讨肉苁蓉-巴戟天药对治疗股骨头坏死的作用机制世界科学技术-中医药现代化(2021年10期)2021-03-02大孔树脂纯化密花香薷总黄酮工艺研究湖南师范大学自然科学学报(2020年6期)2020-12-30摘松果数学小灵通(1-2年级)(2020年3期)2020-06-24羽绒清洁度检测方法的研究中国纤检(2019年1期)2019-01-12小松果小学生导刊(2018年34期)2018-12-18摘松果数学小灵通(1-2年级)(2018年4期)2018-05-07分松果数学小灵通(1-2年级)(2017年6期)2017-06-22红柳肉苁蓉人工栽培技术总结甘肃林业(2016年2期)2016-11-072BR-1肉苁蓉播种机的研制与应用新疆农垦科技(2014年10期)2014-02-28推荐访问:肉苁蓉 新疆 活性