酪蛋白胶束对原花青素稳定性的影响
来源:优秀文章 发布时间:2023-04-08 点击:
王楠,杨敏,郑杰,秦娟娟
(甘肃农业大学 理学院,甘肃 兰州,730070)
原花青素(proanthocyanidins,PCs)是一类广泛存在于植物中的天然多酚类化合物,分子结构中含多个酚羟基,具有广泛的药理学活性,如抗氧化、抗肥胖、抗糖尿病等。而且,PCs成本低、安全性高,在医药、食品等方面具有较高的利用价值。然而,PCs稳定性较差,在加工过程中易受到光照、温度、pH、氧化剂、金属离子等因素影响。因此,提高PCs稳定性是亟待解决的关键问题。目前,提高PCs稳定性的方法主要有化学法和物理法,其中化学法存在潜在的安全问题,物理方法更为常用。物理方法主要是通过加入保护气、辅色素、与生物大分子形成复合物等,以提高PCs的稳定性[1]。
生物大分子负载提升PCs稳定性是基于PCs和大分子间以氢键、疏水作用、静电作用等次级键结合,既不会影响PCs天然结构,又不会产生新的物质,安全性高,是提高PCs稳定性的主要手段。蛋白质、糖类、脂类等生物大分子是负载PCs的主要基质,负载后PCs稳定性提升显著,如β-环糊精添加量为2 500 mg/L时,可显著提高紫薯花色苷的贮存稳定性[2];
葡萄籽花色苷与磺基丁基醚-β-环糊精形成的包合物不仅提高了花色苷的溶解度和稳定性,而且保留了花色苷的抗糖尿病作用[3]。
蛋白质来源广泛,价格低廉,不仅生物相容性好,而且营养价值高,是活性小分子主要载体;
其中乳蛋白因其制备工艺简单、成本低廉而成为蛋白质中的首选基质。乳蛋白主要由乳清蛋白和酪蛋白组成,有文献指出,乳清蛋白-PCs复合物的热稳定性大于游离PCs的热稳定性[4]。乳清蛋白和酪蛋白在热、氧化和光照条件下能使PCs的降解量减少,对其稳定性有较好的改善作用[5];
α-酪蛋白和β-酪蛋白均能提高蓝莓花青素稳定性,并保护其抗氧化能力[6]。由此可见,利用乳蛋白负载可提升PCs的稳定性。
乳中,酪蛋白占总蛋白的80%,由4种不同类型的酪蛋白(αs1,αs2,β和κ,质量比例约为4∶1∶4∶1)组成,这些酪蛋白与磷酸钙自组装成一种纳米级复合物,称为酪蛋白胶束(micellar casein,MC),其结构特殊,具有疏水内部和亲水表面[7]。本团队前期研究发现,MC对活性小分子具有较高的结合能力,如在37 ℃条件下,MC与大黄素、咖啡酸和咖啡酸苯乙酯的结合常数分别为5.470×104、8.12×104和8.93×106[8-9],有利于提高疏水分子的溶解性和生物利用度。然而,MC对PCs稳定性影响研究报道较少。
本文以MC为基质,以PCs为配体,制备PCs-MC复合物,利用紫外-可见光谱、荧光光谱、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、X-射线衍射(diffraction of x-rays,XRD)、粒径和Zeta电位等表征复合物结构,并分析热处理、超声处理、添加H2O2和金属离子对PCs-MC复合物中PCs稳定性的影响规律及作用机制,为PCs稳定性提升提供参考依据。
1.1 材料与试剂
PCs,上海麦克林生化科技有限公司;
FeCl3、ZnCl2,烟台市双双化工有限公司;
香草醛,兰州嘉特星工贸有限公司;
其他试剂均为分析纯。
新鲜牛乳购自兰州天天鲜乳制品有限责任公司,离心脱脂(4 000×g,30 min),过100 kDa有机膜,浓缩液冷冻干燥制得胶束酪蛋白,4 ℃冷藏备用[9]。
1.2 仪器与设备
RF-5301PC荧光分光光度计,日本日立仪器有限责任公司;
Nicolet iS50 FTIR光谱仪,美国赛默飞世尔科学公司;
HX-T涡旋混合器,中国金坛百塔鑫宝仪器有限公司;
XD3 X射线多晶衍射仪,北京普析通用仪器有限责任公司;
STA 449 F5 TG-DSC热分析仪,德国耐驰仪器制造有限公司;
FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;
H1850台式高速离心机,湖南湘仪实验室仪器开发有限公司;
UV-1780双光束紫外可见分光光度计,岛津仪器有限公司;
BT-Zeta100 Zeta电位/纳米粒度/分子量分析仪,丹东百特仪器有限公司。
1.3 实验方法
1.3.1 PCs-MC复合物制备
用0.05 mol/L pH 6.86磷酸盐缓冲液溶解MC,获得3 g/L MC溶液。将适量PCs用二甲基亚砜助溶后置于0.05 mol/L pH 6.86磷酸盐缓冲液中,涡旋振荡使其充分溶解,制得浓度分别为2、4、6、8 mmol/L的溶液。上述PCs溶液与MC以体积比1∶1混合,37 ℃水浴中磁力搅拌加热20 min,制得PCs-MC复合物,备用。取一部分复合物溶液进行冷冻干燥,获得粉末状复合物,冷藏备用。
1.3.2 紫外-可见光谱分析
PCs-MC复合物溶液用0.05 mol/L pH 6.86磷酸盐缓冲液稀释30倍,用紫外-可见分光光度计进行全波长扫描,扫描范围为190~500 nm。
1.3.3 荧光光谱分析
PCs-MC复合物溶液用0.05 mol/L pH 6.86磷酸盐缓冲液稀释10倍,用荧光分光光度计测量,测量范围为290~500 nm,激发波长为280 nm,激发狭缝为10 nm,发射狭缝为5 nm。
1.3.4 FTIR分析
参照文献[10],将PCs-MC复合物粉末置于ATR元件,用FTIR仪测量,对酰胺Ⅰ带(1 600~1 700 cm-1)进行二级结构含量分析。
1.3.5 XRD 分析
参照QIN等[8]的方法,将PCs-MC复合物粉末用X射线多晶衍射仪在Cu Kα辐射下进行XRD扫描。
1.3.6 粒径和Zeta电位分析
参照LI等[11]的方法,将PCs-MC复合物溶液用0.05 mol/L pH 6.86磷酸盐缓冲液稀释10倍,使用BT-Zeta100 粒度仪测定粒径及电位。
1.3.7 差示扫描量热法(thermogravimetric analysis-differential scanning calorimetry,TG-DSC)分析
参照QIN等[8]的方法,使用TG-DSC热分析仪测定PCs-MC复合物粉末的热稳定性。
1.3.8 PCs稳定性分析
1.3.8.1 PCs含量的测定
PCs含量测定参考WEN等[12]报道的方法,取0.5 mL样品,加入4.5 mL体积分数2%盐酸-10 g/L香草醛乙酸溶液中,在37 ℃恒温水浴锅中加热30 min后冷却至室温,使用紫外-可见分光光度计在500 nm处测量吸光度,绘制标准曲线(图1)。

a-PCs;b-PCs-MC图1 游离PCs和PCs-MC复合物中PCs的标准曲线Fig.1 Standard curves of free PCs and PCs in PCs-MC complexes
PCs的稳定性用保留率表示,计算如公式(1)所示[12]:

(1)
式中:c0,PCs的初始浓度,mmol/L;
ct,t时刻PCs的浓度,mmol/L。
1.3.8.2 温度对PCs稳定性的影响
将PCs-MC复合物溶液及相同浓度游离PCs溶液分别置于4 ℃冰箱、37、50和65 ℃水浴中恒温60 h,每隔12 h取样测定PCs保留率。
1.3.8.3 金属离子对PCs稳定性的影响
将PCs-MC复合物溶液及相同浓度游离PCs溶液分别与0.01 mol/L FeCl3和0.01 mol/L ZnCl2溶液以体积比1∶1混合均匀,室温静置150 min,每隔30 min取样测定PCs保留率。
1.3.8.4 H2O2对PCs稳定性的影响
在PCs-MC复合物溶液及相同浓度游离PCs溶液中分别加入一定量H2O2溶液,使其终体积分数为0.006%和0.024%,室温静置75 min,每隔15 min取样测定PCs保留率。
1.3.8.5 超声处理PCs稳定性的影响
将PCs-MC复合物溶液及相同浓度游离PCs溶液进行超声处理50 min,频率为20 kHz,振幅为30%,采用间歇超声模式(工作5 s停1 s),每隔10 min取样测定PCs保留率。
1.3.9 PCs降解动力学分析
根据文献[13],采用一级动力学模型分析PCs降解动力学,如公式(2)所示:
lnct=-kt+lnc0
(2)
式中:c0,PCs的初始浓度,mmol/L;
ct,t时刻PCs的浓度,mmol/L;
k,降解速率常数,h-1或min-1;
t,时间,h或min。
1.4 数据统计分析
所有试验重复3次,试验数据采用Excel 2010处理并用平均数±标准偏差表示,用Origin Pro 9.0作图,用IBM SPSS Statistics 22进行差异显著性分析,数据间差异显著分析采用Duncan法。
2.1 PCs-MC复合物结构表征
2.1.1 紫外-可见光谱分析
由图2-a可知,随着游离PCs浓度的增加, 280 nm处的吸光度逐渐增大。由图2-b可知,随着PCs浓度的增加,PCs-MC复合物在280 nm附近的吸收峰不断增大,且最大吸收波长从277 nm红移到280 nm,表明MC二级结构发生改变,疏水氨基酸残基向亲水微环境转变,证明PCs和MC发生相互作用,形成了复合物。另一方面,MC疏水性氨基酸残基微环境发生变化,说明PCs与MC可能以疏水作用结合。WANG等[14]研究发现,随着花青素浓度的增加,黑豆分离蛋白的吸光度逐渐增加,且最大吸收波长从272 nm红移到279 nm,与本研究结果基本一致。

a-游离PCs;
b-PCs-MC复合物图2 游离PCs和PCs-MC复合物的紫外光谱图Fig.2 UV-Vis spectra of PCs and PCs-MC complexes
2.1.2 荧光光谱分析
PCs-MC复合物的荧光光谱如图3所示。MC在336.4 nm处有最大荧光值(1 682.6);
随着PCs浓度的增加,最大荧光强度逐渐降低。当PCs 浓度为4 mmol/L时,复合物的荧光强度降低到59.0,表明PCs使MC中色氨酸、酪氨酸残基微环境发生改变,对MC有荧光猝灭作用,再次证实PCs与MC发生相互作用,形成PCs-MC复合物。LI等[15]研究表明,PCs通过静态猝灭抑制乳铁蛋白的固有荧光,乳铁蛋白和PCs之间主要由疏水作用和氢键形成复合物。MA等[16]发现,PCs B1、B2、B3和A2可通过静态猝灭抑制β-酪蛋白的固有荧光,PCs C1可通过动态和静态猝灭抑制β-酪蛋白的固有荧光,PCs与β-酪蛋白的结合作用主要是疏水作用、范德华力和氢键。可见,PCs更易于与蛋白质形成疏水作用。

图3 PCs-MC复合物的荧光光谱图Fig.3 Fluorescence spectra of PCs-MC complexes
2.1.3 FTIR分析

对酰胺I带进行二级结构含量分析,结果如图4-b所示。添加PCs后,MC中β-折叠结构含量显著降低,转角含量显著增加(P<0.05)。当PCs添加量为1~3 mmol/L时,各二级结构含量随PCs浓度增加变化不显著(P>0.05)。当PCs浓度为4 mmol/L时,复合物中转角结构含量最高,β-折叠含量最低,且与其他样品差异显著(P<0.05)。由此可见,添加PCs后,MC二级结构发生改变,这与紫外-可见光谱研究结果一致(图2)。

a-FTIR图;
b-二级结构含量图4 PCs-MC复合物的FTIR图和二级结构含量Fig.4 FTIR spectra and secondary structure conctents of PCs-MC complexes注:不同小写字母表示差异显著
2.1.4 XRD分析
PCs-MC复合物的XRD如图5所示。游离MC和PCs出现较宽的峰,说明二者均呈现无定形结构。PCs-MC复合物在32°处出现一个新的晶体衍射峰,表明PCs与MC形成复合物。SHADDEL等[18]研究发现,加入花青素后,以明胶和阿拉伯胶为基质的微胶囊晶体结构发生改变,形成明显的晶体衍射峰,与本研究结果一致。

图5 PCs-MC复合物XRD图Fig.5 XRD patterns of PCs-MC complexes
2.1.5 粒径及电位分析
由图6-a可知,随着PCs浓度的增大,游离PCs和PCs-MC复合物粒径都逐渐增大,且PCs-MC复合物粒径小于游离PCs粒径。由于PCs为聚合物,在水中溶解度不高,多形成团聚体,因此粒径较大。将PCs添加到MC溶液中后,PCs与MC以物理相互作用结合,有效改善了PCs的团聚,使其分散为小分子,因此复合物粒径显著小于游离PCs(P<0.05)。由于MC为近球形粒子,PCs结合于其表面,因此随着PCs结合量的增加,复合物粒径略有增大。YAN等[19]研究发现,与樟仁分离蛋白相比,樟仁分离蛋白-酚复合物的粒径更大,表明蛋白质-酚复合物的形成,与本文研究结果一致。

a-粒径;
b-Zeta电位图6 PCs-MC复合物的粒径和Zeta电位Fig.6 Particle size and Zeta-potential of PCs-MC complexes注:图中不同小写字母表示PCs-MC样品间差异显著;
不同大写字母表示PCs样品间差异显著(下同)
由图6-b可知,在pH 6.86的缓冲体系中,PCs带负电荷,1 mmol/L时电位值为-8.8 mV。相同体系中,MC带负电荷,电位值为-18.0 mV。随着PCs浓度的增大,PCs-MC复合物的负电量有所增加,表明PCs改变了MC二级结构,形成PCs-MC复合物,且PCs-MC复合物粒子间静电斥力增强,与红外光谱分析结果一致(图4)。LI等[11]研究发现,当儿茶素浓度增加到1.5 g/L时,复合物的电位值增大了1倍多。
2.1.6 TG-DSC分析
由图7-a中可知,在80 ℃左右出现吸热峰,是由于水分蒸发所致。PCs-MC复合物在350 ℃附近出现较大放热峰,为复合物热分解所致,与文献[18]的研究结果一致。
由图7-b可知,PCs和MC第一次失重在80 ℃附近,为水分蒸发所致;
第二次失重在275~350 ℃,表明大分子热分解。PCs-MC复合物在该阶段的质量损失低于MC,且损失率随着PCs含量的增加而降低,说明复合物之间形成了相互作用,减缓了MC的热分解。可见,PCs-MC复合物的热稳定性高于游离MC和PCs。有研究指出,微胶囊化的花色苷质量损失更加缓慢,卡拉胶对花色苷的降解起到保护作用,与本文研究结果相似[20]。

a-DSC;
b-TG图7 PCs-MC复合物的DSC和TG曲线Fig.7 DSC and TG curves of PCs-MC complexes
2.2 温度对PCs-MC复合物稳定性的影响
2.2.1 不同温度下PCs保留率分析
不同温度处理下的PCs保留率如图8所示。
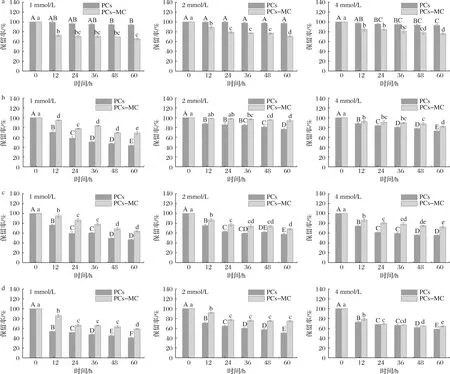
a-4 ℃;
b-37 ℃;
c-50 ℃;
d-65 ℃图8 不同温度处理下PCs保留率Fig.8 Retention rate of PCs with different heat treatment
由图8-a可知,4 ℃贮藏时,复合物中PCs保留率低于游离PCs,这可能是由于低温下酪蛋白胶束结构发生改变,部分β-酪蛋白析出,PCs可能进入酪蛋白胶束内部,从而难以检测到[21]。另一方面,复合物中PCs浓度越大,其保留率越大,这可能是因为PCs之间形成π-π堆积等作用,进而结构稳定性提升[22]。由图8-b~图8-d可知,37、50和65 ℃处理时,MC对PCs均起到保护作用,复合物中PCs降解率明显低于游离PCs,与QUAN等[2]的研究结果一致。由于PCs分子以特定基团与MC形成物理相互作用,使其结构稳定性提升,在外界环境影响下降解减缓,从而提高了PCs的保留率。就游离PCs而言,浓度为1 mmol/L时PCs保留率最低,可见PCs分子之间的相互作用也有利于其结构稳定,但这种作用弱于MC与PCs之间的相互作用。与其他温度相比,随着贮藏时间的延长,4 ℃下游离PCs和复合物中PCs保留率最高且变化缓慢,可见低温贮藏有利于保持PCs的稳定性。
有文献指出,β-环糊精与花青素之间的相互作用会促进花青素的降解[23],与本文研究结果不同,可能是由于原料间的相互作用机理不同所导致。综上所述,MC与PCs结合有利于改善PCs在中高温环境下的稳定性。
不同温度下PCs一级降解动力学拟合结果如表1所示。不同温度处理下,游离PCs和复合物中的PCs降解均符合一级降解动力学,拟合度较高,与WANG等[17]报道一致。

表1 不同影响因素下PCs的一级降解速率常数(k)和相关系数(R2)Table 1 Degradation rate constants (k) and correlation coefficients (R2) of PCs under different treatment
2.2.2 PCs-MC复合物粒径和电位分析
为了进一步解释MC对PCs稳定性的保护作用,选取50 ℃下不同贮藏期的PCs-MC复合物为样品,进行粒径和电位分析,结果如图9所示。由图9-a可知,随着热处理时间的延长,游离PCs粒径减小;
且浓度越小,粒径降低幅度越大,说明PCs对温度敏感,在热处理下发生降解。就PCs-MC复合物而言,其粒径随热处理时间延长虽呈现出增大趋势,但增大幅度较小。电位方面,PCs-MC复合物电荷为-20 mV左右,是较为稳定的体系。随着热处理时间的延长,游离PCs降解后,负电荷增加,而复合物的电荷变化规律性不强,整体变化程度较小。由此可见,MC与PCs的相互作用有效缓解了PCs的热降解。

a-PCs-MC复合物粒径;
b-PCs-MC复合物Zeta电位图9 50 ℃处理下PCs-MC复合物的粒径和Zeta电位Fig.9 Particle size and Zeta-potential of PCs-MC complexes at 50 ℃
2.3 Fe3+和Zn2+对PCs-MC复合物稳定性的影响
2.3.1 PCs保留率分析
Fe3+和Zn2+处理下PCs保留率如图10所示。由图10-a可知,加入Fe3+后,游离PCs保留率高于复合物中PCs保留率,且PCs浓度越小,复合物中PCs保留率越低,如1 mmol/L时游离PCs和复合物中PCs保留率最低,加入Fe3+150 min后,游离PCs保留率为48.8%,而复合物中PCs保留率为37.1%。由图10-b可知,加入Zn2+150 min后,浓度为1 mmol/L的游离PCs和复合物中PCs保留率分别为76.2%、68.8%,其变化趋势与Fe3+的影响一致,均表现为MC促进了PCs的降解,与RATANAPOOMPINYO等[24]的研究报道一致。文献报道指出,金属离子可以与PCs形成螯合物,从而增加其结构稳定性[24]。与MC非共价结合后,降低了PCs与金属离子的螯合能力,因此降低了其稳定性。PATRAS等[25]研究发现,Fe3+提高了矢车菊素-3-O-葡萄糖苷在60 ℃加热80 min的稳定性。另外,由表1可以看出PCs在Fe3+和Zn2+存在时的降解动力学符合一级反应。根据文献报道,矢车菊素-3-O-葡萄糖苷在Fe3+存在下的一级降解速率常数为0.001 53(min-1),与本文研究结果相似[24]。

a-Fe3+对PCs保留率的影响;
b-Zn2+对PCs保留率的影响图10 Fe3+和Zn2+对PCs保留率的影响Fig.10 Effect of Fe3+ and Zn2+ on the retention rate of PCs
2.3.2 Fe3+对PCs-MC复合物粒径和电位的影响
由图11-a可知,加入Fe3+后,游离PCs粒径迅速降低,可能是由于Fe3+与PCs螯合后结构发生改变,分子结构更紧凑所致。然而,PCs-MC复合物在Fe3+作用下粒径迅速增大,且随着时间的延长粒径越大,这可能是由于Fe3+与MC上特定的氨基酸残基或结合于MC上的PCs产生了螯合作用,将MC交联起来,形成更大的团簇结构。
由图11-b可知,加入Fe3+后,游离PCs体系电荷由负电变成正电,说明其与PCs产生了螯合作用;
而PCs-MC复合物体系依然为负电体系,且带电量随着时间的延长逐渐降低,说明MC间可能发生了交联。由此可见,MC降低PCs的金属离子稳定性,其本质在于阻碍了PCs与金属离子的螯合作用,而该作用有利于稳定PCs的醌式碱结构不受亲核试剂攻击[25]。虽然MC与PCs的疏水作用也有利于提高其结构稳定性,但该作用效果弱于螯合作用。

a-Fe3+处理下PCs-MC复合物粒径;
b-Fe3+处理下PCs-MC复合物Zeta电位图11 Fe3+处理下PCs-MC复合物的粒径和Zeta电位Fig.11 Particle size and Zeta-potential of PCs-MC complexes with Fe3+
2.4 H2O2对PCs-MC复合物稳定性的影响
2.4.1 不同H2O2浓度下PCs保留率分析
如图12所示,加入H2O2后,2种样品中PCs保留率都随时间的延长而降低,说明H2O2使PCs逐渐降解。

a-0.006% H2O2处理;
b-0.024% H2O2处理图12 不同浓度H2O2处理对PCs保留率的影响Fig.12 Retention rate of PCs with different concentrations of H2O2
另外,随着H2O2浓度的增大,PCs保留率减小。与游离PCs相比,相同条件下复合物中PCs保留率均较高。MC与PCs的非共价结合,保护了PCs结构稳定,使其难以被氧化;
而且,MC与 PCs结合后,其结构发生改变,可能将PCs包埋在肽链内部,使其不易与氧化剂接触,从而提高了稳定性。由此可见,MC对PCs在H2O2下的氧化降解有明显的抑制作用,与HE等[5]的研究报道一致。
同一浓度H2O2处理下,不同浓度样品中PCs保留率不同。其中,浓度为1 mmol/L时,H2O2处理后复合物中PCs保留率最高,浓度为2 mmol/L时PCs保留率最低,这可能是由于不同PCs浓度下,添加H2O2引起MC结构变化程度不同所致。当PCs浓度较低时,MC结构变化有利于将其包裹在分子内或分子间,从而提高其稳定性。H2O2存在下,PCs的降解符合一级降解动力学(表1)。有研究发现[26],在H2O2处理条件下,蓝莓花色苷降解符合一级动力学方程,0.0%~2.0% H2O2条件下花色苷降解速率k为0.000 4~0.057 4 min-1,与本文研究相似。
2.4.2 H2O2对PCs-MC复合物粒径和电位的影响
由图13-a可知,加入H2O2后,虽然游离PCs粒径随时间延长呈减小趋势,但粒径较大,说明PCs 在氧化剂作用下团聚现象严重,可能是PCs氧化聚集。PCs-MC复合物粒径随时间变化不大,说明体系基本没有发生团聚现象,证实体系较为稳定。由图13-b可知,加入H2O2后,游离PCs和PCs-MC复合物的电位变化不大。

a-0.024% H2O2处理下PCs-MC复合物粒径;
b-0.024% H2O2处理下PCs-MC复合物Zeta电位图图13 0.024% H2O2处理下PCs-MC复合物粒径和Zeta电位Fig.13 Particle size and Zeta-potential of PCs-MC complexes with 0.024% H2O2
2.5 超声处理对PCs-MC复合物稳定性的影响
2.5.1 PCs保留率分析
由图14可知,超声处理下,MC促进了PCs的降解,这可能是由于超声处理不仅削弱了PCs与MC的相互作用,而且破坏了PCs分子间作用,使其稳定性降低。由表1可以看出,超声处理下PCs的降解符合一级降解动力学。

图14 超声处理对PCs保留率的影响Fig.14 Retention rate of PCs-MC complexes during ultrasound treatment
2.5.2 超声处理对PCs-MC复合物粒径和电位的影响
从图15-a可以看出,游离PCs在超声10 min时粒径明显减小(P<0.05),但随着超声时间的延长粒径逐渐增大,可能是短时间超声促进了PCs的溶解,而长时间超声使其聚集。就PCs-MC复合物而言,超声处理对其粒径影响不大。由图15-b可知,超声处理对游离PCs和PCs-MC复合物的电位影响不大。可见,超声处理主要通过改变PCs分子间及PCs与MC之间的相互作用,从而影响PCs的稳定性。

a-超声处理下PCs-MC复合物粒径;
b-超声处理下PCs-MC复合物Zeta电位图15 超声处理时不同浓度PCs-MC复合物的粒径和Zeta电位Fig.15 Particle size and Zeta-potential of PCs-MC complexes during ultrasound treatment
以MC为载体,制备PCs-MC复合物,发现 PCs对MC有显著的荧光猝灭作用,且改变了MC的二级结构。XRD和FTIR光谱证实,PCs与MC形成复合物。MC对PCs的热稳定性影响与温度有关,其中MC降低了PCs在4 ℃时的稳定性,而提高了其在37、50、65 ℃时的保留率。另外,MC改善了PCs在H2O2作用下的稳定性。但是,在Fe3+、Zn2+作用下和超声处理时,PCs-MC复合物中PCs保留率低于游离PCs,可见MC促进了PCs的降解。综上所述,MC对PCs的稳定性影响与处理条件有关。
猜你喜欢酪蛋白复合物游离游离股前外侧穿支皮瓣修复足踝部软组织缺损实用手外科杂志(2022年2期)2022-08-31乳制品中A1β-酪蛋白、A2β-酪蛋白含量的测定中国乳业(2022年4期)2022-05-06蛋氨酸对奶牛乳腺酪蛋白合成及其上皮细胞自噬的影响中国饲料(2022年5期)2022-04-26莫须有、蜿蜒、夜游离科学导报·学术(2020年29期)2020-10-21柚皮素磷脂复合物的制备和表征中成药(2018年7期)2018-08-04黄芩苷-小檗碱复合物的形成规律中成药(2018年3期)2018-05-07白杨素磷脂复合物的制备及其药动学行为中成药(2017年5期)2017-06-13酪蛋白磷酸肽-钙络合物对酸乳贮藏特性的影响中国酿造(2016年12期)2016-03-01游离血红蛋白室内质控物的制备及应用现代检验医学杂志(2015年4期)2015-02-06Evaluation of the Development of Circular Agriculture in Sichuan Province Based on the Coefficient of VariationAsian Agricultural Research(2015年3期)2015-02-02推荐访问:胶束 花青素 稳定性推荐文章
- 【想移民荷兰的朋友看过来,告诉你定居荷兰是一种怎样的生活体验】荷兰移民需要什么条件
- [关于训练口才的经典句子]训练口才的经典句子
- 【加拿大留学金融系专业排名】 加拿大留学专业排名
- 2018年四川省人民医院神经外科临床医师编外人员招聘公告 2018年神经外科年会
- 2018安徽高考志愿填报及征集志愿时间安排:2018高考志愿填报征集志愿时间
- 行政前台工作计划表_行政前台工作计划怎么写
- 和女朋友表白感人的话_和女朋友表白的句子
- 【英语语法:the,fact,that的语法功能】 in fact等于什么
- [2018入党培训心得体会范文2000字【三篇】]入党积极分子思想汇报
- 2018年中级审计师考试试题每日一练(6.14)|审计师报名时间2018