ALT,升高、低病毒载量慢性乙型肝炎患者不确定期采用不同抗病毒治疗方案的疗效及安全性
来源:优秀文章 发布时间:2023-03-24 点击:
武 媞 ,黄 康 ,赵智蓉 ,李海雯 ,李晓非 ,杨永锐
(1)大理大学公共卫生学院,云南 大理 671000;2)昆明市第三人民医院肝病科,云南 昆明 650041)
根据我国最新发布的慢性乙型肝炎防治指南(2019 版)[1],将HBV 感染分为4 期:免疫耐受期、免疫清除期、免疫控制期和再活动期。然而,在临床实践中慢性 HBV 感染者的病情复杂,约有30%~40%的患者不符合上述 4 期,处于不确定期[2]。不确定期患者,如不及时进行抗病毒治疗,可能会因发生肝细胞癌(hepatocellular carcinoma,HCC)或疾病进展而导致死亡[3]。
根据最新《扩大慢性乙型肝炎抗病毒治疗对专家意见》[4]建议把未经抗病毒治疗患者启动抗病毒治疗的 ALT 阈值确定为男性 30 U/L、女性19 U/L,以减少相关的肝脏炎症、纤维化、肝硬化、HCC 及肝病相关死亡。本研究以此标准进行了一项真实世界的回顾性研究,观察一线核苷酸类[nucleos(t)ide analogues,NAs]抗病毒药物恩替卡韦(entecavir,ETV)、富马酸替诺福韦酯(tenofovir disoproxil,TDF)及富马酸丙酚替诺福韦(tenofovir alafenamide,TAF)对ALT 升高、低病毒载量的不确定期慢乙肝患者的疗效及安全性差异。
1.1 研究对象
研究对象选自2019 年1 月至2022 年4 月在昆明市第三人民医院门诊就诊的诊断为慢乙肝不确定期患者96 例。本研究方案经由昆明市第三人民医院伦理委员会批准。
1.2 入组标准
(1)未抗病毒治疗的不确定期慢乙肝患者,诊断符合我国 2019 年版的慢性乙型肝炎防治指南抗病毒适应症[1];
(2)HBsAg 阳性,实时定量PCR 方法检测出HBV DNA 介于100~2 000 IU/mL的患者;
(3)ALT 持续高于治疗阈值(男性 30 U/L、女性 19 U/L),且排除其他原因所致的患者;
(4)治疗依从性良好,定期门诊复诊。
1.3 排除标准
(1)合并甲、丙、丁、戊型肝炎病毒感染、其他肝脏疾病及其他可能引起慢性肝功异常的疾病;
(2)排除曾使用干扰素,核苷(酸)类似物进行过抗病毒治疗的患者;
(3)排除肝硬化失代偿期患者(4)排除同时合并HIV 患者;
(5)排除有各系统肿瘤史的患者;
(6)排除怀孕及哺乳期及备孕患者。
1.4 研究方法
入组96 例ALT 升高低病毒载量不确定期慢乙肝患者,根据使用药物不同将患者分为3 组,分别为ETV 组、TDF 组和TAF 组,3 组患者均持续用药48 周。分别在基线、12 周、24 周、48 周检测(病毒学、生化学检查)对患者进行评估,观察主要指标为:CVR 率、HBV 生物标志物、肾小球滤过率(eGFR)、甲胎蛋白(AFP)等,次要指标:肝功能(TBIL、ALT 复常率、GGT)等。ETV 组患者采用(生产企业:湖南千金协力药业有限公司,国药准字H20140093)进行治疗,用药方法:空腹口服,0.5 mg 每日治疗1 次。TDF 组患者采用(生产企业:安徽贝克生物制药有限公司,国药准字H20173303)进行治疗,用药方法:空腹口服,300 mg 每日治疗1 次。TAF 组患者采用 TAF(生产企业:美国Patheon Inc,进口药品注册证号:H20180060)进行治疗,用药方法:随食物服用,25 mg 每日治疗1 次。乙肝病毒学检测采用ROCHE 公司全自动AmpliPerp/cobas TaqMAn48系统检测仪,试剂使用ROCHE 公司的配套试剂,线性检测范围为1×100~1.5×108IU/mL。HBV血清学标志物采用化学发光免疫分析法(美国罗氏)进行测定。临床生化检测使用日本奥林巴斯AU400 全自动生化仪,试剂选用日本和光谷丙转氨酶测定试剂盒和谷草转氨酶测定试剂盒。
1.5 统计学处理
利用SPSS27.0 统计软件进行数据处理和分析。计量资料服从正态分布采用均数±标准差描述,组间比较采用重复测量方差分析;
未服从正态分布采用M(P25,P75)表示,组间比较采用秩和检验Kruskal-Wallis H 检验;
计数资料以[n(%)]描述,组间比较采用卡方检验。水准α=0.05,P< 0.05 为差异有统计学意义。
2.1 3 组患者的一般资料
根据纳入和排除标准共选取ALT 升高、低病毒载量不确定期慢乙肝患者96 例,其中ETV 组33 例,TDF 组33 例,TAF 组30 例。3 组患者的性别、HBV DNA 载量、HBV 生物标志物、生化学指标(TBIL、ALB、GGT、CR、UA、AFP)等基线资料差异无统计学意义(P> 0.05),见表1。
表1 入组患者的基线临床特征[/n(%)/ M(P25,P75)]Tab.1 Baseline clinical characteristics of enrolled patients [/n(%)/ M(P25,P75)]

表1 入组患者的基线临床特征[/n(%)/ M(P25,P75)]Tab.1 Baseline clinical characteristics of enrolled patients [/n(%)/ M(P25,P75)]
2.2 3 组患者治疗后的病毒学应答
经抗病毒治疗48 周后,总CVR 率为96.88%(93/96),3 组的CVR 率为:ETV 组96.97%(32/33),TDF 组96.97%(32/33),TAF 组96.67%(29/30)(P=0.997)。根据HBeAg 是否阳性分层后,HBeAg 阳性组,48 周CVR 率为94.74%(36/38),HBeAg 阴性组,48 周CVR 率为98.28%(57/58),组间差异无统计学意义(P> 0.05),见表2。

表2 不同治疗方案治疗慢乙肝不确定期患者的病毒学载量情况[n(%)]Tab.2 Virological load of patients with chronic hepatitis B in uncertain stage treated with different treatment regimens[n(%)]
2.3 3 组患者治疗前后HBV 生物标志物的对比
在48 周的治疗期间,所有患者的血清HBsAg 均未完全消失。治疗48 周时HBsAg 水平较基线平均下降情况:ETV 组中位数治疗后较治疗前下降2.03l gIU/mL(P=0.003),TDF 组中位数治疗后较治疗前下降2.73 gIU/mL(P=0.001),TAF 组中位数治疗后较治疗前下降2.69l gIU/m(P=0.001),在48 周治疗中3 组HBsAg 滴度水平下降差异无统计学意义(P> 0.05),见表3。
表3 不同治疗方案治疗慢乙肝不确定期患者的血清HBsAg 滴度水平改变[M(P25,P75)]Tab.3 Changes of serum HBsAg titers in patients with chronic hepatitis B in uncertain stage treated with different treatment regimens [M(P25,P75)]
2.4 3 组患者治疗前后生化学应答对比
2.4.1 3 组患者治疗前后肝功能改变ETV 组在治疗第48 周后TBIL 较基线出现明显改善,中位数较基线下降了6.90 µmol/L(P=0.023),ALT 水平中位数较基线下降8.00U/L(P=0.141)复常率为60.61%(20/33)。TDF 组在第48 周GGT 中位数较基线下降5.00U/L(P=0.020),ALT 水平中位数较基线下降9.00 U/L(P=0.009),复常率为45.45%(15/33)。TAF 组ALT、TBIL、GGT、AFP 等生化学指标治疗48 周后较治疗前均有明显改善,ALT中位数下降:4.00U/L,P=0.001,复常率为70.00%(21/30),见表4;
TBIL:平均下降1.10 µmol/L,P=0.001;
GGT:平均下降5.00 U/L,P=0.037,见表5。3 组各项肝功指标差异无统计学意义(P>0.05)。

表4 不同治疗方案治疗慢乙肝不确定期患者的ALT 生化学应答比较[M(P25,P75)]Tab.4 Comparison of ALT biochemical responses in patients with chronic hepatitis B in uncertain stage treated with different treatment regimens [M(P25,P75)]

表5 不同治疗方案治疗慢乙肝不确定期患者的TBIL 生化学应答比较[M(P25,P75)]Tab.5 Comparison of TBIL biochemical responses in patients with chronic hepatitis B in uncertain stage treated with different treatment regimens [M(P25,P75)]
2.4.2 3 组患者治疗前后肾功能改变3 组患者抗病毒治疗48 周后,ETV 组eGFR 中位数较基线下降了3.40 mL/min/1.73m2,虽然出现波动但变化无统计学意义,TDF 组eGFR 中位数较基线下降了6.08 mL/min/1.73 m2(P=0.040),TAF 组在第48周时eGFR 中位数较基线升高14.70 mL/min/1.73 m2(P=0.032),见表6,eGFR 治疗48 周时3组表现出统计学差异(P=0.037),进一步两两比较后TAF 组118.9(110.4,122.8)相较于ETV 组105.5(98.6,120.3)(P=0.013)以及TDF 组110.8(103.2,125.5)(P=0.047)均有显著升高,见图1、表7、表8。

表6 不同治疗方案治疗慢乙肝不确定期患者的GGT 生化学比较[M(P25,P75)]Tab.6 Comparison of GGT biochemical responses in patients with chronic hepatitis B in uncertain stage treated with different treatment regimens [M(P25,P75)]
表7 不同治疗方案治疗慢乙肝不确定期患者的eGFR 生化学比较[M(P25,P75)]Tab.7 Comparison of eGFR biochemical responses in patients with chronic hepatitis B in uncertain stage treated with different treatment regimens [M(P25,P75)]

表8 不同治疗方案治疗慢乙肝不确定期患者第48 周的eGFR 生化学比较[M(P25,P75)]Tab.8 Comparison of eGFR biochemistry responses in patients with chronic hepatitis B at the 48th week in uncertain stage treated with different treatment regimens [M(P25,P75)]

图1 3 组药物对eGFR 的改变Fig.1 Changes of eGFR in three groups of drugs
2.5 3 组患者治疗前后AFP 水平对比
经抗病毒治疗48 周后,TAF 组AFP 中位数水平较基线下降1.17 ng/mL(P=0.011),在治疗第48 周时AFP 水平TAF 组2.32(1.51,3.09)相较于ETV 组3.10(2.55,3.71)和TDF 组3.47(2.23,4.71)差异有统计学意义(P=0.009),两两比较后TAF 组较ETV 组(P=0.008)和TDF 组(P=0.007)显著下降见图2、表9、表10。

表9 不同治疗方案治疗慢乙肝不确定期患者的AFP 水平比较[M(P25,P75)]Tab.9 Comparison of AFP biochemical responses in patients with chronic hepatitis B in uncertain stage treated with different treatment regimens [M(P25,P75)]

表10 不同治疗方案治疗慢乙肝不确定期患者第48 周的AFP 生化学比较[M(P25,P75)]Tab.10 Comparison of AFP biochemistry responses in patients with chronic hepatitis B at the 48th week in uncertain stage treated with different treatment regimens [M(P25,P75)]
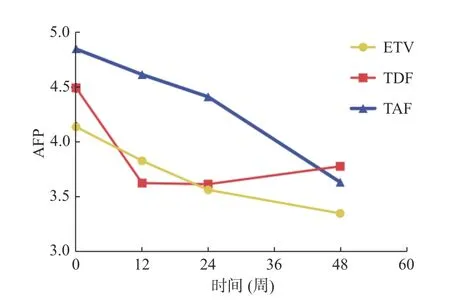
图2 3 组药物对AFP 的改变Fig.2 Changes of AFP in three groups of drugs
目前国内外对于慢性乙型肝炎抗病毒治疗的适应症已逐步放宽,但仍有相当数量的乙型肝炎患者因不符合现有标准而未能接受抗病毒治疗,因而可能导致疾病进展[5]。台湾的一项研究指出[6],处于慢乙肝不确定期患者10 a 肝细胞癌累积发生率为2.7%。在一项美国的研究中[7],共纳入886 例不确定期慢乙肝患者在中位随访6.3 a 中有9%的患者发生肝硬化。目前抑制性抗病毒治疗已被证明可降低肝脏相关并发症的风险,并可阻止甚至逆转疾病进展[8]。
本研究针对ALT 升高、低病毒载量不确定期慢乙肝患者在真实世界中进行抗病毒治疗,观察3 组使用不同抗病毒药物的患者在基线、12 周、24 周、48 周病毒学、生化学变化。3 组患者抗病毒治疗48 周后总CVR 率达到96.88%(93/96),ETV 组96.97%(32/33),TDF 组96.97%(32/33),TAF 组96.67%(29/30),组间无统计学差异(P=0.997)。抗病毒治疗48 周后3 组HBsAg 水平较基线均有显著下降(P< 0.05),但组间无统计学差异(P=0.348)。治疗48 周后ALT 复常率TAF 组70.00%(21/30)优 于TDF 组45.45%(15/33)(P=0.049),TAF 组与ETV 组ALT 复常率差异无统计学意义。
安全性方面,已有大量的研究显示TDF 与TAF 之间的病毒抑制率相似,但TAF 在CHB 患者的肾脏安全性有更大的优势[9]。本研究中TAF组在治疗48 周时eGFR 较基线升高14.84 ml/min/1.73 m2(P=0.032),肾功能明显改善且优于ETV 组105.5(98.6,120.3)(P=0.013)以 及TDF组110.8(103.2,125.5)(P=0.047),该研究结果显示TAF 能改善患者肾功能。
关于不确定期与HCC 风险的相关性的探索一直是关注的热点。来自韩国的Choi 教授[10]团队对24 156 例成人CHB 患者人群队列的研究结果表明,与ETV 相比,TDF 与HCC 的风险显著降低相关。另一项[11]纳入11 项东亚观察性研究包含42 939 例CHB 患者的Meta 分析显示,接受TDF 治疗发生HCC 的风险显著低于接受ETV 治疗的风险(P=0.03)。目前关于TAF 与ETV 或TDF 远期发生肝细胞癌风险的研究较少。本研究显示,相比ETV 组及TDF 组,TAF 组治疗后48周AFP 下降更多,或许与肝脏炎症减轻、新生肝细胞减少相关,或许也预示着未来发生HCC 风险降低。
既往研究证明慢乙肝不确定期患者远期危害显著[12],本研究结果显示予以TAF 治疗患者AFP 水平下降更快,eGFR 水平改善更明显,TAF 组ALT 复常率也优于TDF 组,在 48 周治疗中3 组药物均可持续抑制病毒复制,改善生化指标,并具有良好的耐受性,对ALT 升高、低病毒载量慢乙肝不确定期患者进行抗病毒治疗能减轻肝细胞炎症坏死及肝脏纤维组织增生,延缓和减少肝功能衰竭、肝硬化失代偿、HCC 和其他并发症的发生。
本研究存在一定局限性,做为回顾性研究,该研究入组患者例数不多,研究结果可能存在一定的偏差。下一步加大样本例数,继续深入研究。
猜你喜欢 载量中位数乙肝 叶卫江:为什么用“乙肝携带状态”替代“乙肝携带者”?肝博士(2020年5期)2021-01-18病毒载量检测在102例HIV抗体不确定样本诊断中的应用昆明医科大学学报(2020年11期)2020-12-28陈建杰教授治疗低病毒载量慢性乙型肝炎经验总结中西医结合肝病杂志(2020年2期)2020-10-27乙肝妈妈:我该如何孕育一个健康宝宝?肝博士(2020年4期)2020-09-24中位数计算公式及数学性质的新认识统计与决策(2018年9期)2018-05-22不再为乙肝“愁断肠”中老年健康(2017年5期)2017-06-02HCMV感染婴儿尿液病毒载量与肝脏损伤指标的相关性分析现代检验医学杂志(2016年1期)2016-11-1276例妊娠合并乙肝的护理分析中国卫生标准管理(2015年18期)2016-01-20乙肝患者HBV载量与IgA,IgG,IgM及C3,C4相关性研究现代检验医学杂志(2015年4期)2015-02-06导学案不能沦落为“习题单”:以“中位数和众数”的导学案为例中学数学杂志(2014年6期)2014-03-01推荐访问:乙型肝炎 抗病毒 不确定