外侧隔核背侧部生长抑素阳性神经元参与异氟醚麻醉觉醒
来源:优秀文章 发布时间:2023-03-10 点击:
王宇浩,张思敏,李健楠,董海龙
(1陕西中医药大学第二附属医院中心实验室,陕西 咸阳 712046;
2空军军医大学西京医院麻醉与围术期医学科,陕西 西安 710032)
隔核位于大脑中线区域,是边缘系统的重要组成部分[1-2]。根据位置、神经元组成和环路连接的不同可将隔核分为内侧隔核和外侧隔核[3]。其中内侧隔核被认为主要由谷氨酸神经元组成,投射至海马组成隔核-海马通路,参与记忆的形成和储存[4-5]。而外侧隔核主要由γ-氨基丁酸能(gamma-aminobutyric acid-ergic,GABAergic)抑制性神经元组成,这些神经元接受海马的投射,并向外侧下丘脑、腹侧被盖区等脑区发出神经传出[6-7]。研究表明,外侧隔核参与多种神经功能的调控,例如,外侧隔核接受海马的神经传入从而参与学习记忆[8-9];
外侧隔核可通过对下丘脑-垂体-肾上腺素轴产生影响调控应激行为[10];
并且,其与腹侧被盖区存在神经连接,从而参与奖赏反馈等[11]。除此之外,近年来的研究认为外侧隔核参与多种神经精神疾病的发生发展[12]。全麻药物作用机制相关的研究表明,外侧隔核的GABAergic神经元具有觉醒活性,激活这类神经元能够促进小鼠从睡眠和异氟醚麻醉中觉醒,其中的机制是通过抑制腹侧被盖区GABAergic神经元,进一步去抑制腹侧被盖区内觉醒活性神经元,从而产生觉醒效应[13]。
根据解剖学和神经元组成的不同,外侧隔核可分为背侧部(dorsal part of the lateral septal nucleus,LSD)、中间部以及腹侧部。其中,LSD表达大量生长抑素(somatostatin,SOM)阳性神经元,中间部主要包含脑啡肽阳性神经元,而腹侧部主要由表达雌激素受体的神经元组成[14-15]。目前,尚缺少LSD内SOM神经元的传出投射及其在麻醉时的活性变化的相关研究。本研究拟利用顺向病毒示踪技术,观察LSD内SOM阳性神经元的神经传出,并利用钙信号记录与分析技术,观察LSD内SOM阳性神经元的活性在异氟醚麻醉-觉醒中的变化。
1.1 材料
1.1.1 实验动物 雄性SOM-Cre小鼠,6~8周龄,体质量20~25 g,购自美国Jackson公司,引进后在空军军医大学西京医院麻醉与围术期医学科实验室转基因动物饲养中心SPF条件下饲养和繁育。饲养环境温度(23±1)℃,湿度(40±2)%。昼夜节律为7∶00~19∶00亮灯。允许小鼠自由摄取水和食物以及自由活动。本实验经空军军医大学实验动物福利与伦理委员会审查批准[许可证号:SYXK(军)2017-0044]。
1.1.2 主要仪器和试剂 顺向示踪病毒AAV2/9-Ef1α-DIO-mCherry和钙信号病毒AAV2/9-Ef1α-DIO-GCaMP6s购自武汉Brain-VTA公司,PBS缓冲液购自中国鑫泰公司,光纤购自杭州Inper公司,钙信号记录分析系统(QAXK-FPS-DC-LED)购自南京千奥星科公司,立体定位仪(REP185-002)、小动物麻醉机(HSIV-130123061)及异氟醚挥发罐(SN4828)购自深圳瑞沃德公司,病毒注射器(MO-10)及小动物颅骨钻孔机(NE120)购自日本NSK公司,激光共聚焦显微镜(FV1000)及全玻片扫描系统购自日本Olympus公司,冰冻切片机(CM1900)购自日本LEICA公司。
1.2 方法
1.2.1 顺向示踪病毒的注射 雄性SOM-Cre小鼠6只,在14 mL/L异氟醚麻醉下,被固定于立体定位仪上。用络合碘消毒液消毒后剪开小鼠头皮暴露颅骨,充分清晰暴露前囟和人字点。调平颅骨平面后,根据小鼠脑立体定位图谱,将200 nL的AAV2/9-Ef1α-DIO-mCherry病毒以50 nL/min的速度注射到小鼠的右侧LSD(AP:1.0 mm,ML:0.4 mm,DV:-3.2 mm)。注射完毕后,留置注射针10 min,以局限病毒扩散范围。手术结束后,用牙科胶封闭颅骨避免感染。
1.2.2 全脑切片制备和全玻片扫描成像 顺向示踪病毒表达3周后,将小鼠用20 mL/L异氟醚深度麻醉,开胸经心脏先后灌注生理盐水20 mL和40 g/L多聚甲醛20 mL。灌注完毕后断头取脑,经后固定2 h后,置入300 g/L蔗糖溶液中充分脱水。后将小鼠脑组织冰冻切片,切取厚度为40 μm的全脑冠状切片,并按照顺序每切3张脑片留取其中1张。留存的脑片经每次15 min、共3次的PBS缓冲液冲洗后贴片,备荧光显色全玻片扫描成像。
进行荧光显色全玻片扫描成像时,调整激发光参数,激发红色荧光表达。充分对焦每张脑片后,进行全玻片扫描成像,供后续分析。
1.2.3 钙信号记录小鼠模型制作 雄性SOM-Cre小鼠8只,其中6只小鼠病毒表达和光纤位置良好。因此,将另外2只钙信号小鼠模型的数据剔除,对余下的钙信号数据进行分析。在14 mL/L异氟醚平稳麻醉下,将200 nL的AAV2/9-Ef1α-DIO-GCaMP6s病毒,以50 nL/min的速度注射到小鼠的LSD。注射完毕后,留置注射针10 min,以局限病毒扩散范围。然后将光纤植入注射部位的上方,用牙科胶将光纤和颅骨粘合封闭。术后小鼠恢复3周。
1.2.4 钙信号记录与分析 钙信号小鼠模型手术恢复3周后,将光纤使用跳线连接到钙信号采集系统上。钙信号采集系统采用488 nm和590 nm参比的双激光系统,度量GCaMP6s的荧光变化。实验开始前将光纤尖端的激光强度调节为30~40 μW,经过200 s的信号校准后,分别记录清醒基线10 min、14 mL/L异氟醚麻醉吸入30 min以及麻醉后恢复20 min,供后续分析。并且,记录异氟醚麻醉诱导小鼠失去翻正反射,即意识消失的时间,以及停止异氟醚吸入后小鼠恢复翻正反射,即意识恢复的时间[13]。计算钙信号记录过程中实时钙信号强度的变化:平均delta F/F=(F-F0)/F0×100,其中F是钙信号强度,F0是基线荧光强度[16]。
2.1 LSD内SOM阳性神经元投射到多个脑区
对6只动物的全玻片扫描分析发现,有3只动物的病毒注射和表达位置准确。神经元特异性顺向示踪病毒AAV2/9-Ef1α-DIO-mCherry被准确地注射至SOM-Cre小鼠的LSD。通过显微镜观察可知,红色荧光DIO-mCherry表达良好并局限在右侧LSD(图1A)。对神经元末梢的DIO-mCherry病毒表达进行分析发现,LSD内SOM阳性神经元主要向前扣带回(25区)(图1B)、外侧隔核腹侧部(图1C)、前下丘脑核(图1D)、外侧下丘脑(图1E)、腹侧被盖区(图1F)发出密集神经纤维投射,向中缝背核(图1G)、蓝斑(图1H)也有神经纤维投射。这些结果表明,LSD内SOM阳性神经元支配脑内多个脑区,因此其可能通过调控上述下游脑区参与调控应激、觉醒、奖赏反馈、情感等神经生理效应。

A:SOM-Cre小鼠LSD注射顺向示踪病毒;
B:前囟前1.53 mm神经元末梢DIO-mCherry病毒表达;
C:前囟前0.37 mm神经元末梢DIO-mCherry病毒表达;
D:前囟后0.35 mm神经元末梢DIO-mCherry病毒表达;
E:前囟后1.91 mm神经元末梢DIO-mCherry病毒表达;
F:前囟后3.16 mm神经元末梢DIO-mCherry病毒表达;
G:前囟后4.47 mm神经元末梢DIO-mCherry病毒表达;
H:前囟后5.63 mm神经元末梢DIO-mCherry病毒表达。LSD:背侧部;
ACC:前扣带回;
MS:内侧隔核;
LV:侧脑室;
LSI:外侧隔核内侧部;
LSV:外侧隔核腹侧部;
NAc:伏隔核;
Cpu:纹状体;
LPO:外侧视前区;
AH:前下丘脑核;
LH:外侧下丘脑;
VTA:腹侧被盖区;
DRN:中缝背核;
DRV:中缝背核腹侧部;
LC:蓝斑。图1 LSD内SOM阳性神经元向下游投射示踪
2.2 LSD内SOM阳性神经元参与异氟醚麻醉觉醒进程
异氟醚麻醉-觉醒进程钙信号记录结束后,对6只病毒表达和光纤位置良好(图2A~C)的小鼠模型进行钙信号数据分析。LSD内SOM阳性神经元的钙信号活动在清醒基线较高,能被异氟醚麻醉减弱,并且在麻醉后恢复(图2D、G)。对数据进行分析发现,清醒、异氟醚麻醉、麻醉后觉醒3个阶段的平均delta F/F值差异明显,其中清醒阶段显著高于异氟醚麻醉阶段(P<0.01,图2J)。进一步分析发现LSD内SOM阳性神经元的钙信号活动在意识消失时显著下降(图2E、H),意识消失后的平均delta F/F值显著低于意识消失前(P<0.05,图2K)。在意识恢复时,LSD内SOM阳性神经元的钙信号活动显著增加(图2F、I),意识恢复后的平均delta F/F值显著高于意识恢复前(P<0.05,图2L)。这些结果表明,LSD内SOM阳性神经元在全麻-觉醒中被麻醉抑制,并且在意识消失和恢复过程中发生了显著改变。
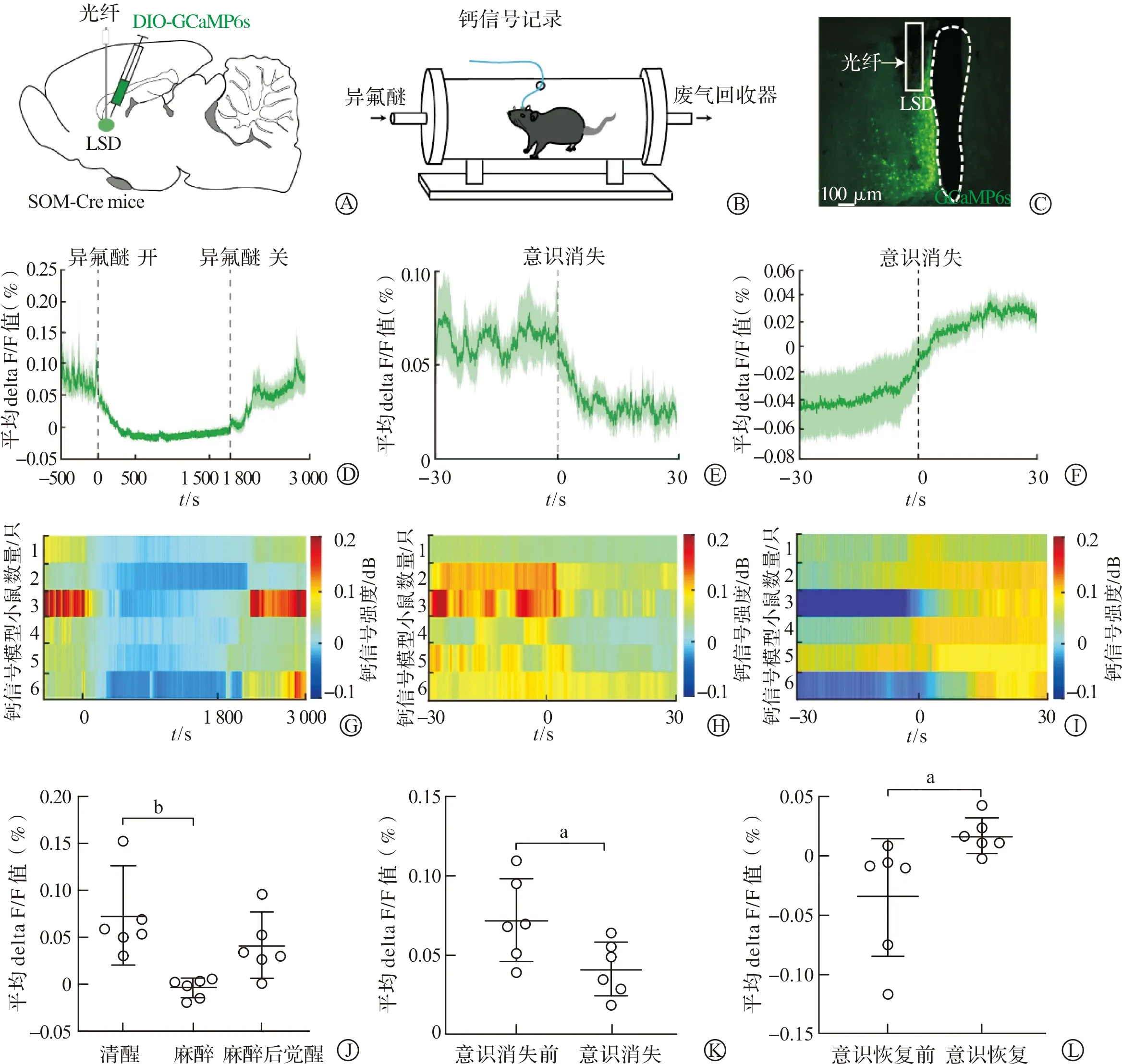
A:观察LSD内SOM阳性神经元钙信号小鼠模型制作示例图;
B:异氟醚麻醉-觉醒过程钙信号记录系统示例图;
C:LSD内SOM阳性神经元钙信号病毒表达情况;
D:异氟醚麻醉-觉醒过程中,LSD内SOM阳性神经元钙信号变化曲线图异氟醚诱导意识消失过程中,LSD内SOM阳性神经元钙信号变化曲线图异氟醚麻醉后意识恢复过程中,LSD内SOM阳性神经元钙信号变化曲线图异氟醚麻醉-觉醒过程中,LSD内SOM阳性神经元钙信号变化时间光栅图;
H:异氟醚诱导意识消失过程中,LSD内SOM阳性神经元钙信号变化时间光栅图;
I:异氟醚麻醉后意识恢复过程中,LSD内SOM阳性神经元钙信号变化时间光栅图;
J:异氟醚麻醉-觉醒过程中,LSD内SOM阳性神经元钙信号变化统计图;
K:异氟醚诱导意识消失过程中,LSD内SOM阳性神经元钙信号变化统计图;
L:异氟醚麻醉后意识恢复过程中,LSD内SOM阳性神经元钙信号变化统计图。LSD:背侧部;
SOM:生长抑素。
aP<0.05, bP<0.01。图2 异氟醚麻醉-觉醒过程中LSD内SOM阳性神经元钙信号活动变化
本研究通过神经元特异性顺向病毒示踪的方法,观察展示了LSD内SOM阳性神经元的神经传出,结果发现其主要向下丘脑、中脑等觉醒相关核团投射,提示其具有调控全麻-觉醒进程的可能。进一步通过神经元特异性钙信号记录与分析的方法,证实了LSD内SOM阳性神经元的活性在异氟醚麻醉期间被抑制,并且其神经元活性在意识消失过程中显著下降,在意识恢复过程中显著上升。这些结果展示了LSD内SOM阳性神经元的下游投射分布,并证实了其活性变化与异氟醚麻醉-觉醒过程相关。
既往研究证实,外侧隔核中90%以上的神经元为GABAergic抑制性神经元,而SOM阳性神经元主要存在于LSD[7]。LSD主要接受海马CA3的神经传入,并向下丘脑等区域投射[14-15]。但这些研究缺乏系统性或神经元特异性。本研究的顺向示踪结果证实LSD内SOM阳性神经元主要向下丘脑外侧区、腹侧被盖区等觉醒相关核团发出密集神经投射,提示其可能在全麻-觉醒和睡眠-觉醒中发挥调控作用。全麻药物相关的研究证实,外侧隔核内GABAergic阳性神经元能够通过抑制腹侧被盖区GABAergic抑制性神经元,进一步去抑制该核团内觉醒阳性神经元,从而促进小鼠从全麻和睡眠中觉醒[13]。该研究主要调控LSD和外侧隔核中间部的GABAergic阳性神经元,而本研究将范围局限在LSD内的SOM神经元。已有研究表明LSD内的SOM神经元调控恐惧反应[14],提示其在意识调控中有重要作用,我们通过钙信号记录与分析,证实了其活性在异氟醚麻醉-觉醒过程中发生了动态变化,并且在意识消失过程中显著下降和在意识恢复过程中显著上升。结合顺向病毒示踪和钙信号的结果我们认为,LSD内SOM阳性神经元可能通过调控下丘脑外侧区、腹侧被盖区等觉醒相关核团从而促进觉醒。SOM阳性神经元被认为是GABAergic抑制性神经元,而抑制性神经元促进觉醒的机制可分为去抑制兴奋性神经元[13]以及前馈抑制促进睡眠的抑制性神经元[17]。因此,LSD内SOM阳性神经元发出神经投射至上述核团内何种类型的神经元,以及是通过“去抑制”还是“前馈抑制”的作用调控不同核团促进觉醒,其神经环路机制仍需进一步探索研究。
综上所述,本研究较为系统地展示了LSD内SOM阳性神经元的神经传出投射,并证实了其参与全麻-觉醒调控的作用,为接下来研究其调控觉醒以及觉醒相关行为的机制提供了相关证据。
猜你喜欢 腹侧异氟醚神经元 刷短视频成瘾,是大脑的事儿吗青少年科技博览(中学版)(2022年2期)2022-03-29肾周筋膜悬吊装置在后腹腔镜肾部分切除术中的应用北京大学学报(医学版)(2021年4期)2021-11-241-氯-2,2,2-三氟乙基二氟甲基醚红外光谱研究有机氟工业(2020年2期)2020-07-04跑台运动对肥胖大鼠腹侧纹状体多巴胺水平及胰岛素信号的调控作用中国运动医学杂志(2020年3期)2020-05-21异氟醚间断预处理对非停跳冠状动脉移植患者的心肌保护作用心肺血管病杂志(2019年12期)2019-05-20跃动的神经元——波兰Brain Embassy联合办公现代装饰(2018年5期)2018-05-26大脑深处发现暴饮暴食触发点大众健康(2016年7期)2016-08-04七氟醚与异氟醚低流量吸入麻醉临床应用对比分析中国卫生标准管理(2015年25期)2016-01-14ERK1/2介导姜黄素抑制STS诱导神经元毒性损伤的作用中国生化药物杂志(2015年4期)2015-07-07毫米波导引头预定回路改进单神经元控制弹箭与制导学报(2015年1期)2015-03-11推荐访问:神经元 阳性 觉醒