应用超高效液相色谱-四极杆-飞行时间质谱法建立谷物中18种真菌毒素非靶向筛查数据库及确证方法
来源:优秀文章 发布时间:2023-02-16 点击:
章璐幸, 黄朝辉, 罗淑青, 曹 琳, 谢 莹, 钱 江*
(1. 浙江药科职业大学, 浙江 宁波 315100; 2. 宁波市药品检验所, 浙江 宁波 315048; 3. 宁波鄞州粮食收储有限公司, 浙江 宁波 315100)
真菌毒素(mycotoxins)是一类由产毒真菌在特定的生长环境下产生的有毒次级代谢产物,其对谷物作物的污染严重威胁了农产品的质量与安全[1]。部分真菌毒素具有强毒性等特点,有些毒素会在饲用动物体内发生结构转化,以结构类似物存在于食品中,危害人类健康[2]。
目前发现的数百种真菌毒素中,约12种真菌毒素被认为具有严重的健康危害[3],国际癌症研究机构(IARC)已将黄曲霉毒素列为Ⅰ类致癌物,将赭曲霉毒素等列为Ⅱ类致癌物[2],食品安全组织及多个国家均制定了比较严格的最大残留限量标准和检测方法。但是法规覆盖的真菌毒素种类和数量有限,评估各类真菌毒素在食品的生产、加工及流通等环节的暴露风险迫在眉睫。
随着检测技术的不断更新,目前液相色谱-串联质谱(LC-MS/MS)被认为是残留检测首选的方法[4-9]。虽然LC-MS/MS具有较高的灵敏度和选择性,但在处理的物质种类繁多时,方法的设置繁琐且费时[10];并且为了准确定性和定量,必须获得各种高浓度的真菌毒素对照品及对应的同位素内标[11-13],有些标准品如黄曲霉毒素类(黄曲霉素B1等)因纯度高、毒性大,不免会对实验者及实验环境造成一定的危害;而且由于靠预先设定的对照品来进行定性,无法获取对照品以外的真菌毒素残留信息。
随着质谱技术的发展,近年来现代液相色谱-质谱联用仪的性能改进以及有助于提升分析效率的软件工具的开发促进了残留检测技术的发展。高分辨质谱(HRMS)能够在全扫描模式下采集选定质量范围内的全部信息[14,15],因此能分析几乎无限数量的污染物。它们还支持通过回顾性数据分析来查找在测定时未予考虑的污染物[16]。并且具有高分辨率、高灵敏性等数据采集特性[1], HRMS也可以对没有参考标准的化合物进行定性筛查分析[17]。
本文建立了包含18种真菌毒素的UPLC-Q-TOF/MS高分辨质谱数据库,以稻谷和小麦作为研究对象,通过QuEChERS萃取盐包结合HLB净化柱的前处理方法进行筛查研究,确定每种真菌毒素在稻谷、小麦中的筛查检出限(SDL),最后将该方法应用于部分市售稻谷及小麦的真菌毒素筛查。本方法可实现无标准品情况下对真菌毒素的定性筛查,具有高通量、简便、快捷、准确等特点。
1.1 仪器与试药
SYNAPT G2 MS四极杆-飞行时间高分辨质谱仪、ACQUITY UPLC超高效液相色谱仪、MassLynx V4.2工作站、UNIFI科学信息学系统(美国Waters公司); Milli-Q超纯水纯化系统(美国Millipore公司); SB 25-12 DTN超声波清洗机(宁波新芝生物科技股份有限公司)。
真菌毒素标准品溶液和标准品见表1, QuEChERS萃取盐包购自美国安捷伦公司,Oasis Prime HLB净化柱购自美国Waters公司,实验用水为Milli-Q超纯水。甲醇、乙腈(质谱纯)购自德国Merck公司,乙酸、甲酸、乙酸铵(质谱纯)购自阿拉丁试剂公司。

表 1 18种真菌毒素标准品和混合标准溶液Table 1 Standard and mixed standard solutions of the 18 mycotoxins
1.2 色谱-质谱分析条件
1.2.1UPLC条件
色谱柱为Waters HSS T3 C18柱(100 mm×2.1 mm, 1.8 μm),柱温40 ℃,流动相A为含1%(体积分数)乙酸和5 mmol/L乙酸铵的水溶液,流动相B为甲醇,流速:0.3 mL/min。梯度洗脱程序:0~2.0 min, 10%B; 2.0~3.0 min, 10%B~20%B; 3.0~7.0 min, 20%B~24%B; 7.0~10.5 min, 24%B~30%B; 10.5~13.5 min, 30%B~60%B; 13.5~15.0 min, 60%B~70%B; 15.0~18.0 min, 70%B~75%B; 18.0~18.1 min, 75%B~95%B; 18.1~21.9 min, 95%B; 21.9~22.0 min, 95%B~10%B。样品进样量为3 μL。
1.2.2Q-TOF/MS条件
ESI正离子模式:毛细管电压3.00 kV,锥孔电压40 V,离子源温度110 ℃,脱溶剂气温度450 ℃,锥孔气流速50 L/h,脱溶剂气流速800 L/h。ESI负离子模式:毛细管电压3.10 kV,锥孔电压40 V,离子源温度110 ℃,脱溶剂气温度450 ℃,锥孔气流速50 L/h,脱溶剂气流速800 L/h。LockSpray溶液:亮氨酸脑啡肽(正离子m/z556.277 1,负离子m/z554.261 5);采集模式:MSE模式,质量扫描范围:m/z50~1 200;扫描时间0.25 s;低碰撞能量(LE)关闭,高碰撞能量(HE)为3~40 eV。数据采集由MassLynx V4.2工作站完成。
1.3 数据库的构建
1.3.1混合标准溶液的制备
按表1所示质量浓度配制混合标准溶液。
1.3.2数据库信息采集
在www.chemspider.com网站上检索真菌毒素,下载对应的.mol的文件,将列有各个真菌毒素化合物名称的excel表格和其结构式的.mol文件导入UNIFI软件,UNIFI会根据导入的结构式自动生成一份包含分子式、质量数的初步数据库。
在上述色谱-质谱条件下,UPLC-Q-TOF/MS用MSE模式对表1所示浓度的18种真菌毒素混合标准溶液进行采集,获得化合物的保留时间、加合物精确质量数等信息。在MS/MS模式下,得到不同碰撞能量产生的主要碎片离子的精确质量数。最后将两次数据采集的保留时间、加合物精确质量数和碎片离子的精确质量数录入数据库。
1.4 样品前处理
准确称取5.0 g样品于50 mL聚丙烯具塞离心管中,加入10 mL 10%(v/v)甲酸水溶液,涡旋混匀,再加入10 mL乙腈,振荡提取25 min,加入QuEChERS萃取盐包(含4 g硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸二钠盐),振荡5 min,以4 000 r/min的转速离心5 min,取上清液2.5 mL加至Oasis Prime HLB小柱上,用柱塞杆稍加施压,滤液弃去0.5 mL左右,取续滤液,用0.22 μm有机滤膜过滤,进样分析。
1.5 UNIFI筛查条件
选取加合物(包括[M+H]+、[M+NH4]+、[M-H]-和[M+CH3COO]-)作为目标质量,低能量通道质谱报告强度阈值100,高能量通道质谱报告强度阈值20;绝对保留时间漂移0.3 min;测得离子质量数与数据库中的离子理论质量数匹配容差5×10-6。
2.1 真菌毒素名单确定及其监管限量
根据中华人民共和国粮食行业标准LS/T 6133-2018《粮油检验 主要谷物中16种真菌毒素的测定 液相色谱-串联质谱法》[18]中发布的主要谷物中16种真菌毒素的名单,结合欧盟关于食品污染物最大限量的法规EC No. 1881/2006[19],并考虑到数据库未来的应用范围,增加了现行检测标准监管较少的桔青霉素和展青霉素[2],确定了构建数据库的18种真菌毒素名单,见表1。
真菌毒素有多种监管限量,具体取决于特定真菌毒素、被分析基质、监管机构和目标消费者。参考中华人民共和国国家标准GB 2761-2017《食品安全国家标准 食品中真菌毒素限量》[20]和EC No. 1881/2006[19],在稻谷、小麦基质中被监管的真菌毒素有7种,被监管的最大限量(maximum levels,MLs)具体数据见表2。
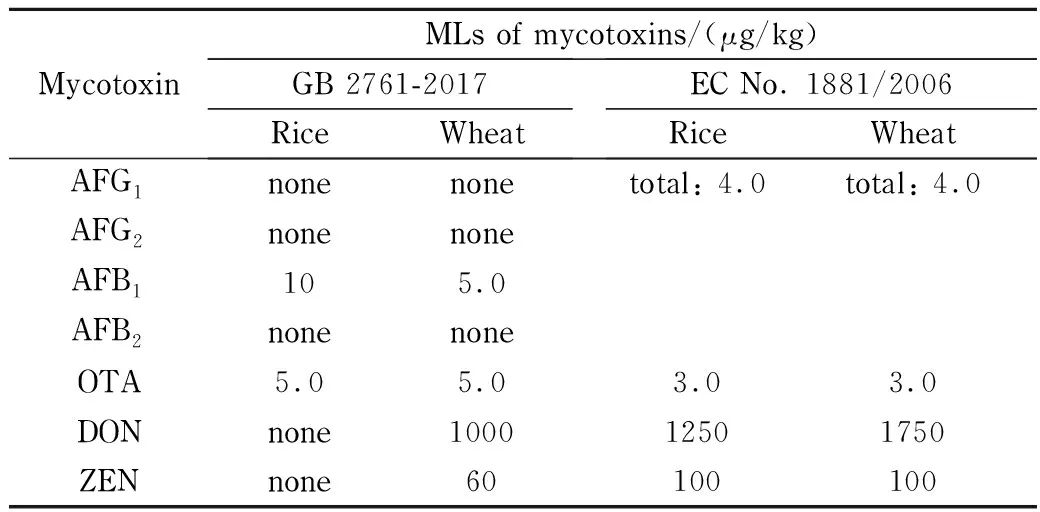
表 2 本研究中涉及的真菌毒素的最大限量Table 2 Maximum levels (MLs) of mycotoxins in this study
2.2 数据采集条件的优化
将18种真菌毒素混合标准溶液完成数据采集后获得的相关数据信息录入UNIFI数据库(见表3),总离子流图见图1。

表 3 18种真菌毒素精确质量数据库Table 3 Database of the exact mass of the 18 mycotoxins

图 1 18种真菌毒素的总离子流色谱图Fig. 1 Total ion chromatogram (TIC) of the 18 mycotoxins
在数据库的建立中,为了获得精确的加合物离子质量数和主要碎片离子质量数,我们在MassLynx中选择MS/MS模式,根据不同真菌毒素的结构特性,为每一个真菌毒素设立一组碰撞电压,记录加合物离子的精确质量数和主要碎片离子的精确质量数。如AFG1,考察了在碰撞能量(CE)分别为10、20、25 eV的情况下,加合物离子和碎片离子的分布和响应,选择20 eV为其最佳碰撞能量,并记录加合物离子的精确质量数为329.065 5,主要碎片离子的精确质量数为311.052 5、243.065 9和283.054 4,且该碎片离子的响应为加合物离子响应的10%以上。
确定特定碰撞能量下的加合物离子和子离子之后,用于样品筛查的色谱-质谱图需要在MassLynx中选择分辨率模式下的MSE模式采集。MSE的特点是能够获得包含所有成分的MS及MS/MS数据信息[21]。因此我们在MSE模式下同时开启低能量和高能量采集通道,高能量通道中设置了梯度碰撞能量,为3~40 eV,涵盖了在MS/MS模式下每一个真菌毒素的碰撞能量。
其中11种真菌毒素用正离子模式采集,7种真菌毒素用负离子模式采集。如果均以正离子或者负离子的模式采集会导致部分真菌毒素的响应达不到最佳状态。另外引入碎片离子这一维度信息,减少了假阳性的产生。
2.3 筛查方法的设置
将包含有色谱、质谱信息的原始数据导入UNIFI科学信息学系统,基本筛查流程见图2。

图 2 数据库的筛查流程图Fig. 2 Screening process for the data library
由于真菌毒素类筛查方法尚未给出明确指南,我们借鉴欧盟SANTE/11813/2017指南《食品和饲料中农药残留分析的方法验证和质量控制程序》[22]中关于高分辨质谱筛查结果的鉴定与确证方法,必须满足以下4个条件的前三条:第一,目标峰信噪比≥3;第二,至少两个测得的质量数(其中一个是碎片离子)与理论质量数质量偏差不超过5×10-6;第三,在基质匹配条件下,加合物离子和碎片离子的提取色谱图保留时间重合(±0.1 min);第四,试样与标准溶液中离子相对丰度的偏差最好不超过30%。但指南中也提到,第四个指标匹配离子相对丰度的偏差的要求不那么严格,可能随实验方法和仪器的稳定性不同而发生偏移,需具体情况具体分析,但应作为指示值,超过30%应进一步调查并判断。
使用UNIFI数据库进行自动筛查时,所设置的筛查条件直接影响筛查结果。筛查结果需要同时满足保留时间和精确质量数两个条件。通过积分参数的设置进行色谱峰识别,并将“已识别”的目标组分与数据库中指定的保留时间进行匹配。色谱系统虽然有较好的稳定性,但由于基质等原因会造成样品的保留时间与数据库中用标准品录入的保留时间之间会有一定的偏差,因此我们将保留时间窗口设置为0.3 min。在质谱方面,需要通过严格的质量数范围来筛选目标,同时考虑仪器分辨率的稳定性和筛查的准确性,加合物离子和碎片离子的质量数匹配容差设为5×10-6。此外,在进行加合物精确质量数匹配时,筛选候选项中的所有同位素,识别同位素的匹配情况,以避免产生假阴性结果。用真菌毒素混合标准溶液验证设置的筛查方法,结果显示能将目标物全部准确标识,没有发生错配的现象。
以3-ACDON为例,通过与数据库比对预期保留时间(11.94 min)和预期的精确质量数(337.132 5、307.119 8、173.056 9),就能在混合物中筛出3-ACDON并做标识。在色谱通道中,找到了加合物离子(m/z397.151 9)和特征碎片离子(m/z337.131 2、307.121 0)对应的色谱峰,该色谱峰的保留时间如图3所示,加合物离子的保留时间(11.84 min)和碎片离子的保留时间(11.84 min)完全一致。UNIFI软件给出了低、高两个碰撞能量通道的质谱图,3-ACDON在高碰撞能量通道中,2个主要碎片离子(m/z337.131 25、307.120 97)与数据库中的碎片离子的精确质量数偏差分别为3.7×10-6和3.8×10-6。符合SANTE/11813/2017指南中的要求“至少两个测得的质量数(其中一个是碎片离子)与理论质量数质量偏差不超过5×10-6”。此外软件给出了碎片离子(m/z307.120 97、173.062 71)可能的结构,如图4所示。

图 3 3-ACDON的筛查分析色谱图Fig. 3 3-ACDON screening chromatograms a. 3-ACDON [M+CH3COO]-m/z 397.1519; b. fragment ion m/z 337.1312; c. fragment ion m/z 307.1210. Acquisition mode: MSE negative mode; mass extraction window:±5×10-6.

图 4 3-ACDON的低能量和高能量通道筛查质谱图Fig. 4 3-ACDON screening mass spectra in low energy and high energy channels a. retention time: 11.8437 min, collision energy closed (low energy); b. retention time: 11.8437 min, collision energy of 3-40 eV (high energy).
2.4 筛查方法学验证
由于本方法侧重于定性筛查,因此重点验证筛查方法的准确性与稳定性。本文参考SANTE/11813/2017指南,以筛查检出限作为主要验证参数[22]。在稻谷、小麦基质中,18种真菌毒素中有7种真菌毒素规定了MLs, 11种尚未规定,按照SDL的定义“目标物在至少95%的样本中被检测到的最低浓度(不一定符合MS鉴定标准)”[22],我们把SDL的水平分成两类,一类是已有MLs的真菌毒素,由于这类真菌毒素其限量浓度高低不一,我们无法用绝对的数值去评估,因此这类真菌毒素以0.5倍、1倍、2倍、4倍MLs作为筛查浓度,做筛查方法学验证;另一类是没有规定MLs的真菌毒素,则以本方法中高分辨质谱能做到的至少95%的样品中可以检测到的最低浓度作为SDL。其中MLs是综合参考GB 2761-2017与EC No. 1881/2006,若针对同一个真菌毒素有不同的限量规定,则选取较低的MLs作为本文的依据。
选取25份稻谷、小麦,精密量取混合标准溶液0.5、1.0、2.0、4.0 mL添加至5 g样品中,经样品前处理后进行筛查检测。通过对检测结果的分析,确定小麦和稻谷中18种真菌毒素的SDL,结果见表4和表5。

表 4 18种真菌毒素在稻谷中的加标水平、检出个数及确定的筛查检出限Table 4 Spiked levels, detected numbers and screening detection limits (SDLs) of the 18 mycotoxins in rice

表 5 18种真菌毒素在小麦中的加标水平、检出个数及确定的筛查检出限Table 5 Spiked levels, detected numbers and SDLs of the 18 mycotoxins in wheat
由表4和表5可知,对于已有MLs的真菌毒素,AFB1、AFB2、AFG1、AFG2、OTA、DON均可在稻谷、小麦基质中在其各自的MLs水平实现95%的样品被筛查出,其中ZEN在0.5倍MLs,即30 μg/kg的水平也能被准确筛查,则其SDL小于MLs(60 μg/kg)。对于目前没有规定MLs的真菌毒素,以ST毒素为例,在加标水平分别是1.0、2.0、4.0、8.0 μg/kg处,统计能达到筛查标准的样品数量。在稻谷基质中,在加标水平为1.0 μg/kg处能被准确筛查到的样品数为21个,我们查看未被筛查到的4个样品数据信息,发现信噪比基本在10左右,保留时间基本一致,但是加合物离子的实测精确质量数与理论精确质量数偏差大于5×10-6,因此未被本法识别。当其加标水平增大到2.0 μg/kg时,在稻谷基质中,能被准确筛查到的样品数为24个,符合筛查条件,也满足了色谱峰信噪比≥3,加合物离子和碎片离子提取色谱峰保留时间一致。同样的,当含量达到4.0 μg/kg时,在稻谷基质中,能被准确筛查到的样品数依然为24个。鉴于在上述3种浓度条件下的筛查结果,可以认为ST毒素在稻谷基质上的SDL为2.0 μg/kg,最高水平8.0 μg/kg的数据不必统计,在表格中以“-”表示。同理,对于T-2毒素,当2.0、4.0 μg/kg均达不到筛查要求时,对于最低水平1.0 μg/kg的数据也不做统计,在表格中以“-”表示。最终确定没有MLs的真菌毒素的SDL数据见表4和表5,最低的SDL为2.0 μg/kg,为ST毒素;最高的SDL为800.0 μg/kg,为NIV、DON-3G、PAT。
考虑到样品本身会有真菌毒素污染,在做筛查检出限验证之后,对空白样品进行了一次筛查,1份稻谷中检出AFG1、AFG2、FB1、ST, 1份稻谷中检出FB1、ST, 2份小麦中检出FB1、OTA(见2.6节)。由于受限于样品被污染的多样性、基质效应和仪器检测灵敏度等因素的制约,我们无法获得绝对不含18种真菌毒素的空白稻谷、小麦样品,样品本底的污染会影响被监控真菌毒素SDL的准确性。为减少制约因素带来的误差,采用的措施如下:选用25批稻谷、小麦样品,均为1年内新粮,储存条件良好,减少被真菌毒素污染的几率;对2.6节所述样品进行3倍体积进样(10 μL),结果仍与2.6节结果一致,即同样的1份稻谷中检出AFG1、AFG2、FB1、ST, 1份稻谷中检出FB1、ST,同样的2份小麦中检出FB1、OTA,其他真菌毒素均未检出。
最后的SDL认定以稻谷中ST毒素为例,当加标水平为2.0 μg/kg时,在统计数量过程中,25批中检出24批,则有95%的样品被筛查到,但其中包含了2批本底受污染的样品,其检出的真菌毒素是本底和混合标样两个浓度的叠加,考虑到此种情况,计算时扣掉2批本底受污染的样品。剩下的23批可认为是未被18种真菌毒素污染的样品,结果23批中检出22批,依然可达到95%。
2.5 基质效应
在稻谷、小麦提取净化后,可能会有一些共同提取物对目标真菌毒素的离子化效率产生影响,造成目标物的信号响应增强或抑制。针对定性筛查方法,相关指南并没有给出基质效应的评价方法,由于基质效应会增强或者抑制离子信号,可能会造成假阴性或者假阳性的可能,因此我们对定性筛查的基质效应做初步考察。
选取自身受真菌毒素污染相对较低的3批稻谷、小麦样品作为空白基质,按照1.4节进行提取净化,获得空白基质提取液。用空白基质提取液和稀释液分别配制表4中4个质量浓度的混合标准溶液,同法分析。ME=(基质匹配校准曲线的斜率-标准曲线斜率)/标准曲线斜率×100%,当|ME|<20%时,弱基质效应,可以忽略;20%≤|ME|≤50%,中等基质效应;|ME|>50%,强基质效应。如图5所示,在小麦基质中,有7种真菌毒素|ME|<20%,是弱基质效应,有11种真菌毒素20%<|ME|<50%,是中等基质效应;在稻谷基质中,有4种真菌毒素|ME|<20%,是弱基质效应,有14种真菌毒素20%<|ME|<50%,是中等基质效应。对于有MLs的真菌毒素,虽然最高的基质抑制达46%,但其在限量浓度水平,提取离子色谱图中目标物的信噪比大于3,且加合离子和其中一个碎片离子精确质量数与数据库质量偏差≤5×10-6,其限量浓度达到了筛查检出限的水平,可避免假阴性的可能;对于没有MLs的真菌毒素,其中15-ACDON、DON-3G、桔青霉素及展青霉素的基质抑制超过45%,表4和表5显示,它们的SDL则较其他真菌毒素高。可能的原因是本文中的净化方法以尽量满足全部目标物的提取而牺牲了各个真菌毒素的回收率,这种为了获得提取的普适性而降低针对性的操作,在非靶向筛查中较为常见[23,24]。

图 5 稻谷、小麦中18种真菌毒素的基质效应Fig. 5 Matrix effects of the 18 mycotoxins in rice and wheat
2.6 实际样品检测
采用本文建立的方法对市售25批稻谷、小麦进行了18种真菌毒素的分析筛查验证,各筛查出2份阳性样品,1份稻谷中检出AFG1、AFG2、FB1、ST, 1份稻谷中检出FB1、ST; 2份小麦中检出FB1、OTA,其他真菌毒素均未检出。以一份检出ST的稻谷样品为例,将样品采集的数据与数据库中的保留时间、加合物离子和碎片离子的精确质量数进行比对,ST的提取离子色谱图和质谱图分别见图6和图7。在色谱图中,系统通过数据库标识了筛查出来的组分名字和保留时间,在高能量通道,可以观测到提取的碎片离子(m/z310.045 5、281.043 6)对应的色谱峰,其保留时间(17.48 min、17.47 min)和ST [M+H]+加合物离子的保留时间(17.47 min)一致。在质谱图的低能量通道,有[M+H]+加合物离子峰的精确质量数325.070 47,与其理论精确质量数偏差为0.6×10-6。在质谱图的高能量通道,有特征碎片离子m/z281.043 60,与理论精确质量数偏差为2.4×10-6,因此加合物离子与碎片离子测得精确质量数与理论精确质量数均在5×10-6以内。另外m/z281.043 60这个碎片离子相对丰度与标准溶液相对丰度的偏差均大于30%。可能影响碎片离子相对丰度偏差的因素主要包括仪器设备的稳定性、样品基质的影响及目标碎片离子较低的响应(S/N<15)[16]。指南中指出,由于精确质量测量的附加因素,对匹配离子相对丰度偏差的要求不那么严格,但应作为指示值,超过30%应进一步调查并仔细判断。因此后续可通过调整前处理的方式尝试样品浓缩来提高信号的响应,再对离子相对丰度的偏差进行评估。筛查结果表明,超过了SDL浓度的真菌毒素一定能检出,这对于可疑物质的风险控制较为有利。但同时,我们认为检出不代表一定超出MLs,对于检出的真菌毒素的浓度具体是多少,还需LC-MS/MS进行定量。

图 6 水稻中ST的筛查分析色谱图Fig. 6 ST screening chromatograms for rice a. ST [M+H]+m/z 325.0705; b. fragment ion m/z 310.0455; c. fragment ion m/z 281.0436. Acquisition mode: MSE positive mode; mass extraction window:±5×10-6.

图 7 水稻中ST的筛查分析质谱图Fig. 7 ST screening mass spectra for rice a. retention time: 17.4780 min, collision energy closed (low energy); b. retention time: 17.4780 min, collision energy: 3-40 eV (high energy).
本研究采用超高效液相色谱-四极杆-飞行时间高分辨质谱仪建立了真菌毒素非靶向筛查数据库,并针对稻谷及小麦基质进行筛查方法的开发和验证,最后将该方法应用于市售稻谷及小麦中真菌毒素的筛查。可实现无标准品情况下对真菌毒素的定性筛查。该法具有高通量、简便、快捷、准确等特点,适用于稻谷、小麦中多种真菌毒素的定性检测,同时也降低了检测人员被多品种、高浓度真菌毒素标准品危害的几率,为粮谷中的真菌毒素筛查检测提供新思路与新方法,也为监管提供技术支持。
猜你喜欢 稻谷毒素真菌 谦卑的稻谷科教新报(2021年39期)2021-11-04What Makes You Tired考试与评价·高二版(2021年3期)2021-09-10LC-MS在真菌毒素检测中的研究进展食品安全导刊(2021年21期)2021-08-30玉米价疯涨 稻谷也凑热闹今日农业(2020年15期)2020-12-15高等大型真菌与人类科学(2020年2期)2020-08-24毒蘑菇中毒素的研究进展天然产物研究与开发(2018年8期)2018-09-10真菌造房子小学科学(学生版)(2018年8期)2018-08-21烟叶主要真菌病害的发生与防治现代园艺(2017年23期)2018-01-18稻谷飘香四川党的建设(2015年9期)2015-09-15江汉平原辞安徽文学(2015年8期)2015-09-10推荐访问:靶向 确证 高效推荐文章
- 【想移民荷兰的朋友看过来,告诉你定居荷兰是一种怎样的生活体验】荷兰移民需要什么条件
- [关于训练口才的经典句子]训练口才的经典句子
- 【加拿大留学金融系专业排名】 加拿大留学专业排名
- 2018年四川省人民医院神经外科临床医师编外人员招聘公告 2018年神经外科年会
- 2018安徽高考志愿填报及征集志愿时间安排:2018高考志愿填报征集志愿时间
- 行政前台工作计划表_行政前台工作计划怎么写
- 和女朋友表白感人的话_和女朋友表白的句子
- 【英语语法:the,fact,that的语法功能】 in fact等于什么
- [2018入党培训心得体会范文2000字【三篇】]入党积极分子思想汇报
- 2018年中级审计师考试试题每日一练(6.14)|审计师报名时间2018