脱色菌藻聚生体系代谢组及固定化分析
来源:优秀文章 发布时间:2023-02-12 点击:
肖映瑱,徐小琳,2*,汤伟华,侯勇博,郭德亮
(1 石河子大学化学化工学院/环境监测与污染物控制兵团重点实验室;
2 兵团工业技术研究院,新疆 石河子 832000)
印染废水中的残余染料,排入江河中影响水中生物的生存。同时,有机物沉入水底,因厌氧分解产生各种有毒气体影响人类健康[1]。蒽醌染料是常用的合成染料之一,用量约占总染料的30%~35%。
印染废水处理方法主要有物理[2]、化学[3]和生物法[4]。其中生物法操作简单、成本低廉[5]。Dawkar等[6]利用芽孢杆菌在12 h内去除废水中80%的染料。但单一微生物脱色往往产生有毒的芳香胺或次级代谢物,甚至比母体染料更难降解[7]。复合微生物中不同菌株则可攻击染料分子的不同位点,或对代谢物分步降解,去除更彻底。汤伟华等[8]利用小球藻与曲霉聚生体系相比单一藻种可有效提高染料去除率。Tengda等[9]利用代谢组学技术探究栅藻Scenedesmus和硅藻Naviculasp.对污水中葛兰素内酯的去除,结果显示栅藻和硅藻对葛兰素内酯的去除率可达到72.9%-100%,代谢组学方法分析出葛兰素内酯在微藻体中的代谢涉及到甲基化、羟基化等。Chen等[10]利用代谢组学方法分析小球藻Chlorellasorokiniana和细菌共培养去除废水营养物,结果显示,共培养处理和单一小球藻对废水营养物去除率分别为94.4%和72%,已鉴定代谢物的PLS-DA推测共培养方法会促进小球藻的代谢水平。
由于游离微生物处理废水存在生物量流失,系统运行不稳定等问题。固定化细胞技术是目前常用的策略之一[11],Ueno等[12]用网状材料对菌株P.zopfii进行固定化,菌株能快速成膜,且反应稳定。
本文以具备染料降解能力的曲霉Aspergillussp.XJ-2和小球藻C.sorokinianaXJK聚生体系为研究对象[8],分析藻菌聚生体系形成前后,小球藻的代谢组变化,研究聚生体系提高染料去除率的机制;
并以聚氨酯泡沫为载体,优化固定条件,制备固定化菌藻聚生体系,为进一步开展光生物反应器的研究奠定基础。
1.1 菌株与材料
1.1.1 微生物
曲霉Aspergillussp.XJ-2和小球藻C.sorokinianaXJK由课题组自行筛选并保藏于石河子大学化学化工学院/环境监测与污染物控制兵团重点实验室。
1.1.2 微生物培养基
微藻培养基:改良BG11培养基,培养基配方见表1[13];
曲霉培养基:查氏培养基,培养基配方见表2[14]。
1.1.3 固定化材料
将聚氨酯泡沫、玉米芯和棉花秸秆切割成1×1×1 cm3形状,泡沫筛选合格后,乙醇浸泡15 min,去离子水冲洗3次,恒温60 ℃ 烘干24 h至恒重,待用;
1.1.4 模拟废水(g·L-1)
0.1分散红3B,0.38 NH4Cl,0.08 K2HPO4,0.03 KH2PO4,0.248 NaHCO3,0.5 葡萄糖(g)(表3)。

表1 BG11培养基配方

表2 曲霉培养基配方

表3 模拟染料废水指标
1.2 实验方法
1.2.1 菌藻聚生体系的构建
曲霉Aspergillussp. XJ-2密度为1.5 ×106cell mL-1,小球藻C.sorokinianaXJK密度为3.0 ×106cell mL-1,同时接种进分散红3B模拟废水,菌藻接种比例为1∶2,pH=6,温度为25 ℃,转速为160 r·min-1[15]。
1.2.2 小球藻代谢组学分析:
菌藻聚生体系以及单一小球藻对分散红3B模拟废水(0.1 g·L-1)脱色4 d。脱色后将单一小球藻和聚生体系洗脱的小球藻富集培养,然后每0.2 mL为一个样品,编号两组,每组6个样品。单一小球藻样品编号Group1(Z-1,Z-2,Z-3,Z-4,Z-5,Z-6),聚生体系洗脱的小球藻样品编号Group2(Z-7,Z-8,Z-9,Z-10,Z-11,Z-12)。进行代谢组学分析,按北京百迈克有限公司靶向代谢组学分析方法提取代谢物,安捷伦1290超高效液相-AB 5600 Triple TOF质谱仪进行分析。采用Analyst TF 1.7, AB Sciex软件进行一级、二级质谱数据收集。在每个数据收集循环中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。轰击能量:30 eV。离子源参数如下:雾化气压(GS1):60 Psi,辅助气压:60 Psi,气帘气压:35 Psi,温度:650 ℃,喷雾电压:5 000 V或-4 000 V。
1.2.3 固定化聚生体系降解条件优化
固定化材料的筛选:取2 g棉花秸秆、玉米芯、聚氨酯泡沫(Φ±0.3 cm),分别投加入100 mL浓度为0.1 g·L-1分散红模拟废水,与灭菌锅121 ℃灭菌20 min。
固定化载体投加量:接种孢子悬浮液浓度比为1∶2的菌藻聚生体系于100 mL模拟废水当中,投加通过以上实验选取的最适载体,投加量梯度为0.2、0.4、0.6、0.8 g·L-1。
固定化载体投加时间:接种孢子悬浮液浓度比为1∶2的菌藻聚生体系于100 mL模拟废水当中,在最适投加量下,选择载体投加时间梯度为0、6、12、24 h(其中0 h指同时投加聚氨酯泡沫与接种菌藻聚生体系)。
初始pH:接种孢子悬浮液浓度比为1∶2的菌藻聚生体系于100 mL模拟废水当中,在最适投加量及投加时间条件下,设置pH梯度为4、5、6、7、8。
1.2.4 固定化聚生体系的耐受性研究
固定化聚生体系的耐盐性:以优化后固定化菌藻聚生体系,降解分散红3B模拟废水,废水中调整NaCl浓度梯度为:5、10、15、20、25 g·L-1。
固定化聚生体系的染料浓度耐受性:以优化后固定化菌藻聚生体系,降解分散红3B模拟废水,调整分散红3B浓度梯度为:0.1、0.2、0.3、0.4、0.5 g·L-1。
固定化聚生体系对模拟废水中氨氮、TP和COD的去除:以优化后固定化菌藻聚生体系降解分散红3B模拟废水,在150 mL锥形瓶中加入100 mL的浓度为0.1 g·L-1的分散红模拟废水。每隔24 h取样,离心后测定上清液模拟废水中氨氮、TP、COD的去除情况。每组实验重复3次(表4)。

表4 营养物质测定方法
1.2.5 Zeta电位测定
选取优化后固定化菌藻聚生体系,在150 mL锥形瓶里,对100 mL的分散红3B(0.1 g·L-1)模拟废水进行脱色处理4 d。每隔24 h取样5 mL,模拟废水自然沉降,然后取悬浮液在Zeta电位分析仪下测量其Zeta电位,每组实验重复3次[19]。
1.2.6 测定方法
脱色率测定:将固定化菌藻聚生体系接入分散红3B模拟废水中后,放入恒温振荡器中培养,每隔1 d取样10 mL,8 000 r·min-1离心10 min,取上清液,以未加入分散红3B的模拟废水为空白,在最大吸收波长590 nm下测定其吸光度值的大小,用公式(1)计算脱色率[20]:
脱色率D(%)=(D0-Dx)/D0×100%。
(1)
式中:D0-t=0 h分散红3B染料的最大吸光度;
Dx-t=x h分散红3B时染料的最大吸光度。
生物量测定:在最适条件下利用固定化菌藻聚生体系处理模拟染料废水4 d,每24 h取样100 mL(整瓶样品)进行抽滤10 min,然后用蒸馏水清洗三次,在70 ℃干燥2 h至恒重,用感量0.1 mg天平准确称重。
固定化菌藻聚生体系生物量(g·L-1)m=(mx-m0- m1)/100×1 000。
(2)
式中:m0= 滤纸质量;
m1= 聚氨酯泡沫质量;
mx=干燥后样品总质量。
2.1 代谢组学样品分析
2.1.1 主成分分析
采用PCA分析方法分别对单一小球藻(Group1)和聚生体系小球藻(Group 2)进行样品检测,由图1可知Group1和Group 2的样品具有显著的差异,说明单一小球藻和聚生体系小球藻之间的代谢物差异较明显。Group1和Group 2的组内样品差异性不大,相对而言Group 2样品之间差异性更小。
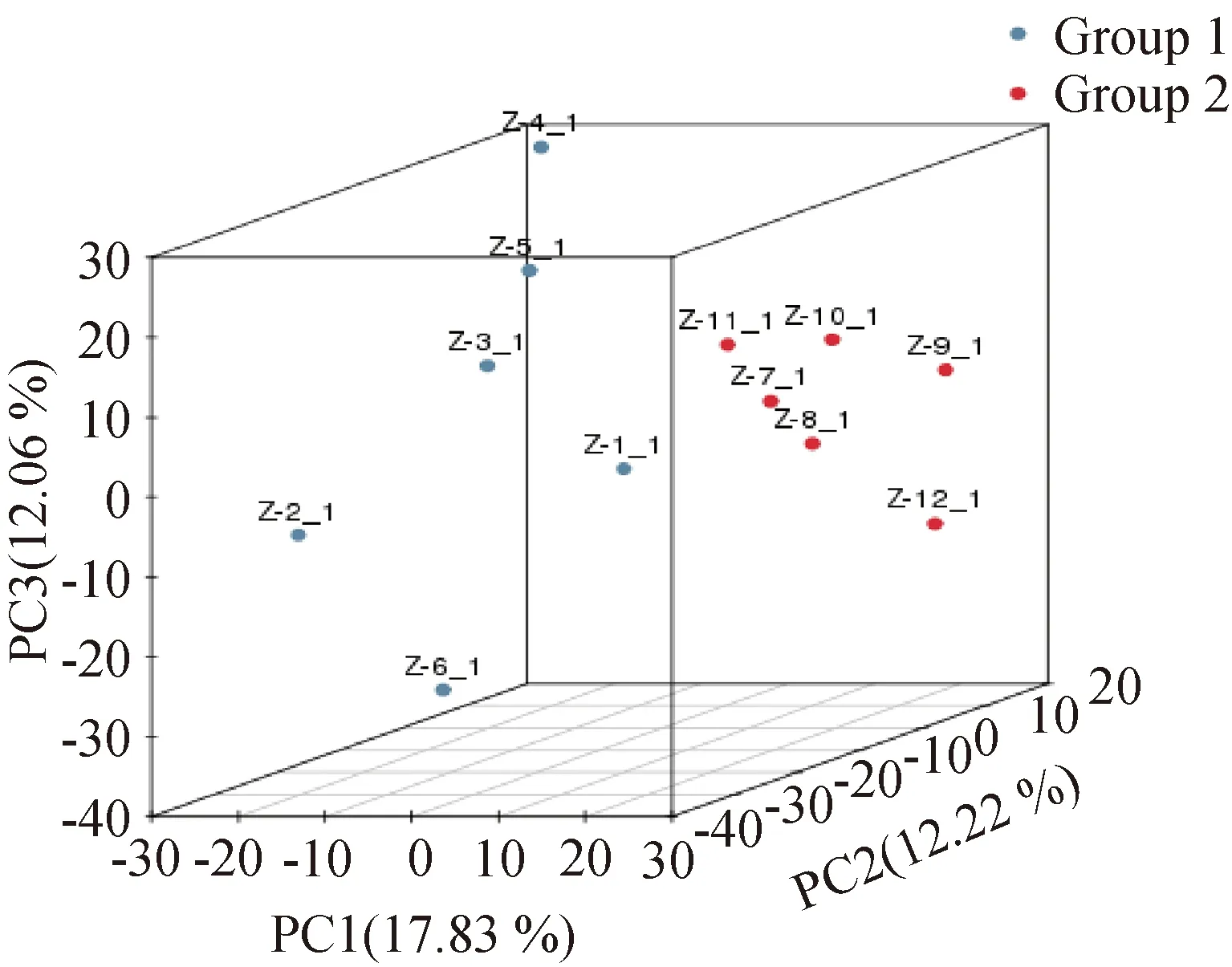
图1 单一小球藻及聚生体系小球藻样品PCA分析
为充分分析单一小球藻和聚生体系小球藻样品中代谢物的差异信息,筛选不同的差异代谢物,需进一步采取OPLS-DA模型进行验证。由图2A可知,Group1 vs Group 2中的样品点均匀地分布在两个不同的区域,且各自成簇。说明单一小球藻和聚生体系小球藻样品中代谢产物的含量和种类存在显著差异。图2A中R2X和R2Y均大于0.5并且Q2大于0.9,表明该模型具有较好的拟合性和预测性。
同时采用最小二乘法判别分析置换检验OPLS-DA模型可靠性,避免出现过拟合现象。图2B中横坐标对应置换检验的值,轴坐标为Q2或R2的值,从图中可以看出,R2值趋近与1,说明该模型符合样品的真实数据。Q2为0.005小于0.5,说明原模型未出现过拟合现象,并且稳定性良好。

A:OPLS-DA得分图;B:OPLS-DA检验结果图。图2 模型验证
2.1.2 差异代谢物筛选
以Pvalue< 0.05和VIP>1为条件筛选差异性代谢物,差异代谢物筛选结果如图3所示:436种差异性代谢物中有242种代谢物无明显变化,129种代谢物显著上调,65种代谢物显著下调。对样品代谢物进行log2处理后,其中能明确性质的代谢物有34种,主要包括:糖类5种、氨基酸6种、脂肪酸5种和18种其他类型代谢物。Group1 vs Group 2时,Group 2中糖类代谢产物均有不同程度的提升,并且检测出Group 2中月桂酸(lauric acid),棕榈油酸(palmitoleic acid),亚麻酸(linolenic acid)等油脂含量均有一定程度提升,表明菌藻聚生体系内真菌XJ-2对小球藻XJK的产油脂能力有一定辅助作用。Group 2中丙酮酸(Pyruvic acid)代谢量下降了2.42倍,研究发现大量的芳香族化合物降解过程会产生丙酮酸,小球藻中丙酮酸代谢表达量下调,有利于染料分子的降解。
同时,Group 2中山梨糖醇(sorbitol)上调2.5倍,海藻糖(trehalose)上调1.53倍,研究表明sorbitol和trehalose都参与了磷酸盐的转运,同时可以在磷酸盐转移酶作用下运送到小球藻细胞内,即提高小球藻去除废水中磷的能力。由表5可知Group 2中大部分氨基酸如鸟氨酸(ornithine),赖氨酸(lysine)和异亮氨酸(Isoleucine)代谢表达量均有提高,但L-谷氨酸(L-glutamic acid)代谢表达量下调。谷氨酸作为小球藻光合作用过程中重要代谢物之一,对小球藻细胞的生长起到很大作用。由于真菌XJ-2抑制了小球藻XJK体内合成L-谷氨酸的能力,从而小球藻XJK需要吸收更多胞外氮源形成L-谷氨酸,来满足自身光合作用所需营养,由此推测聚生体系有助于提高小球藻去除废水中氮的能力。
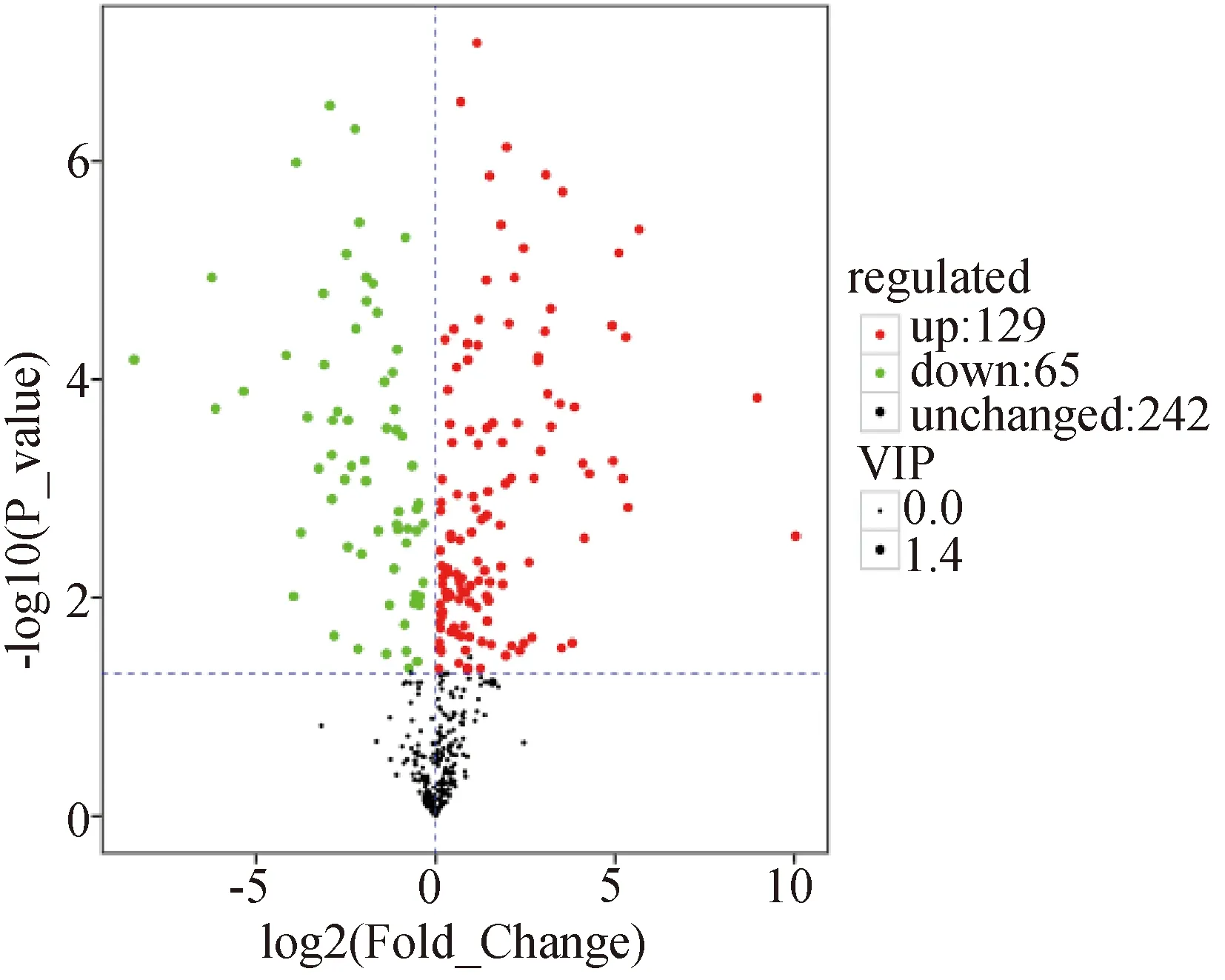
图3 小球藻样品的差异代谢火山图
通过代谢组分析可知,菌藻聚生体系中真菌的引入,使得藻类的代谢产物有明显改变,对与染料降解脱氮除磷均有一定的辅助,菌藻体系在污水处理中有很好的应用潜力,但游离微生物存在生物量流失,系统运行不稳定等问题。因此,拟采用固定化技术改善聚生体系的应用性能(表5)。

表5 Group 2显著差异性代谢化合物统计表
2.2 菌藻聚生体系的固定化
2.2.1 固定化载体的选择
选取2种植物废弃物(玉米芯、棉花秸秆)及一种合成有机高分子材料聚氨酯泡沫。通过对比固定化后脱色率、负载情况等指标,选择合适的固定化载体(图4)。

A:不同固定化载体脱色率;
B:固定化聚生体系脱色模拟废水4 d后照片。图4 不同载体材料负载聚生体系后对模拟废水脱色情况
结果如图4A所示,不同固定化载体对脱色率有一定的影响,当固定化载体为聚氨酯泡沫和玉米芯时,脱色率在第3 d均达到98.5%以上,但是当固定化载体为棉花秸秆时,固定化菌藻聚生体系在第2 d时发生了脱附现象,由79.7%下降至8%。因此以下研究选择聚氨酯泡沫和玉米芯进行对比。脱色四天后,可明显观察到模拟染料废水色度降低至无色透明,固定化聚生体系沉降在容器底部(图4B)。
2.2.2 固定化载体的优化
在固定化菌藻聚生体系对模拟废水处理过程中,固定化材料的选择、投加量、投加时间和pH都会对模拟废水的脱色有一定的影响,采用单因素法对模拟废水的脱色条件进行优化。
首先改变聚氨酯泡沫和玉米芯载体的投加量,通过对比固定化后的脱色率,选择最终适合的载体。结果如图5所示,当聚氨酯泡沫的投加量为0.8 g·L-1时,固定化菌藻聚生体系的脱色率达到98.5%,并且未发生脱附现象,较为稳定。而玉米芯投加量由0.2 g·L-1提高至0.8 g·L-1时,脱色率由95%下降至62.5%,随着投加量增加发生了脱附现象。
对比棉花秸秆和玉米芯这两种生物质来源的载体,虽然染料去除率可达90%以上,也可作为备选载体进行菌株固定化,但其有机碳含量较高,在培养体系中可为微生物提供一定的碳源,在一定程度上有助于其他杂菌的生长,其自身结构发生一定变化,本研究中均发生脱附现象,影响染料脱色效率。因此选择聚氨酯泡沫作为固定化载体。

图5 聚氨酯泡沫和玉米芯投加量对模拟废水脱色影响
由于菌-藻聚生体系进行脱色过程中生物量同时不断增加,会形成具有一定空间体积的球状菌丝体,在进行固定化时,不同大小的菌丝体在特定孔径聚氨酯泡沫载体上的固定化载量可能有所不同,因此考察了载体的投加时间,通过对比固定化后的脱色率和固定化载量,选择适宜的投加时间。由图6可知,当同时投加聚氨酯泡沫与接种菌藻聚生体系时(即所设投加时间0 h),固定化菌藻聚生体系对分散红3B的脱色率达到98.5%(4 d),同时生物量增加到4.51 g·L-1。此结果优于另外3组延迟投加载体的实验组。说明真菌类微生物固定化过程中,菌丝体大小于固定化载量有一定相关性。另外,同时投加固定化载体,可为快速生长的聚生体提供附着,提高菌藻聚生体系的抗剪切力、稳定性,从而有助于生物量积累以及染料的降解。本研究中对比几种投加时间,同时投加聚氨酯泡沫载体和菌藻聚生体系更有利于染料的脱色。

图6 聚氨酯泡沫投加时间对模拟废水脱色影响
通过改变模拟废水的pH值,对比不同pH值下的脱色率,结果如图7A所示。
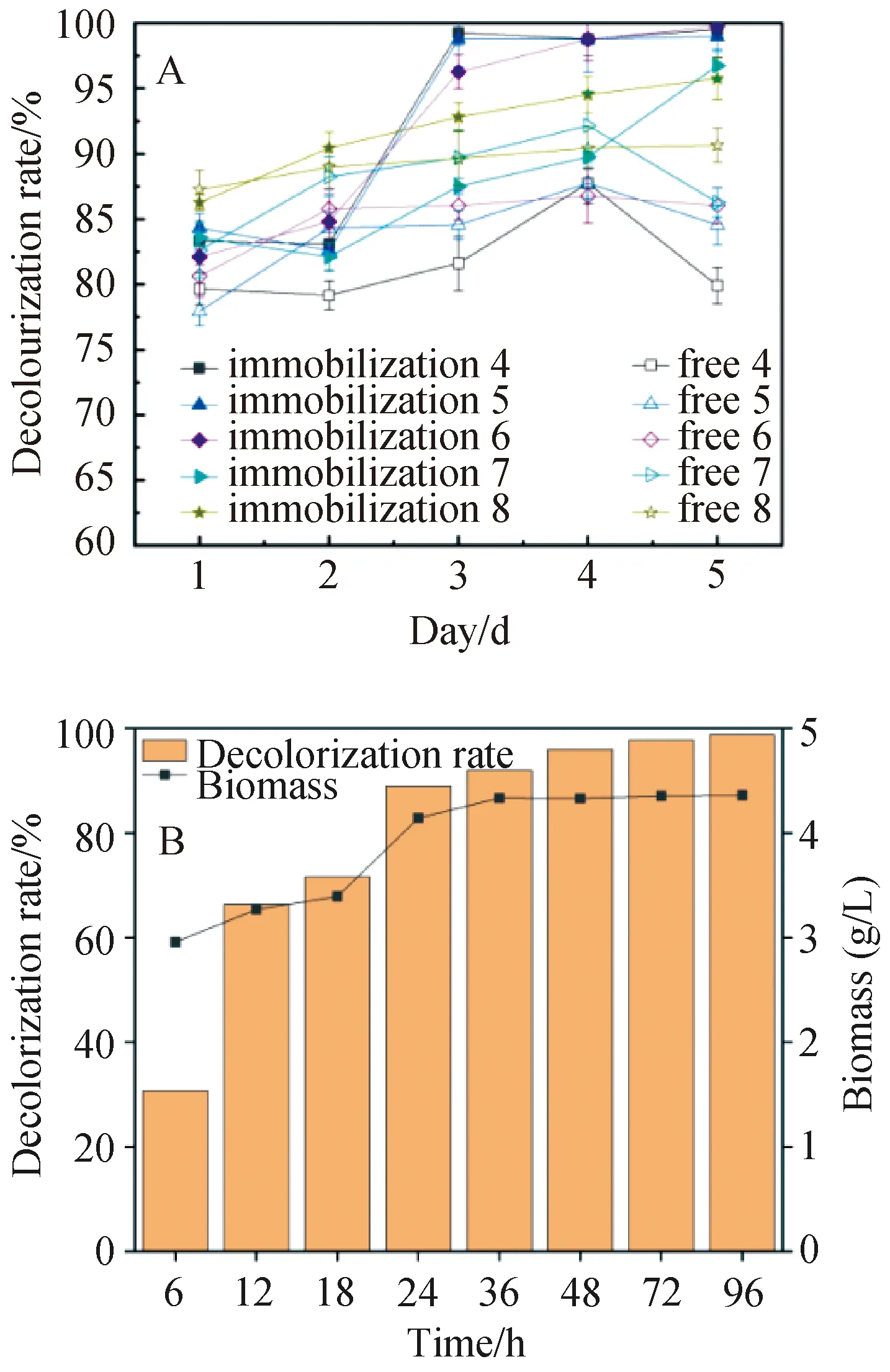
A:固定化菌藻体系和游离菌藻体系脱色率对比;
B:固定化菌藻聚生体系在最优pH下脱色率和生物量的变化。图7 不同pH对菌藻聚生体系染料脱色的影响
在初始pH为6时,固定化菌藻聚生体系对分散红3B的脱色率相对最高达98.8%。对比游离的菌藻聚生体系,经固定化后,菌藻聚生体系在不同pH的脱色率菌高于相应的游离状态,固定化对于聚生体系对酸碱的耐受范围扩大。最优条件下同时考察脱色率及脱色过程中生物量的变化,结果如图7B所示。优化后固定化菌藻聚生体系对分散红3B脱色过程中,其生物量在24 h内达到稳定期,同时脱色率达到较高水平,4 d后脱色率和生物量分别达到了98.8%和4.51 g·L-1。通过对脱色条件的初步优化,该固定化菌藻聚生体系对分散红3B模拟废水的脱色效率有所提高。
通过以上条件优化,固定化菌藻聚生体系在菌藻接种比例为1∶2,固定化载体与菌藻聚生体系同时投加,初始pH为6,温度为25 ℃,转速为160 r·min-1条件下,其对模拟废水脱色效果较好,4 d后对分散红3B的脱色率可达98.8%。
2.3 固定化聚生体系降解性能研究
2.3.1 固定化聚生体系耐盐性的研究
实际印染废水中往往含盐量较高,因此处理印染废水的微生物,其耐盐性为重要指标之一。比较固定化菌藻聚生体系和游离菌藻体系在去除分散红3B的过程中的耐盐性,结果如图8所示。在盐浓度达10 g·L-1时,固定化菌藻聚生体系脱色率仍保持96.5%,但游离菌藻体系脱色率降低至66.2%。可以看出固定化之后,由于载体的保护,对菌藻聚生体系的稳定有一定辅助作用,相对游离菌藻聚生体系,固定化后其能耐受更高的盐度,其高盐浓度下对分散红3B依然保持较高的脱色率。Jiang等[21]采用Fe3O4-藻酸钙珠包埋固定Debaryomycessp.在1%盐浓度下,40 h内可以完全降解苯酚废水。当盐浓度增加到9%时,固定化细胞72 h降解率超过99%,而游离细胞降解率仅为30.6%,可以看出固定化技术可以有效提高生物处理含盐废水效能。

图8 固定化菌藻体系和游离菌藻体系在不同NaCl浓度下模拟废水脱色率
2.3.2 固定化聚生体系染料浓度耐受性
实际废水中染料浓度通常有一定的波动,处理染料废水的微生物体系应对染料浓度有一定的耐受能力才能在实际生产中进行应用。本论文考察了不同染料浓度下,聚生体系的对染料的去除能力,结果如图9所示。随着染料浓度的逐渐升高,固定化聚生体系的染料脱色率逐渐降低,但当分散红3B浓度达到0.5 g·L-1时,固定化菌藻聚生体系4 d后脱色率仍能维持在90%,而游离态聚生体系脱色率下降相对较快。经过固定化之后,此聚生体系对染料浓度的波动耐受性有所提高。与本研究结果类似,黄文媛等[22]采用聚氨酯泡沫固定化产碱杆菌Alcaligenessp.DN25处理苯酚废水,结果表明在高浓度苯酚废水情况下,游离菌体完全受到抑制,而固定化产碱杆菌Alcaligenessp.DN25仍可以在66 h左右对其进行高效处理。可见固定化方法可有效提高菌体稳定性和对高浓度污水处理能力。

图9 固定化聚生体系和游离聚生体系在不同染料废水浓度下模拟废水脱色能力
2.3.3 固定化聚生体系对污染物的去除
污水处理中COD、TP、氨氮处理也是达标排放的重要指标,污染水体中染料去除的同时,还需要同时考虑其它污染物的去除,因此本研究还考察了固定化菌藻聚生体系对废水中COD、TP、氨氮的去除。结果如图10所示。
固定化菌藻聚生体系处理模拟废水4 d后,废水中COD、TP、氨氮去除率分别达到了85.5%、89.3%、89.4%。可以看出,该固定化菌藻聚生体系对于模拟废水中的营养物质也具有良好的去除能力。因此该体系在实际废水的处理中具有很好的应用前景。
2.4 固定化菌藻聚生体系的Zeta电位变化
Zeta电位是一种测量的是微生物表面电位的方法。Zeta电位的绝对值越高,则表明水溶液里固定化微生物体系越稳定,微生物更容易稳定的分散在水溶液里;
而如果Zeta电位绝对值越低,则表明水溶液里的微生物体系越不稳定,微生物更容易发生絮凝作用。
本研究对脱色过程中聚生体系的Zeta电位进行了测定,结果如图11所示,5 d中固定化菌藻聚生体系Zeta电位一直稳定在0 mV上下,而游离菌藻聚生体系的Zeta电位波动较大,说明固定化后载体对菌藻聚生体系起到很好的附着和支撑作用,相对游离体系更加稳定。
对比固定化菌藻聚生体系和游离体系的脱色效率,固定化后菌藻聚生体系脱色效率更高,说明稳定性提高,有助于微生物与可溶性污染物充分接触,固定化对体系稳定和脱色率提高有一定的促进作用。
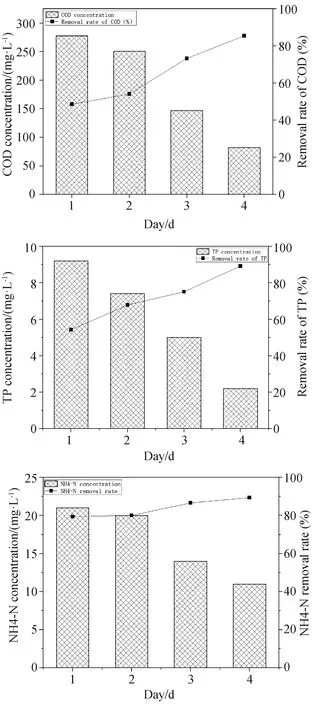
图10 固定化聚生体系对水体中污染物的去除率(COD、TP、氨氮)

图11 模拟废水脱色过程中聚生体系表面Zeta电位的变化情况
2.5 固定化聚生体系的重复批次
为考察固定化菌藻聚生体系重复利用情况,对将该体系重复用于染料的脱色。结果如图12所示。游离菌藻聚生体系脱色率下降较快,3 d后可见菌藻体系结构松散严重,培养液变浑浊。而聚生体系重复脱色3次时,能保持较好的完整性和较高的脱色率,脱色率维持在90%以上;
但随着重复使用次数的增加,固定化菌藻聚生体系对模拟废水脱色率逐渐下降,5次后,该体系对分散红3B的脱色率从最初的95%下降至64%,肉眼可见固定化结构出现松散现象,培养液浊度有所提高。宁立群等[23]将白腐真菌吸附固定在植物材料对酸性黑ATT进行脱色,结果表明连续脱色5次后脱色率仍能保持在89%以上。吴义诚等[24]采用纳米Al2O3-海藻酸钠固定小球藻去除废水中总磷,固定化菌体重复使用3次时,总磷去除率仍可以达到77.51%。由此可见,通过固定化技术有助于菌藻聚生体系结构完整,为生物处理废水的长效、稳定提供了有利条件。固定化方法的建立为微生物在废水处理中的实际应用提供保障。

图12 固定化菌藻聚生体系重复使用的脱色率
(1)代谢组分析表明,聚生体系小球藻相对于单一小球藻,糖类化合物、氨基酸、脂肪酸等差异性代谢物均有不同程度的提高,聚生体系中真菌和小球藻存在互作作用,真菌对小球藻代谢水平的作用有助于小球藻对污染的降解。
(2)适用于该聚生体系的固定化载体为聚氨酯泡沫,固定化菌藻聚生体系相对游离体系,具有更强的适应性,结构更加稳定,对蒽醌染料分散红3B脱色效率相对提高,同时能有效去除COD、TP、氨氮等污染物,且能耐受一定的盐浓度和染料浓度波动的冲击,并且可以多次重复利用便与回收和规模化使用。
猜你喜欢 小球藻脱色代谢物 小球藻在水产养殖中的应用及培养要点南方农业(2022年12期)2022-11-23高氨氮沼液浸种强化小球藻对沼液废水的处理效果西南农业学报(2022年8期)2022-10-28蛋白核小球藻的培养体系优化研究科学技术创新(2022年28期)2022-10-21阿尔茨海默病血清代谢物的核磁共振氢谱技术分析现代临床医学(2022年4期)2022-09-29一株红树植物内生真菌Pseudallescheria boydii L32的代谢产物*中山大学学报(自然科学版)(中英文)(2022年4期)2022-08-05漆树籽油与蜡脱色工艺条件初探农产品加工(2022年9期)2022-06-17高酸值米糠油的活性白土与硅胶联合脱色工艺研究中国油脂(2022年1期)2022-02-12响应面优化冷榨胡萝卜籽油吸附脱色工艺粮食与食品工业(2021年4期)2021-08-19山桐子油脱色工艺优化及其品质效应分析广东农业科学(2020年9期)2020-11-10环孢素A代谢物的研究概况Δ中国医院用药评价与分析(2020年3期)2020-05-29推荐访问:脱色 代谢 固定推荐文章
- 2018年江西赣州市医疗急救中心招聘编外人员公告:赣州市医疗急救中心
- 升学宴策划活动方案|2018升学宴活动方案
- 小学六一游园活动总结 [小学六一游园活动策划]
- 2018年中国工商银行广东分行暑期实习生招聘岗位、报名时间:2018中国工商银行广西分行春招
- 澳洲留学八大名校排名申请条件_澳洲留学奖学金申请条件及时间
- [调工商档案介绍信范文] 工商档案查询介绍信
- 加拿大亲属移民政策最新更新|加拿大亲属移民条件
- 初一下册语文练习册答案人教版2018 2018人教版语文练习册答案
- 贵州贵阳房价2018 2018年贵州贵阳中医学院第二附属医院招聘方案
- 【2018广东省湛江市赤坎区审计局招聘公告】2018湛江市赤坎区教师招聘