黄芪甲苷通过Toll-like,受体通路对HepG2,高脂细胞脂质积累的抑制作用
来源:优秀文章 发布时间:2023-02-08 点击:
杨柳 熊小平 马国斌 李昱 胡林 丁海强 曾圣强 王洪
高脂血症是指人体内的血脂水平过高,严重危害人的身体健康,可引起各种急、慢性并发症[1]。尤其是植入心脏支架的患者,更应严格控制血脂水平[2,3]。近几十年来,如何有效降脂的问题越来越受到研究者的关注。目前,在临床常规治疗中应用的降脂药物种类较多,西药主要有他汀类、贝特类药物[4]以及烟酸类及其衍生物等,以及较新的前蛋白转化酶枯草溶菌素9(PCSK9)抑制剂等[5]。与此同时,传统中医药因其毒性副作用小且具有降低血脂效应已成为研究的热点[6]。黄芪(AS-Ⅳ为黄芪提纯的单体)具有益气固表之功效。可降低心脑血管壁的压力,减轻胰岛素抵抗[7]。已被描述用于治疗高脂血症,在高脂血症患者中具有减轻血脂代谢紊乱,保护心肌作用[8,9]。然而,关于AS-Ⅳ的降脂作用、其潜在的分子机制和相关信号通路的数据有限。
Toll-like 受体(TLRs)信号通路在高脂血症患者中有广泛的跨细胞膜表达[10],不易受环境因素的影响。其中Toll 样受体2(TLR2)和TLR4 与高脂血症有关[11],当TC 和TG 升高时,TLR2 和TLR4 基因表达上调,此外,国内报道OXLDL/Beta2GPI/ANTI-Beta2GPI 复合物可通过TLR4 途径激活人脐静脉内皮细胞(HUVEC),表达与动脉粥样硬化相关的活性分子[12]。结合黄芪临床上的作用和之前的研究结果,作者有理由猜测AS-Ⅳ通过影响TLRs 信号通路参与多靶点降低血脂的过程。黄芪作为祖国中医药对降脂药物的重要补充,还有进一步研究机制的拓展空间。
HepG2 为人源性肝癌细胞系,由于其保留了与人体生物代谢相关的完整酶,能正常表达mRNA 转录水平和脂质代谢相关的蛋白质水平,因此在评价中药降脂活性方面,被多项研究采用[13]。所以,体外培养的HepG2 细胞系是降脂药物的新药筛选和药效评价的重要模型。基于此,本研究以该细胞模型为干预对象,研究不同浓度的AS-Ⅳ的作用从而来验证作者的假想。
1.1 材料
1.1.1 细胞株 人肝细胞癌细胞株HepG2。
1.1.2 药物配置 AS-Ⅳ:购自中国药品生物制品检定所(纯度≥98%,中国北京)。配置:将其溶解在二甲基亚砜(DMSO)中,使原液浓度为2 mmol/L。
1.1.3 主要试验仪器 细胞培养箱(Thermo Fisher Scientific,US);
超净工作台(苏净安,中国);
实时荧光定量PCR 仪(Applied Biosystems 7500 Fast,USA);
移液枪(Eppendorf)。
1.1.4 主要试剂 Dulbecco 培养基(Gibco Life Technologies,Grand Island,NY,USA);
0.25%胰蛋白酶(Gibco Life Technologies);
10% 胎牛血清;
油酸;
DMSO(USA);
RIPA 细胞裂解液;
引物序列(sinotec,CHINA);
QuantNva® SYBR® Green PCR Kit试剂盒(QIA-GEN,GERMANY);
BCA 蛋白定量试剂盒(Themo,USA)。
1.2 方法
1.2.1 细胞培养 将HepG2 肝癌细胞株细胞在混合10%胎牛血清的低碳水化合物Iscove 改良而成的杜尔贝克培养基(USA,NY)中进行孵育,并在37℃条件下,培养基每隔一天更换一次,使用0.25%胰蛋白酶 (Gibco Life Technologies) 消化和传代细胞。
1.2.2 脂肪堆积细胞造模(高脂细胞模型) 选用油酸最终浓度250 μmol/L 诱导HEPG2 细胞脂肪堆积,同时处理12 h,弃培养基,PBS清洗2次,每孔加入1 ml 4%多聚甲醛固定30 min,PBS 润洗2 次,加入终质量浓度为2 mg/L 油红O 染色40 min,PBS 润洗3 次,置于激光共聚焦显微镜下观察并拍照;
每孔加入1 ml 异丙醇溶解,将孔内溶液全部转于1.5 ml EP 管中,取1 ml 异丙醇溶液作对照,于510 nm 波长处测定吸光度,以吸光度反映脂滴含量。
1.2.3 实验分组 随机分为AS-Ⅳ低、中、高(0.05、0.1、0.2 mmol/L)剂量组,对照组,抑制剂组[TLR4 抑制剂TAK-242(最终浓度为1 µmol/L)],AS-Ⅳ+抑制剂组。
1.2.4 药物干预 在96 个孔板中接种5000 个细胞/孔密度的对数生长期HEPG2 细胞,在37℃的CO2培养箱中培养。使细胞粘连在一起。在培养基中培养24 h后,在处理组中加入不同浓度的AS-Ⅳ,并在37℃下再培养细胞使用8 个重复孔。没有使用AS-Ⅳ,而加入等量的培养基的细胞被用作每个板的对照组。
1.2.5 细胞内血脂水平测定 测定细胞内血脂水平采集细胞沉淀溶于0.3 ml PBS,超声破裂冰浴条件下(功率300 W,5 s/次,间隔30 s,重复3 次),匀浆。制备好的细胞试样采用酶标仪进行吸光度测定。
1.2.6 细胞增殖能力的测定方法CCK-8法使用CCK-8 细胞活力测试试剂盒(CK04;
Dojindo Laboratories,Japan)测定HepG2 细胞的活力。每孔10 μl CCK-8 溶液加入到培养基中。使用光谱仪(Multiskan FC;Thermo Fisher Scientific,Germany)在450 nm 处测量吸光度值(a)。使用以下公式计算存活细胞的百分比:细胞活力(%)=(实验孔A/对照孔A)×100%。
1.2.7 RT-PCR 检测TLR,TRAF6 和MyD88 mRNA 等表达 ①按说明提取核糖核酸。PCR 反应系统:2×SYBR Green PCR Master Mix 10。设置内参,RNA 逆转录成 cDNA 在PCR 管中配制逆转录反应液反应体系为20 μl: RNaseFree Water 4 μl,补足20 μl,搅拌均匀,短暂离心后,放入PCR 仪中。反应条件为42℃、45 min,85℃、5 min。②进行PCR 扩增。反应条件为:94℃预变性10 min;
然后94℃变性15 s,60℃退火1 min,共40 个循环。对目的基因相对表达量进行分析。③扩产产品。PCR 条带采用Quantityone 软件进行半定量分析,重复以上结果3 次,取平均值。设计引物见表1。
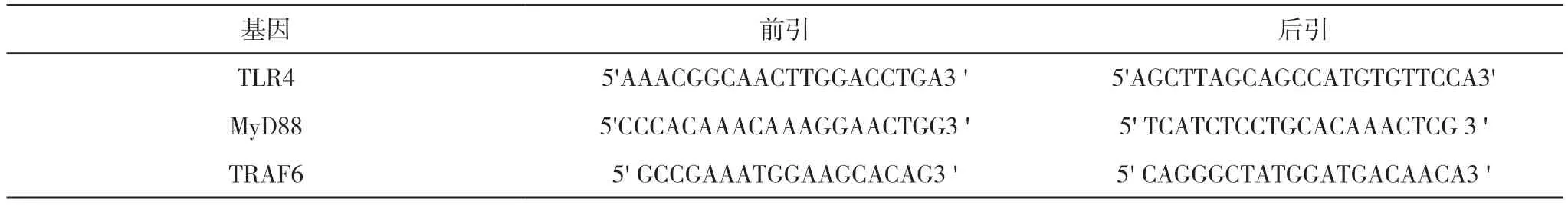
表1 引物序列
1.2.8 WB 法检测各组TLR4、MyD88、TRAF6 等蛋白的表达 ①所得细胞PBS 洗涤2 次,再加入适量的RIPA300 μl(内加入100×PMSF),加 入RIPA后转移到离心管,放置冰块,提取粗蛋白;
最后对蛋白浓度进行测定。之后将蛋白储存于-80℃。取一部分蛋白,煮沸10 min,储存于-20℃/-80℃待用。②用等量蛋白样本(50 μg)作SDS-PAGE 凝胶电泳,封闭后,除去封闭液。③加入密闭液稀释后的MYD88(1∶1000)、TLR4(1∶500)、TRAF6(1∶1000)、TBST 漂洗滤膜4 次,10 min/次。将HRP 标记的二抗(1∶4500)在室温下摇晃、孵化2 h,然后用TBST 将薄膜充分洗净,通过一台凝胶成像装置进行成像。作为内参蛋白的GAPDH表达、MyD88 的测定、TLR4 和TRAF6 水平的测定等用于统计分析。
1.3 统计学方法 采用SPSS21.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用Mann-Whitneytest。P<0.05 表示差异具有统计学意义。
2.1 各组HepG2 细胞增殖能力比较 实验结果显示,AS-Ⅳ介入HEPG2 细胞的细胞增殖抑制率呈剂量依赖性,根据细胞生长抑制率作图得到剂量反应曲线,求出AS-Ⅳ的半抑制浓度(IC50)值为2.107 mmol/L,获得 AS-Ⅳ低、中、高给药剂量分别为0.05、0.1、0.2 mmol/L。
2.2 AS-Ⅳ对HepG2 细胞内血脂水平的影响 AS-Ⅳ在中高剂量下,能明显降低血脂水平。与对照组相比,AS-Ⅳ低剂量组TG、TC、LDL 水平无明显变化,差异无统计学意义(P=0.33>0.05);
TG、TC、LDL 水平在AS-Ⅳ高剂量组中显著下降,差异具有统计学意义(P<0.05);
AS-Ⅳ中剂量组TG、TC、LDL 水平显著降低,差异具有统计学意义 (P<0.05)。见图1。

图1 对 HepG2 细胞内血脂水平的影响
2.3 实时荧光定量PCR 方法测定TLR4、MyD88、TRAF6 mRNA 表达检测结果 PCR 分析结果显示:AS-Ⅳ高、中、低剂量组,对照组,抑制剂组以及AS-Ⅳ+抑制剂组分别在1、2、3、4、5、6 泳道。用Image J 软件分析后得出高,AS-Ⅳ中剂量组中TLR4、MyD88、TRAF6 mRNA 表达差异具有统计学意义(P<0.05),而AS-Ⅳ低剂量组和对照组差异无统计学意义(P>0.05)。提示上述mRNA 表达水平随AS-Ⅳ干预浓度的降低而逐步提高。说明中、高剂量AS-Ⅳ干预有效,但是低剂量AS-Ⅳ干预作用不明显。抑制剂组与对照组比较差异具有统计学意义(P<0.05);
AS-Ⅳ+抑制剂组与对照组比较差异具有统计学意义(P<0.05)。提示AS-Ⅳ通过抑制相关TLR4、MyD88、TRAF6 mRNA 表达来干预血脂调节。见图2。

图2 实时荧光定量PCR 方法测定TLR4、MyD88、TRAF6 mRNA 表达检测结果
2.4 WB 法测定TLR4、MyD88、TRAF6 蛋白表达检测结果 Western blot 条带结果分析见图3。对照组对于Toll-like 信路相关的分子蛋白(TLR4、MyD88、TRAF-6) 均有表达,其中表达量相对较少的是MyD88。AS-Ⅳ高剂量组中相关分子蛋白的表达均显著下降,比较差异具有统计学意义 (P<0.05)。AS-Ⅳ中剂量组中相关分子蛋白表达均显著减低,比较差异具有统计学意义 (P<0.05)。AS-Ⅳ低剂量组与对照组的蛋白质表达比较,差异无统计学意义(P>0.05)。在Toll-like 信号通路重要节点蛋白分子的表达中,明确AS-Ⅳ能有效阻断Toll-like 依赖信号通路相关蛋白的表达。和PCR 结果相似,AS-Ⅳ低剂量组几乎没有起到相应的作用。抑制剂组与对照组比较差异具有统计学意义 (P<0.05);
AS-Ⅳ+抑制剂组与对照组比较差异具有统计学意义(P<0.05)。和PCR 结果类似,提示AS-Ⅳ通过抑制相关TLR4、MyD88、TRAF6 蛋白来干预血脂调节。

图3 WB 法测定TLR4、MyD88、TRAF6 蛋白表达检测结果
高脂血症在当今世界中对人类危害巨大,目前降血脂药物种类繁多,中医药在此方面有独特优势,但是,大多数详细的机制仍不清楚。中药现代化研究的优势是多组分、多靶点和多种药理作用,也是关键问题[14]。本研究的目的即在于揭示AS-Ⅳ在HepG2 高脂细胞模型中降低血脂的作用机制。
药理研究表明,黄芪具有降血脂、利尿等功效[15]。本研究使用HepG2 高脂细胞模型来验证AS-Ⅳ对高脂血症的干预作用。研究发现与对照组比较,AS-Ⅳ低剂量组TG、TC、LDL 水平无明显统计学差异,AS-Ⅳ中、高剂量组则能显著降低TG、TC、LDL 水平。这与很多学者应用大鼠模型研究等得出结论一致[16,17]。并且随着分子生物学技术的发展,代谢综合征中的TLR-4、MF-KB 等信号途径在脂代谢紊乱中的价值也得到重视[18]。最重要的结果(图2,图3)提示,AS-Ⅳ高、中剂量组TLR4、MyD88、TRAF6 表达和对照组有统计学差异,低干预浓度的AS-Ⅳ和对照组没有统计学差异。提示中、高剂量AS-Ⅳ浓度干预可降低血清中mRNA或蛋白表达的水平。这表明,AS-Ⅳ通过下调该通路中TLR4、MyD88、TRAF6 的表达而达到降低血脂的作用。这其中可能的原因有,首先,TLRs 被认为是近几年研究显示的一种损害诱导炎症的主要因素。TLR2和TLR4 在各种生理和病理条件下具有共同的配体和相似的功能[19,20]。无论是细胞学实验,还是动物研究,在胰岛素抵抗和2 型糖尿病的发生和发展过程中,慢性炎症的作用已经得到了证实[21]。Laureline 等[22]发现TLR4 缺乏预防间歇性缺氧(IH)诱发的胰岛素抵抗。而众所周知,血脂、肥胖和2 型糖尿病联系起来,胰岛素抵抗是一个枢纽,显然,降低胰岛素抵抗能有效的降低血脂[23]。
其他研究者发现,膳食中的饱和脂肪酸和棕榈酸能够激活TLR2 和(或)TLR4,并导致NF-κB 活化[24]。而同时TLR4-MyD88 的过度激活可能导致了更严重的脂肪代谢障碍,显然抑制 TLR4-MyD88能够逆转过度激活。
最后,TRAF6 在细胞内属于重要的适配蛋白TRAF 家族,具有独特的受体结合能力。TRAF6 参与下游效应蛋白Toll/IL-1 信号级联,TLR4/MyD88 信号通路[25]。说明抑制TRAF6,在一定程度上逐步放大抑制信号,信号通路被激活完成。
这一发现与之前的一些研究一致,即通过药理抑制TLR4,胆固醇浓度和TG 浓度在正常小鼠血清中显著降低[26]。另外,一些流行病学调查显示,HMGB-1(TLR4 配体之一)可作为胰岛素抵抗和肥胖的重要诊断标志物[27]。而与之对应的是,使用抗HMGB-1 中和抗体可以有效减轻肥胖小鼠的心脏损伤[28]。
此外,AS-Ⅳ低剂量组几乎没有发现显著对高脂细胞模型的作用,这可能说明AS-Ⅳ在低剂量下作用不明显。在黄芪建中汤对脾胃虚寒型胃溃疡模型大鼠JAK2/STAT3 信号通路作用下,白敏等[29]发现了黄芪建中汤的功效,而高剂量的组分更明显地影响了这一通路。这与作者的研究类似。这可能的原因是中,高剂量的AS-Ⅳ才能有效的抑制该通路相关基因的表达。抑制剂组与对照组相比有统计学差异;
AS-Ⅳ+抑制剂组与对照组相比有统计学差异,提示AS-Ⅳ可能通过抑制相关TLR4,MyD88,TRAF6mRNA,蛋白来干预血脂调节。
总之,本次研究表明,AS-Ⅳ可以作用于Toll-like受体通路,通过下调HepG2 模型中TLR4、MyD88、TRAF6 的表达而达到降低血脂的作用。其作用可能通过抑制TLR4 和MyD88 的激活以及TRAF6 的放大作用等来降低脂肪代谢紊乱,减轻胰岛素抵抗达进而达到目的(机制示意图见图4)。本研究重点分析AS-Ⅳ对HEPG2 高脂细胞模型Toll-Like 通路的影响,旨在对临床高脂血症中AS-Ⅳ的应用进行补充和提高。
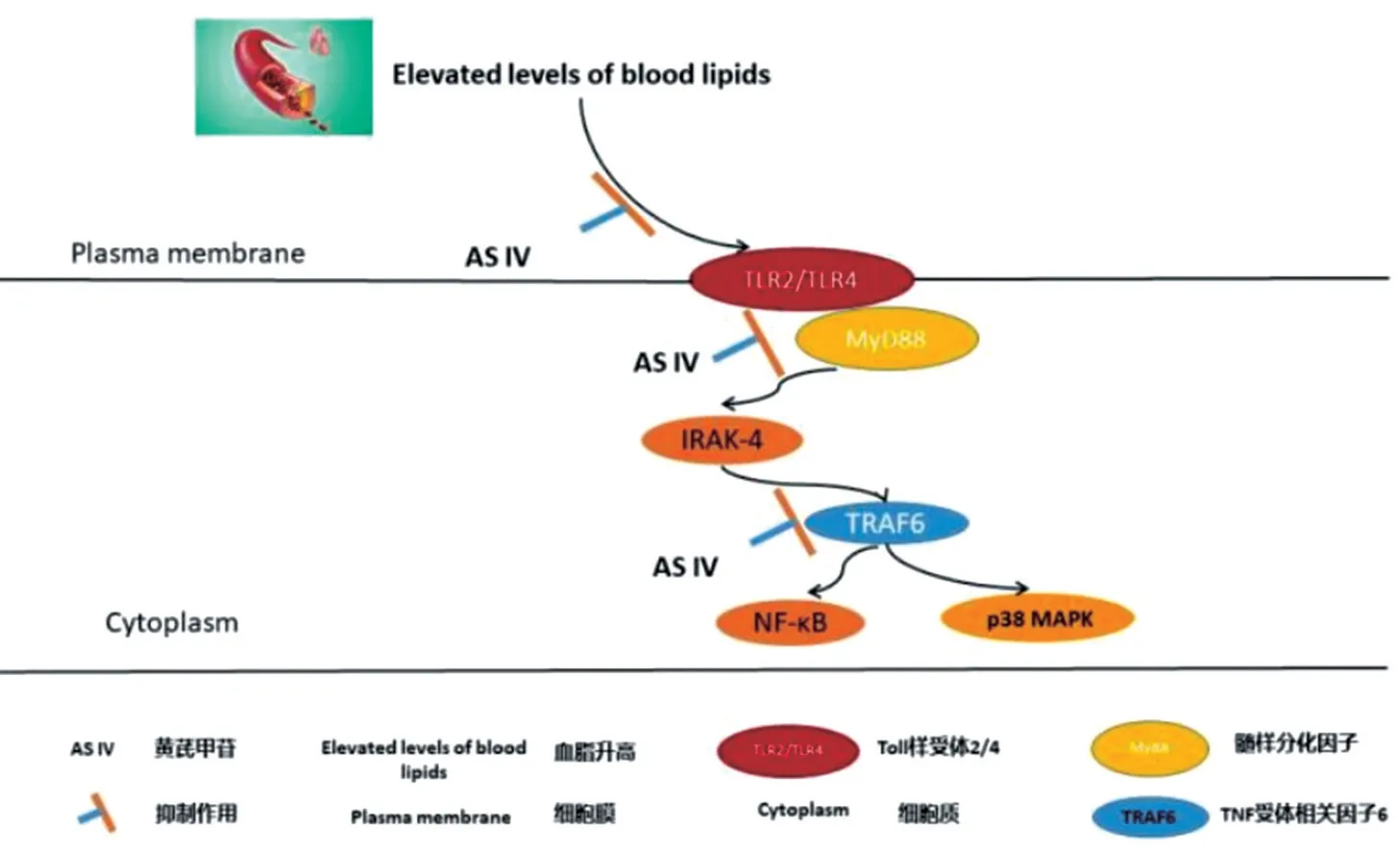
图4 AS-Ⅳ通过Toll-like 通路下调TLR,MyD88 以及TRAF6 降低血脂的可能机制
猜你喜欢 低剂量抑制剂血脂 调节血脂要靠有氧运动中老年保健(2022年6期)2022-08-19320排CT低剂量容积体部灌注成像强化峰值时间对孤立性周围肺病变诊断价值中国临床医学影像杂志(2022年6期)2022-07-26免疫检查点抑制剂相关内分泌代谢疾病天津医科大学学报(2021年4期)2021-08-21血脂常见问题解读保健医苑(2021年7期)2021-08-13SGLT2抑制剂对血尿酸影响的研究进展现代临床医学(2021年2期)2021-03-29血糖血脂对骨关节炎的影响医学新知(2019年4期)2020-01-02全模型迭代重建技术对低剂量CT冠状动脉支架显示的初步研究中国临床医学影像杂志(2019年1期)2019-04-25你了解“血脂”吗中国生殖健康(2019年3期)2019-02-01自适应加权全变分的低剂量CT统计迭代算法计算机应用(2016年10期)2017-05-12大孔径3T低剂量下肢动脉MRA的临床研究安徽医科大学学报(2015年9期)2015-12-16推荐访问:受体 黄芪 通路