高温胁迫下半夏叶片的转录组分析
来源:优秀文章 发布时间:2023-01-26 点击:
郭连安,莫让瑜,谭均,潘媛,陈大霞
(重庆市中药研究院,中国中医科学院中药资源中心重庆分中心,重庆市中药良种选育与评价工程技术研究中心,重庆 400065)
全球变暖导致极端高温天气频发,高温已成为影响植物产量的主要因素之一。高温不仅影响植物的表型,还会破坏细胞稳态,严重影响植物的生长发育,甚至导致死亡[1]。研究表明,高温胁迫会抑制植物各种生理和生化反应,包括水分利用、细胞膜稳定性、光合作用、次级代谢产物和植物激素水平等变化[2]。因此,研究植物如何响应高温胁迫对于提高植物耐热性具有重要意义。
半夏(Pinellia ternate)是天南星科半夏属植物,为我国传统的常用大宗中药材之一,具有悠久的药用历史,用于止咳祛痰、镇吐、抗癌、抗早孕、抑制心律失常和炎症等多种病症[3]。目前,有关半夏的研究多集中于栽培技术[4]、有效成分[5]和药理作用[6]等方面。半夏对高温非常敏感,温度过高会出现倒苗,人们逐渐关注到高温对半夏的生理特性[7-8]、植物激素[9]和有效成分含量[10]等方面的影响。然而,从分子生物学水平上探究半夏在温度胁迫下的应对机制,筛选半夏热胁迫基因,提高半夏的耐热性是减轻高温对半夏生长造成伤害的最有效方法。
随着生物技术的发展,转录组测序技术已普遍应用于药用植物功能基因组的研究,能在单核苷酸水平对药用植物的整体转录活动进行检测,从而快速地获取研究对象在某一状态下的转录本信息[11-12]。转录组测序能研究药用植物活性成分的生物合成与调控,挖掘参与逆境胁迫调控的重要功能基因,有助于天然药物的开发和高产抗逆品种的选育。通过转录组测序,已获得高温胁迫下牡丹Paeo⁃nia suffruticosa[13]、薄荷Mentha haplocalyx[14]、黄花蒿Artemisisannua[15]等药用植物转录组信息,为药用植物的遗传改良提供了丰富的基因资源。本研究对高温胁迫下半夏叶片进行转录组测序分析,筛选和挖掘半夏热胁迫基因,为培育半夏耐热品种提供基因资源和理论依据。
1.1 供试材料
半夏种源采自重庆市万州区,经重庆市中药研究院陈大霞研究员鉴定为天南星科半夏属植物半夏(Pinellia ternate)的块茎。选取大小一致的半夏块茎播种于花盆中,培养基质为土壤∶蛭石=2∶1,每盆20颗,在人工气候箱中培养,白天温度25℃,晚上温度20℃,光周期为12 h光照12 h黑暗,光照4 000 lx。待半夏植株长到约15 cm时,在人工气候箱中进行38℃高温处理,12 h后取半夏叶片,用锡箔纸包裹储藏于液氮中,待用。
1.2 总RNA的提取、文库的构建及测序
采用植物总RNA提取试剂盒(TIANGEN)提取半夏叶片总RNA,用Nanodrop超微量分光光度计(Thermo)检测RNA的浓度和纯度,利用琼脂糖凝胶电泳(150 V,20 min)分析RNA质量。检测合格的6个半夏叶片RNA样品委托北京诺禾致源科技股份有效公司进行cDNA文库构建和转录组测序。
1.3 转录组数据组装
转录组原始数据经去除带接头和低质量的reads后,获得Clean reads。利用Trinity软件对Clean reads进行拼接和组装,获得不同大小的转录本(Transcripts)和基因(Unigenes)。
1.4 差异基因分析
采用FPKM值估算基因表达水平,采用Cuf⁃flinks软件对测序得到的FPKM值进行分析[16-17],以Padj<0.05(Padj为矫正后的P)且log2(fold change)≥2为标准筛选差异表达基因(DEGs)。
1.5 DEGs功能注释及GO、KEGG富集分析
将DEGs与NR(NCBI non-redundant protein sequences)、NT(NCBI nucleotide sequences)、PFAM(Protein family)、KOG(euKaryotic Ortholog Groups)、Swiss Prot(Swiss Prot protein database)、KEGG(Kyoto Encyclopedia of Genes and Genomes)和GO(Gene Ontology)等数据库进行比对,获得DEGs的功能注释信息,并对DEGs做GO和KEGG富集分析。
1.6 qRT-PCR分析
采用Primer Premier 5.0软件设计基因特异性引物,内参基因为PtGAPDH[7](表1)。采用M 5 Super plus qPCR RT kit with gDNA remover试剂盒(Mei5bio),以500 ng RNA为模板反转成cDNA。使用实时荧光定量试剂盒(Vazyme)进行qRT-PCR,20μL反应体系为:模板RNA 2μL、上游引物和下游引物各1μL(引物终浓度0.2μmol/L),10μL ChamQTMUniversal SYBR qPCR Master Mix,用ddH2O补足至20μL。所用程序为:94°C预变性5 min;
94°C变性10 s,60°C退火30 s,72°C延伸40 s,40个循环。

表1 实时定量荧光基因引物序列Table 1 Real-time quantitative gene primer sequences
1.7 转录组序列号
全部转录组数据可在美国国家生物信息中心(NCBI)SRA数据库中查询(PRJNA781127)。
2.1 半夏转录组测序结果与数据组装
经高温胁迫处理后,半夏对照组(CK)和高温处理组(T)样本经转录组测序共获得Raw reads 131 281 455条。将有接头的、低质量的Raw reads进行过滤,对照组和高温处理组分别获得62 973 770条和65 240 619条Clean reads,共包含38.48 Gb Clean bases(表2)。经测序质量控制分析,6个半夏叶片测序样本的Q20≥97.23%,Q30≥92.94%,GC con⁃tent≥48.84%(表2),表明这6个半夏叶片转录组测序的质量较高,可用于De novo组装和数据分析。

表2 高温胁迫下半夏转录组测序质量情况Table 2 Sequencing quality of transcriptome of Pinellia ternata under high temperature stress
通过Trinity软件对过滤后的Clean reads进行拼接,共获得281 189个转录本,总长度275 002 094 bp,平均长度978 bp,N50长度为1 270 bp(表3)。通过对所有转录本进行进一步聚类和组装,共获得91 526条Unigenes,总长度82 269 071 bp,平均长度899 bp,N50平均长度1 214 bp。Unigenes长度主要分布在300~500 bp,共有36 904个,占总数的40.32%;
长度为500~1 000 bp的转录本29 243个,占比31.95%;
长度为1 000~2 000 bp的转录本17 362个,占比18.97%;
长度大于2 000 bp的转录本有8 017个,占比8.76%(表3)。转录本和Unigenes的分布趋势不同,分布在500~1 000 bp的转录本最多,而Unigenes的数量随序列长度的增加而减少。
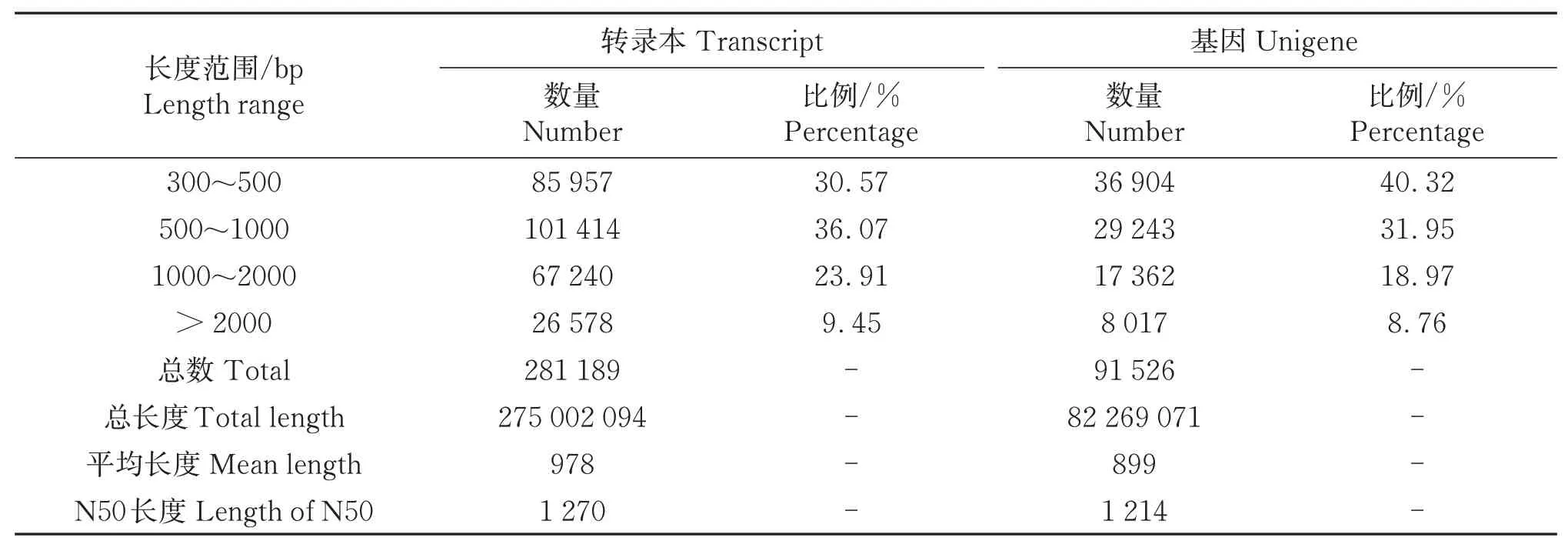
表3 高温胁迫下半夏转录组数据组装统计Table 3 Assemble statistics of transcriptome data of Pinellia ternata under high temperature stress
2.2 转录组Unigenes的功能注释
将Unigenes序列分别在不同的数据库中进行比对,共有45 409条Unigenes获得注释,占比46.61%。其中获得注释比例前三的数据库是NR、PFAM和GO,分别占比39.47%(36130条)、30.05%(27 506条)和30.05%(27 505条)(表4)。根据NR数据库中的物种注释比对,发现大部分Unigenes(27.3%)的E值分布于10-15~10-5(图1A);
40.2%的Unigenes的序列相似度在60%~80%(图1B);
此外,分别有12.5%和12.1%的Unigenes注释到非洲油棕和海枣(图1-C)。

图1 Unigene的NR注释Figure 1 NR annotation of transcriptome for Unigenes

表4 Unigene的注释统计Table 4 Unigenes annotation statistics
2.3 差异表达分析
通过将对照组和高温处理组的半夏叶片转录组数据进行比较分析,以Padj<0.05(Padj为矫正后的P)且|log2(fold change)|≥2为判断标准筛选DEGs。图2结果表明:对照组和高温处理组之间共筛选到1 716个DEGs,与对照组相比,高温处理组中有1 138个DEGs表达量上调,578个DEGs表达量下调。

图2 差异表达基因的火山图Figure 2 Volcano map of differentially expressed genes
2.4 DEGs的GO富集分析
将对照组与高温处理组半夏叶片之间的DEGs进行GO(Gene ontology)功能注释分析,611个DEGs被注释到生物学过程、细胞组分和分子功能3大类,其中有356个DEGs表达量上调,255个DEGs表达量下调。图3为DEGs在GO数据中显著富集的GO term(P<0.005)。在生物学过程方面,除单有机体细胞器组织(22个,占3.60%)得到最显著富集外,还有化学响应(20个,占3.27%)、激素响应(14个,占2.29%)、有机物响应(14个,占2.29%)和生长素响应(13个,占2.13%)等与逆境胁迫相关的GO term,说明高温胁迫已影响半夏的正常生命活动。在细胞组分方面,DEGs主要富集在转录因子复合体(45个,占7.36%)、转移复合体,转移含磷基团(22个,占3.60%)和宿主细胞核(18个,占2.95%)等GO term。在分子功能方面,DEGs主要在内肽酶活性(27个,占4.42%)、血红素结合(23个,占3.76%)和四吡咯结合(23个,占3.76%)等GO term得到显著富集,说明高温胁迫已导致植物细胞被破坏。

图3 高温胁迫处理下半夏转录组DEGS的GO分类Figure 3 Go classification of DEGs in Pinellia ternata transcriptome under high temperature stress treatment
2.5 DEGs的KEGG分类与通路富集分析
将对照组与高温处理组半夏叶片之间的DEGs进行全基因组及代谢途径调控网络富集分析,共有194个DEGs注释到细胞过程(3条)、环境信息处理(2条)、遗传信息处理(15条)、代谢(41条)和生物系统(2条)5大类63条KEGG代谢通路,其中有120个DEGs表达量上调,74个DEGs表达量下调。图4为DEGs富集程度排名前30的代谢通路,获得DEGs注释数量最多的3个代谢通路为内质网蛋白质加工(68个,占35.05%)、内吞作用(25个,占12.89%)和剪接体(23个,占11.86%)。进一步对上调和下调的DEGs进行代谢通路富集分析,发现高温胁迫后半夏叶片中表达量上调的DEGs主要与内质网蛋白加工、内吞作用和剪接体有关(图5A);
表达量下调的DEGs主要集中在氨基糖和核苷酸糖代谢、淀粉和蔗糖代谢及半胱氨酸和氮代谢等代谢通路(图5B)。

图4 高温胁迫下DEGs富集程度排名前30的代谢通路Figure 4 Top 30 of metabolic pathways enrichment of DEGs under high temperature stress treatment.

图5 高温胁迫处理的半夏转录组DEGs KEGG通路富集分析Figure 5 KEGG pathway encichment of DEGs in Pinellia ternata transcriptome under high temperature stress treatment
2.6 差异表达基因功能鉴定
2.6.1 半夏叶片植物激素相关DEGs分析 高温胁迫可能会引起植物细胞内激素代谢和信号转导发生变化。通过转录组测序分析发现,高温胁迫下生长素应答蛋白基因PtARP1、赤霉素调控蛋白基因PtGRP1和脱落酸应答元件结合因子基因PtABF表达量上调,而11个生长素应答蛋白基因PtARP、2个细胞分裂素信号途径负调控基因PtARR(PtARR1、PtARR2)和赤霉素调控蛋白基因PtGRP2表达量下调,说明高温胁迫下不同植物激素响应基因的表达模式存在一定的差异。
2.6.2 半夏叶片氧化还原系统DEGs分析 高温胁迫下,植物体内产生活性氧会破坏细胞膜,而保护酶系统可以清除活性氧,减轻活性氧所造成的细胞损伤。转录组分析发现:在高温胁迫下,7个谷胱甘肽S转移酶基因PtGST表达量不同程度上调,4个过氧化物酶基因PtPOD和2个过氧化氢酶基因PtCAT表达量下调(表6)。

表6 氧化还原系统DEGs分析Table 6 Analysis of DEGs involved in oxidation-reduction system
2.6.3 半夏叶片热激蛋白DEGs分析 热激蛋白是植物受到高温胁迫后产生的一类新的蛋白质,可以提高植物的耐热性。转录组分析发现:半夏叶片中有23个热激蛋白基因PtHSP在高温胁迫下表达量呈现不同程度的上调表达(表7)。这些结果表明高温胁迫下,半夏叶片中的热激蛋白基因表达量增加,对维持细胞稳态、提高抵御高温胁迫的能力具有重要作用。

表7 热激蛋白相关DEGs分析Table 7 Analysis of DEGs encoding heat shock protein
2.7 实时荧光定量分析
为了进一步验证转录组数据,随机选取9个在高温胁迫下上调和下调的DEGs,分别是3个生长素应答蛋白基因PtARP(PtARP3、PtARP5、PtARP12)、细胞分裂素信号途径负调控基因PtARR1、过氧化物酶基因PtPOD1、谷胱甘肽S转移酶基因PtGST2和3个热激蛋白基因PtHSP(PtHSP1、PtHSP2、PtHSP23),使用qRT-PCR技术进行验证。图6的结果表明,9个DEGs在高温胁迫下的表达量变化趋势与转录组测序结果基本一致,表明转录组测序结果相对可信。

表5 植物激素信号转导途径DEGs分析Table 5 Analysis of DEGs involved in plant hormone signal transduction
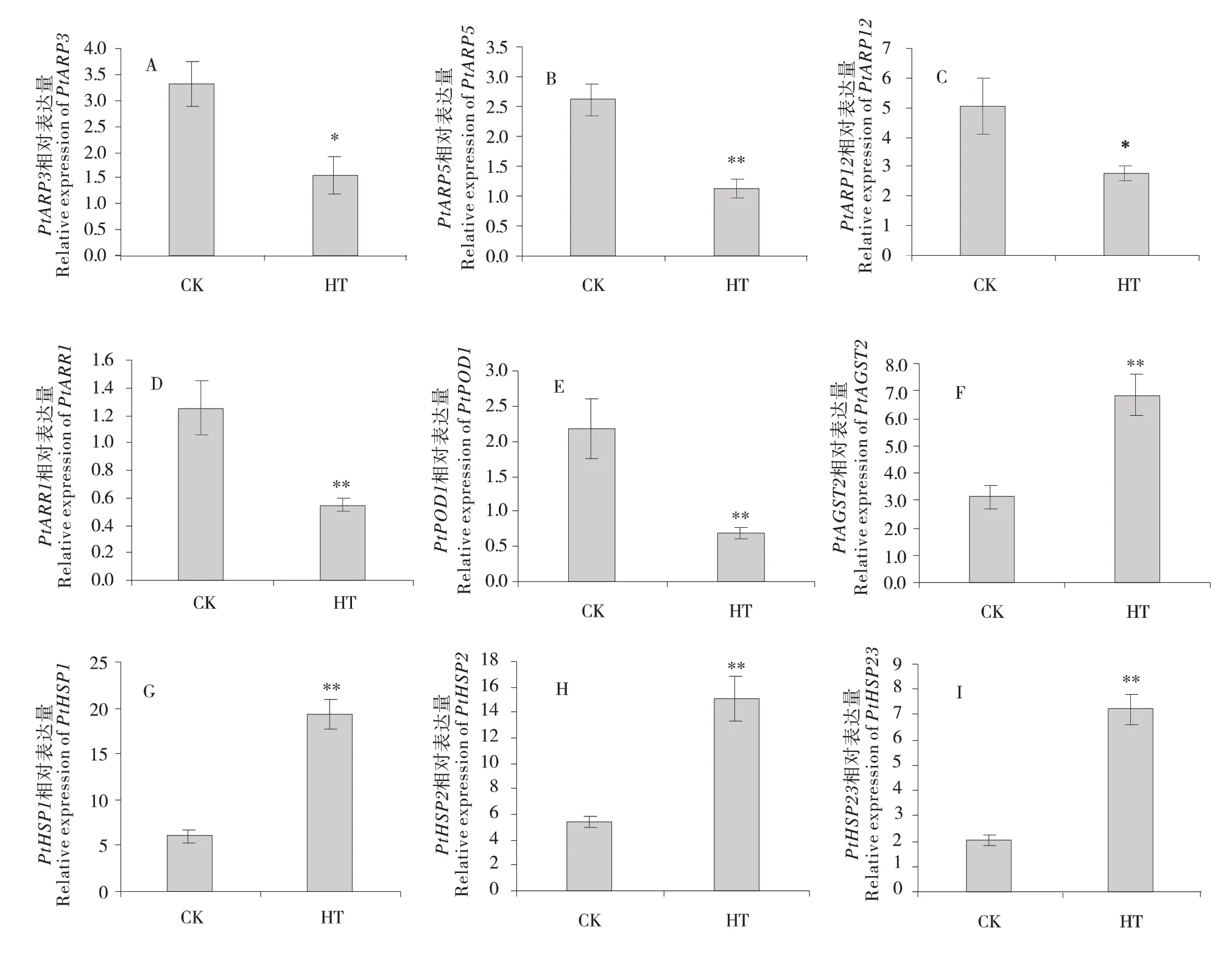
图6 高温胁迫下DEGs的qRT-PCR分析Figure 6 qRT-PCR analysis of DEGs under high temperature stress
近年来,随着全球气候变暖加剧,短期或长期极端高温天气频发,给植物的产量造成严重的影响。高温胁迫会改变植物形态、生理生化过程和基因表达,阻碍植物的正常生长发育,提高植物耐热性已成为研究热点。半夏的生长发育极易受到高温的伤害,在生长发育的关键时期,高温胁迫会导致半夏地上部分倒苗,严重影响半夏的产量积累。薛建平等[18]研究发现,随着高温胁迫时间的延长,半夏叶片、叶柄和块茎中的SOD和POD活性逐渐下降,叶片和叶柄中的MDA含量显著增加。因此,进一步阐明半夏响应高温胁迫的生物学机制,对于提高半夏的耐热性具有重要的指导作用。本研究通过Illu⁃mina高通量测序技术对38℃高温胁迫处理的半夏叶片进行转录组分析,样本平均数据量为6.41 Gb,经Trinity软件组装获得91 526条Unigene,平均长度899 bp,N50平均长度1 214 bp。半夏经高温胁迫后共有1 716个DEGs差异表达,其中表达水平上调1 138个,下调578个。qRT-PCR分析表明9个DEGs在高温胁迫下表达量变化趋势与转录组结果基本一致,进一步验证了转录组数据的可靠性。
GO功能注释分析表明高温胁迫下DEGs主要集中在转录因子复合体、内肽酶活性、血红素结合和四吡咯结合。转录组因子是一类能够以序列特异性方式结合真核基因启动子区域并且调节转录的蛋白质,在植物逆境胁迫中起着重要作用,当植物遭受高温、干旱等逆境胁迫时,通过激活基因的转录表达来调节植物对逆境胁迫信号的反应。在拟南芥Arabi⁃dopsisthaliana中,提高转录因子CBF1和CBF4的表达量可以激活冷胁迫相关基因的表达,并提高拟南芥的耐冷性[19-20]。在番茄Solanum lycopersicum中,过表达热激转录因子HsfA1可提高番茄的耐热性[21]。在GO分析中,富集DEGs最多的是转录因子复合体,说明高温胁迫后半夏叶片中大量转录因子被激活,并通过诱导高温胁迫基因的表达来调节半夏对高温胁迫的应答。内肽酶是蛋白水解酶的一种,参与植物衰老、生物胁迫和非生物胁迫等生命活动。高温胁迫下,内肽酶活性富集了较多的DEGs,表明高温胁迫导致了半夏叶片内蛋白质代谢紊乱。KEGG代谢通路分析发现富集DEGs最多的代谢途径是内质网蛋白质加工。内质网对蛋白质的加工主要包括糖基化、羟基化、酰基化和二硫键形成等,其中最主要的加工是糖基化,绝大部分内质网上合成的蛋白质都会被糖基化,蛋白质经过糖基化作用才能进行信号传导和正确折叠。本研究中,内质网蛋白质加工代谢途径富集了的DEGs最多,说明该代谢途径在半夏响应高温胁迫的过程中起着重要作用[22-23]。
高温胁迫可引起植物体内激素含量和活性的变化,从而提高对逆境的抵抗或适应能力。半夏转录组DEGs注释结果表明,生长素应答蛋白基因的表达受到高温胁迫的双向调控,其中表达水平下调的生长素应答蛋白DEGs明显多于表达上调的DEGs。同时,高温胁迫还促进了赤霉素调控蛋白基因Pt⁃GRP1和脱落酸应答元件结合因子基因PtABF的表达。研究表明,脱落酸应答元件结合因子ABF是一种bZIP转录因子,具有转录激活活性,参与植物非生物胁迫应答和脱落酸信号转导,水稻Oryza sativa OsABF1/OsbZIP12受盐、干旱和脱落酸等非生物胁迫诱导,上调其表达量可增加水稻的耐旱性[22-23]。本研究中,PtABF的表达量上调可能有助于提高半夏对高温胁迫的抗性。
植物遭受逆境胁迫的主要特征是活性氧代谢的失调。高温胁迫会导致植物细胞内活性氧大量积累,而酶促防御系统(包括超氧化物歧化酶、过氧化物酶、过氧化氢酶和谷胱甘肽过氧化物酶等)通过清除活性氧,减轻高温造成的细胞膜和蛋白质损伤,增加对高温胁迫的抗性。本研究中,7个谷胱甘肽S转移酶基因PtGST的表达量在高温胁迫胁迫下显著增加,表明半夏通过谷胱甘肽S转移酶清除高温胁迫产生的活性氧和调控谷胱甘肽的代谢,以减轻高温造成的损伤。
研究表明,高温下植物产生的热激蛋白HSPs可提高植物耐热性,保护机体蛋白质免遭损伤或修复已受损伤的蛋白质,从而对植物起保护作用,并在维持内环境稳态和抵御逆境胁迫等方面具有重要作用[24]。在拟南芥中,过表达百合Lilium lancifolium LlHSP70基因可提高转基因拟南芥对高温的耐受性[25]。在拟南芥中过表达菊花Chrysanthemum HSP70基因可提高拟南芥对高温、干旱和盐胁迫的抗性[26]。本研究表明,半夏经高温胁迫后叶片中27个PtHSP表达水平显著上调,且PtHSP1、PtHSP3、
PtHSP4、PtHSP7、PtHSP9、PtHSP11、PtHSP13、PtHSP19、PtHSP20、PtHSP21、PtHSP22和PtHSP23在高温处理后表达量上调3倍以上,说明PtHSP基因能迅速响应高温胁迫,以维持半夏叶片细胞的正常生理功能。综上,通过对高温胁迫后的半夏叶片进行高通量转录组测序分析,挖掘到植物激素信号转导、氧化还原系统和热激蛋白等候选基因,为培育半夏耐热品种提供基因资源,也为一步深入研究高温影响半夏的分子机制提供理论依据。
猜你喜欢 半夏测序高温 高温干旱持续 农作物亟须“防护伞”今日农业(2022年16期)2022-11-09两种高通量测序平台应用于不同SARS-CoV-2变异株的对比研究中国人兽共患病学报(2022年9期)2022-10-19高温季蔬菜要如此培“根”固本今日农业(2022年15期)2022-09-20全球高温环球时报(2022-06-20)2022-06-20不同温度对半夏倒苗的影响云南农业科技(2021年6期)2021-12-30第四代核电 高温气冷堆中国核电(2021年3期)2021-08-13生物测序走在前科学导报(2021年29期)2021-06-03外显子组测序助力产前诊断胎儿骨骼发育不良中国生殖健康(2020年4期)2021-01-18半夏入药多炮制农村百事通(2019年8期)2019-05-13基因测序技术研究进展科海故事博览·下旬刊(2019年6期)2019-04-16推荐访问:半夏 组分 转录