miR-125a-3p靶向作用P2RX7抑制糖尿病肾病小鼠肾纤维化发展
来源:优秀文章 发布时间:2023-01-26 点击:
蒋伟, 郑东辉, 李海伦, 徐永
(徐州医科大学附属淮安医院肾脏内科,江苏省淮安市 223002)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最主要的并发症之一,DN病程中晚期糖基化终末产物(advanced glycation end-products,AGE)蓄积激活体内活性氧,导致肾组织脂质过氧化、炎症反应和促纤维化因子产生,进而促进肾纤维化进程从而影响肾脏的正常功能[1],目前关于肾纤维化的分子机制仍不清楚。miR-125a-3p是近年新发现的纤维化相关微小RNA(microRNA,miRNA),体外研究显示miR-125a-3p可调控成纤维细胞增殖和细胞外基质累积[2]。也有研究显示DN发生后miR-125a-3p降低,进而参与DN视网膜病变[3],提示miR-125a-3p可能参与DN肾纤维化,但其调节机制仍不清楚。P2RX7是一种ATP门控离子通道,参与调节免疫、炎症和肿瘤的进展,研究表明P2RX7药理学抑制可缓解肝组织纤维化[4],P2RX7对DN肾纤维化的机制仍不清楚。因此,本文探讨miR-125a-3p靶向作用P2RX7对DN小鼠肾纤维化发展的影响。
1.1 主要实验材料
C57BL/6小鼠(SPF级,雄性,6周龄,20~25 g)。ELISA试剂盒、HE染色试剂盒、Masson染色试剂盒(碧云天公司,中国)。P2RX7质粒、miR-125a-3p类似物(mimic)及阴性对照(negative control,NC)(吉玛公司,中国)。TRIzol和mirNeasy mini试剂盒(QIAGEN GmbH公司,德国)。SYBR Premix Ex TaqTM试剂盒(TaKaRa公司,日本)。PCR仪(ABI7900,ABI公司,美国)。P2RX7一抗(ab48871)、胶原蛋白I(collagen I,Col-I)一抗(ab255809)和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(ab40854)一抗(Abcam公司,美国)。ECL显色试剂盒和Nanodrop 2000仪器(Thermo Fisher公司,美国)。肾胚细胞(ATCC公司,美国)。突变试剂盒和Renilla荧光素酶(Beyotime公司,中国)。荧光素酶试剂盒(Promega公司,美国)。
1.2 小鼠建模和分组干预
60只C57BL/6小鼠随机均分为对照组、模型组、miR-125a-3p NC组和miR-125a-3p mimic组。除对照组外,其他小鼠参考文献[5]高糖高脂配合STZ诱导构建DN小鼠模型,小鼠尾静脉空腹血糖>16.65 mmol/L、尿量>对照组50%提示建模成功。建模后miR-125a-3p NC组和miR-125a-3p mimic组DN小鼠分别腹腔注射miR-125a-3p NC或miR-125a-3p mimic(300 μg,每周2次)[6];
对照组和模型组注射等量生理盐水为对照。8周后,收集小鼠尾静脉血,安乐死小鼠收集肾组织。
1.3 qRT-PCR检测miR-125a-3p表达
使用TRIzol试剂从肾组织中提取总RNA,Nanodrop 2000进行定量。使用mirNeasy Mini试剂盒将miRNA进行反转录,使用SYBR Premix Ex TaqTM进行qRT-PCR反应:95 ℃ 2 min,58 ℃20 s, 72 ℃ 20 s(40个循环),以U6为内参,使用2-ΔΔCt法计算miR-125a-3p相对表达水平。
1.4 Western blotting检测P2RX7、Col-I、α-SMA蛋白
肾组织裂解后离心(4 ℃,12 000 r/min,5 min)收集总蛋白。10%SDS-PAGE分离40 μg蛋白,转移到硝酸纤维素膜上。加入5%脱脂牛奶(室温,2 h)封闭后加入抗-P2RX7、抗-Col-I、抗-α-SMA(1∶800,4 ℃,8 h),洗涤后加入二抗(1∶2 000,室温,1 h)。条带用ECL可视化处理,GAPDH为内参,计算P2RX7、Col-I、α-SMA蛋白的相对表达量。
1.5 ELISA检测血肌酐和血尿素氮
取小鼠尾静脉血,半径8 cm 3 000 r/min离心15 min,收集上清,分别加入抗体和显色剂,终止显色反应后15 min内检测光密度(450 nm),根据标准曲线计算肾功能指标血肌酐(creatinine,Cr)和血尿素氮(blood urea nitrogen,BUN)水平。
1.6 HE染色观察肾脏病理改变
肾组织用10%甲醛溶液固定48 h,流水冲洗。梯度乙醇脱水,然后将组织浸入蜡中,切5 μm厚度。载玻片65 ℃恒温烘箱中30 min。脱蜡水化后染色。细胞核用苏木精染色5 min,细胞质用伊红染色1~2 min。染色切片用乙醇脱水并在显微镜下观察拍照。
1.7 Masson染色检测肾纤维化
将1.6切片标本加入Masson三色染料染色,根据试剂盒说明书方法操作,显微镜下观察并拍照,利用IPP 6.0图像分析系统计算胶原蛋白体积分数(collagen volume fraction,CVF)。
1.8 双荧光素酶检测miR-125a-3p与P2RX7靶向关系
通过Starbase网站得到miR-125a-3p与P2RX7的碱基结合位点。根据其原始序列,将P2RX7的3′端非翻译区域(3′-untranslated region,3′-UTR)负载于pGL4荧光素酶载体上作为野生型(WT-)P2RX7;
利用突变试剂盒生成突变型(MUT-)P2RX7。根据上述转染方法,分别将1 μg WT-/MUT-P2RX7及50 nmol/L miR-125a-3p mimic/ NC质粒转染1×104个人胚胎肾干细胞(HEK293)中。36 h后根据Renilla计算细胞荧光素酶活性。
1.9 统计学处理
2.1 各组miR-125a-3p和P2RX7蛋白表达水平的比较
与对照组比较,其他3组P2RX7蛋白表达升高,miR-125a-3p表达降低(P<0.05);
与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;
图1和表1)。

图1 各组P2RX7蛋白表达水平的比较1为对照组;
2为模型组;
3为miR-125a-3p NC组;
4为miR-125a-3p mimic组。

表1 各组小鼠肾组织P2RX7蛋白和miR-125a-3p表达的比较(n=15)
2.2 miR-125a-3p对肾功能指标的影响
与对照组比较,其他3组Cr和BUN水平均升高(P<0.05);
与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;
表2)。

表2 miR-125a-3p对DN小鼠肾功能指标的影响(n=15)
2.3 miR-125a-3p对肾组织病理学改变的影响
对照组细胞排列规则,肾小球和肾小管结构完整;
模型组和miR-125a-3p NC组肾小管出现明显萎缩和紊乱,并出现细胞外基质累积和炎性浸润;
miR-125a-3p mimic组可观察到基础的肾小管和肾小球结构,组织损伤程度较模型组和miR-125a-3p NC组轻(图2)。

图2 miR-125a-3p对DN小鼠肾组织病理学改变的影响(HE染色,40×)
2.4 miR-125a-3p对CVF的影响
对照组着色均匀,无明显蓝色胶原纤维,提示肾组织正常,灰蓝色或灰色为纤维化组织和胶原蛋白。模型组和miR-125a-3p NC组出现明显蓝色胶原纤维,提示肾组织异常;
而miR-125a-3p mimic组出现少量蓝色胶原纤维,较模型组和miR-125a-3p NC组少,提示肾组织部分异常。与对照组比较,模型组和miR-125a-3p NC组CVF均升高(P<0.05);
与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;
图3)。
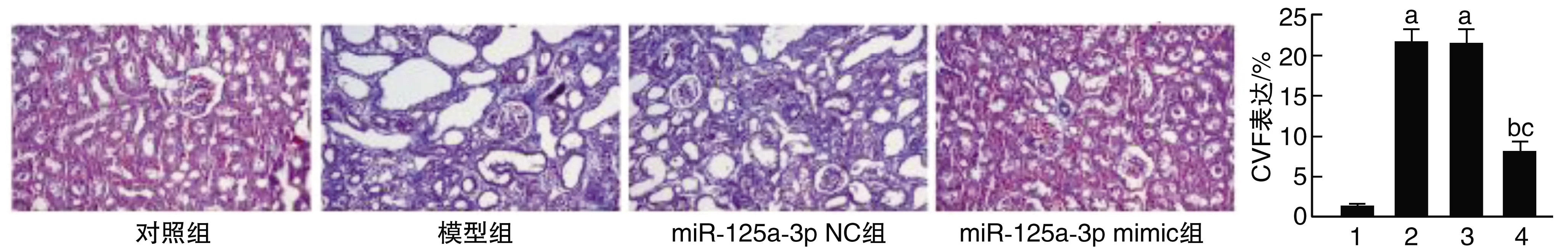
图3 miR-125a-3p对DN小鼠肾组织纤维化的影响(Masson染色,40×)1为对照组;
2为模型组;
3为miR-125a-3p NC组;
4为miR-125a-3p mimic组。a为P<0.05,与对照组比较;
b为P<0.05,与模型组比较;
c为P<0.05,与miR-125a-3p NC组比较。
2.5 miR-125a-3p对Col-I和α-SMA蛋白水平的影响
与对照组比较,模型组和miR-125a-3p NC组Col-I和α-SMA蛋白水平升高(P<0.05);
与模型组和miR-125a-3p NC组比较,miR-125a-3p mimic组上述趋势得到逆转(P<0.05;
图4)。

图4 Western blotting检测miR-125a-3p对DN小鼠Col-I和α-SMA蛋白水平的影响1为对照组;
2为模型组;
3为miR-125a-3p NC组;
4为miR-125a-3p mimic组。a为P<0.05,与对照组比较;
b为P<0.05,与模型组比较;
c为P<0.05,与miR-125a-3p NC组比较。
2.6 miR-125a-3p对P2RX7的靶向作用
miR-125a-3p与P2RX7存在靶向结合位点,转染MUT-P2RX7和miR-125a-3p mimic后,细胞中相对荧光素酶活性降低(P<0.05;
图5),证明miR-125a-3p与P2RX7靶向结合。

图5 miR-125a-3p对P2RX7的靶向调节作用A为miR-125a-3p与P2RX7结合位点;
B为荧光素酶活性柱状图。a为P<0.05,与miR-125a-3p NC组比较;
b为P<0.05,与MUT-P2RX7比较。
糖尿病肾病(diabetic nephropathy,DN) 典型的病理改变为肾小球及肾小管基底膜增厚、肾小管间质纤维化等。若其纤维化得不到有效控制,则会发展为肾小球硬化和肾间质纤维化,甚至终末期肾功能衰竭[7]。
miRNA可通过碱基配对识别并结合mRNA,进而诱导mRNA的降解或者抑制翻译[8]。miR-125a-3p是近年来新发现的与糖尿病和纤维化相关的miRNA,细胞实验结果表明DN会引起miR-125a-3p的水平升高,引起DN相关动脉损伤[9]。miR-125a-3p 通过下调系统性红斑狼疮介导的肾炎小鼠中的TGF-β1表达来抑制肾纤维化[10]。相关研究发现miR-125a-3p可以通过调控STAT3通路缓解成纤维细胞活化,此外,还可以调节自噬参与四氯化碳诱导的小鼠模型肝纤维化[11-12]。为初步分析miR-125a-3p是否参与了DN引起的肾纤维化,本研究成功构建DN模型,并成功促进了肾纤维化,发现肾组织中miR-125a-3p水平降低。为进一步证实miR-125a-3p在DN引起的肾纤维化中的作用,本研究利用miR-125a-3p mimic提高DN小鼠miR-125a-3p水平。本实验结果表明,提高miR-125a-3p水平可显著缓解DN小鼠肾组织损伤,抑制肾纤维化,保护肾功能。本研究在动物水平上证实miR-125a-3p参与了DN诱导的肾纤维化,而提高miR-125a-3p水平可显著缓解纤维化。
P2RX7蛋白是P2X7的受体,通过形成可渗透大分子的膜孔,负责巨噬细胞的ATP依赖性裂解[13]。研究显示,P2RX7的接触抗击可减轻肾脏炎症的早期阶段、间质纤维化,并与输尿管梗阻中的肾细胞增殖有关[14]。也有研究显示,抑制P2RX7通过抑制NLRP3/IL-1β通路而下调Col-I和α-SMA的表达,改善心脏纤维化[15]。Col-I是细胞外基质的主要成分,也是引起纤维化和肾功能障碍的重要蛋白[16]。α-SMA是促进肾上皮细胞转化为肌成纤维细胞的重要蛋白,进而促进纤维化进程[17]。本研究结果显示,在DN纤维化肾组织中,P2RX7水平显著升高,Col-I和α-SMA蛋白升高,而提高miR-125a-3p表达则会恢复P2RX7蛋白的表达水平,并抑制Col-I和α-SMA的表达。此外,双荧光素酶报告实验也验证了miR-125a-3p与P2RX7靶向结合。本研究结果表明,DN会引起肾组织中miR-125a-3p的降低,从而导致P2RX7的过表达,进而导致Col-I和α-SMA蛋白的升高,引起肾纤维化;
而提高miR-125a-3p的水平可通过抑制P2RX7蛋白等的水平抑制纤维化,保护肾功能。
然而,本研究也有一定的局限性,首先,miR-125a-3p与P2RX7的相关性以及在DN引起的肾纤维化的作用仍需要临床研究证实,DN、miR-125a-3p以及P2RX7之间调控的分子机制仍需要进一步分析。
综上所述,miR-125a-3p升高会通过靶向抑制P2RX7蛋白的表达缓解DN引起的肾纤维化,保护肾功能。这提示miR-125a-3p/P2RX7可能是治疗DN肾纤维化的新靶点。
猜你喜欢 荧光素酶纤维化靶向 线粒体自噬在纤维化疾病中作用的研究进展中华实用诊断与治疗杂志(2022年1期)2022-08-31炎性及心肌纤维化相关标志物在心力衰竭中的研究进展中国现代医生(2022年21期)2022-08-22新型抗肿瘤药物:靶向药物中老年保健(2022年1期)2022-08-17肝纤维化无创诊断研究进展传染病信息(2022年3期)2022-07-15如何判断靶向治疗耐药保健医苑(2022年5期)2022-06-10NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21携IL-6单克隆抗体靶向微泡破坏技术在兔MI/RI损伤中的应用昆明医科大学学报(2021年2期)2021-03-29双荧光素酶报告基因系统在家蚕基因启动子研究中的应用广东蚕业(2021年1期)2021-03-18家兔β干扰素启动子质粒的构建及其启动子活性鉴定江苏农业科学(2019年23期)2019-03-03双报告基因标记乳腺癌细胞移植瘤模型的建立及活体成像研究医学信息(2016年29期)2016-11-28推荐访问:靶向 纤维化 小鼠推荐文章
- [高考励志:倒计时冲刺语录] 高考倒计时励志语录
- 2018江苏高考成绩查询入口,点击进入:江苏高考2018成绩查询
- [英语阅读:细数英语中那些出口的汉语]带汉语的英语阅读视频
- 双语阅读:英文吐槽“变凉”的天气_喜剧中心吐槽大会2018
- 2018年福建高考成绩查询网址:http://www.eeafj.cn/:2018福建二建成绩查询
- 小学五年级下册语文阅读理解练习题五道_5年级下册语文书人教版
- 河北教育考试院2018高考查分_福建教育考试院网2018年高考查分系统
- 2018年山西省拟录用公务员公示 [2018年浙江瑞安市各级机关公务员拟录用人员公示(五)]
- 好舌头绕口令 [英语绕口令:挑战你的舌头]
- [2018福建高考成绩什么时候可以查询] 2018中级会计成绩查询