circMTO1调控Wnt/β-catenin抑制乳腺癌细胞增殖和转移能力的机制研究
来源:优秀文章 发布时间:2023-01-24 点击:
苏亚静,吴焕良,敬波,吴灿章
乳腺癌是常见的恶性肿瘤,也是全球女性因癌症死亡的主要原因之一[1]。随着医疗技术的进步,乳腺癌患者的生存率已有了明显的提升,但整体预后情况仍较差[2]。研究显示,腋窝淋巴结转移是乳腺癌患者预后重要影响因素之一[3]。因此,确定乳腺癌转移的潜在分子机制对开发新的治疗靶点非常重要。环状RNA MTO1(circMTO1)是肿瘤相关环状RNA之一。研究显示,circMTO1在包括卵巢癌和肾细胞癌在内的多种肿瘤中低表达,发挥着抑癌基因的作用[4-5]。Chen等[6]研究显示,circMTO1在宫颈癌细胞系和肿瘤组织中表达上调,其可促进宫颈癌细胞迁移和侵袭,增加化疗耐药性,并可抑制肿瘤细胞凋亡。因此,circMTO1在不同肿瘤中发挥的作用可能相反,但鲜见circMTO1与乳腺癌的相关研究。研究表明,circMTO1可通过降低Wnt/β-catenin、转化生长因子-β(TGF-β)/母系DPP同源物以及表皮生长因子受体(EGFR)信号通路活性,抑制结直肠癌和胆囊癌的恶性进展[7-8]。Wnt/β-catenin信号通路的激活可促进乳腺癌的恶性进展,抑制该通路活性有望成为抗肿瘤治疗的新思路[9]。本研究旨在探讨circMTO1与乳腺癌细胞增殖和转移能力的关系及其可能的作用机制。
1.1 材料 乳腺癌细胞系MDA-MB-231、HCC-70、MCF-7和人乳腺正常细胞系MCF-10A购自美国ATCC细胞库;
RPMI 1640培养基、Eagle培养基、胎牛血清、青霉素、链霉素和胰酶购自美国Invitrogen公司;
Trizol、SYBR Premix EX Taq试剂盒和实时荧光定量PCR(qPCR)实验检测试剂盒购自日本TAKARA试剂公司;
氯仿、异丙醇和无水乙醇购自深圳中粤化学有限公司;
逆转录试剂盒购自美国Fermentas公司;
circMTO1过表达和circMTO1敲减质粒购自上海吉玛基因技术有限公司;
MTS试剂购自上海同仁化学技术有限公司产品;
Transwell小室购自北京Solarbio试剂公司;
苏木素和荧光素酶活性检测试剂盒购自上海碧云天生物技术有限公司;
RIPA蛋白裂解液和BCA蛋白质测定试剂盒、Lip2000购自美国Thermo公司;
PVDF膜购自美国Promega公司;
Wnt3a、βcatenin、cMyc、Cyclin D1、基质金属蛋白酶7(MMP7)和GAPDH一抗、HRP偶联的羊抗兔、羊抗鼠二抗购自英国Abcam公司。
1.2 临床样本 选取2018年9月—2020年6月于海南医学院附属儋州市人民医院就诊的102例浸润性乳腺癌患者,收集患者的癌组织及癌旁组织,诊断标准参照2012年《乳腺肿瘤WHO分类》。纳入标准:患者术前未接受化疗、放疗、内分泌或其他任何形式的治疗;
具备手术切除的新鲜肿瘤组织和癌旁组织;
具有完整的临床病理资料。排除标准:合并其他器官肿瘤;
发生远处转移。患者均签署知情同意书。
1.3 研究方法
1.3.1 qPCR检测乳腺癌组织中circMTO1的相对表达水平 使用TRIzol试剂从乳腺癌组织中提取总RNA。采用紫外分光光度仪对RNA样品进行纯度与浓度的检测,光密度(OD)260/280为1.8~2.0。采用逆转录试剂盒在70℃下孵育10 min,室温下以1 000×g离心20 min,采用逆转录试剂盒将细胞总RNA逆转录为cDNA。circMTO1引物:上游5"-GCATCGGAAAGGGACATTTA-3",下游5"-AGCTCTCAGACCCCACACAG-3";
GAPDH引物:上游5"-GTCAACGGATTTGGTCTGTATT-3",下游5"-AGTCTTCTGGGTGGCAGTGAT-3"。反应体系:SYBR Premix EX TaqTM(2×)12.5µL,PCR上、下游引物(10 µmol/L)各0.5 µL,cDNA模板2 µL,dH2O 9.5 µL。热循环条件:45℃逆转录5 min,94℃30 s;
94℃退火5 s、60℃延伸30 s,40个循环,每个样品重复3次。以GAPDH为内参,采用2-ΔΔCt法计算circMTO1的相对表达水平。
1.3.2 乳腺癌细胞培养、分组及转染MDA-MB-231、HCC-70、MCF-7细胞培养在含有100 U/mL青霉素、100 mg/L链霉素和10%胎牛血清的RPMI 1640培养基中;
MCF-10A细胞培养在含有20µg/L EGF、100 U/mL青霉素、100 mg/L链霉素、10%胎牛血清的Eagle培养基中。所有细胞均在37℃、5%CO2及饱和湿度培养箱中培养。每24 h更换1次新鲜培养基,并在细胞密度为90%时,采用胰酶消化细胞进行传代。
参 照1.3.1,采 用qPCR检 测MDA-MB-231、HCC-70、MCF-7和MCF-10A细胞中circMTO1的相对表达量,并选取circMTO1表达量中等的乳腺癌细胞系转染circMTO1过表达和circMTO1敲减质粒。细胞生长状态较好时,胰酶进行消化并计数,以2×105个细胞接种至6孔板中,于37℃、5%CO2及饱和湿度培养箱中培养12 h后,细胞分为NC组、oe-circMTO1组和sh-circMTO1组。采用Lip2000进行转染,其中NC组细胞转染5µg无关序列,oe-circMTO1组细胞转染5µg circMTO1过表达质粒,sh-circMTO1组细胞转染5µg circMTO1敲减质粒,置于37℃、5%CO2及饱和湿度培养箱中培养8 h,更换新鲜培养基,继续培养48 h,参照1.3.1,采用qPCR检测各组细胞circMTO1的相对表达量。
1.3.3 MTS实验检测各组细胞增殖能力 采用胰酶将转染48 h的NC组、oe-circMTO1组和sh-circMTO1组细胞制成单细胞悬液,磷酸盐缓冲液(PBS)洗3次后,加入含10%胎牛血清的培养基,将细胞调至1×104个/mL。取100µL细胞悬液接种于96孔板中,每组设置6个复孔,置于37℃、5%CO2及饱和湿度培养箱中常规培养。在细胞贴壁的第0、24、48和72 h时更换新鲜培养基并加入20µL的MTS试剂,采用全波长自动扫描仪检测490 nm处的OD值。
1.3.4 Transwell实验检测各组细胞转移能力 采用胰酶将转染48 h的NC组、oe-circMTO1组和sh-circMTO1组细胞制成单细胞悬液,无血清培养基洗3次后,加入无血清培养基,将 细 胞 调 至1×106个/mL。取100 µL细 胞 悬 液 接 种 于Transwell小室的上室中,下室中加入500µL添加10%胎牛血清的细胞培养基,每组3个复孔,放置37℃、5%CO2及饱和湿度培养箱中常规培养12 h。无菌棉签轻轻擦去上室表面细胞,PBS洗3次后采用5%戊二醛固定细胞10 min,苏木素染色20 min,PBS洗3次,显微镜下计数各组穿膜的细胞数。
1.3.5 TOP/FOP荧光素酶实验检测各组细胞Wnt/β-catenin信号通路活性 细胞生长状态较好时,胰酶进行消化并计数,以2 000个细胞接种至96孔板,于37℃、5%CO2加湿培养箱中培养12 h,细胞分为NC组、oe-circMTO1组和shcircMTO1组。采用Lip2000进行转染,3组分别转染1µg无关序列、1µg circMTO1过表达质粒和5µg circMTO1敲减质粒,并同时转染1µg TOP/FOP质粒,置于37℃、5%CO2及饱和湿度培养箱中培养8 h,更换新鲜培养基,继续培养48 h,采用双荧光素酶活性检测试剂盒测定各组细胞中荧光素酶活性。
1.3.6 Western blot实验检测各组细胞Wnt/β-catenin信号通路相关蛋白表达 将NC组、oe-circMTO1组和sh-circMTO1组细胞转染48 h后采用预冷的PBS洗涤,加入含有1%蛋白酶抑制剂混合物的蛋白裂解液,在冰上裂解30 min。14 000 r/min离心30 min,裂解细胞,收集细胞蛋白,采用BCA检测试剂盒检测蛋白浓度。取50µg蛋白样品进行聚丙烯酰胺凝胶电泳分离蛋白,并采用常规湿转法将蛋白转移至PVDF膜上,封闭膜后采用一抗Wnt3a(1∶500)、β-catenin(1∶1 000)、cMyc(1∶500)、Cyclin D1(1∶1 000)和MMP7(1∶1 000)4℃孵育过夜,采用羊抗鼠二抗(1∶10 000)37℃孵育1 h,增强型化学发光检测试剂盒进行化学发光显色。采用Image J软件分析,以目的条带蛋白的灰度值和内参GAPDH蛋白的灰度值比值表示目的蛋白的相对表达水平。
1.4 统计学方法 采用SPSS 20.0软件进行数据分析。符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法;
2组间比较采用t检验。P<0.05为差异有统计学意义。
2.1 circMTO1在乳腺癌组织中的相对表达量 与癌旁组织(1.04±0.35)相比,circMTO1在乳腺癌组织(0.87±0.29)中的相对表达水平降低(n=102,t=3.777,P<0.05)。
2.2 circMTO1相对表达量与乳腺癌患者临床病理参数的关系 不同年龄、肿瘤大小、组织分级以及雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体-2(HER-2)阴、阳性表达乳腺癌患者的circMTO1相对表达水平差异无统计学意义。有淋巴结转移和TNM分期为Ⅲ期的乳腺癌患者组织中circMTO1的相对表达水平较低(P<0.01),见表1。
Tab.1 Comparison of circMTO1 expression in the breast cancer tissue of patients with different clinical pathological parameters表1不同临床病理参数患者乳腺癌组织中circMTO1表达量比较 (±s)

Tab.1 Comparison of circMTO1 expression in the breast cancer tissue of patients with different clinical pathological parameters表1不同临床病理参数患者乳腺癌组织中circMTO1表达量比较 (±s)
**P<0.01。
临床参数年龄(岁)≤60>60肿瘤大小(cm)≤2>2组织分级Ⅰ-ⅡⅢ淋巴结转移有无TNM分期Ⅰ-ⅡⅢER阳性阴性PR阳性阴性HER-2阳性阴性n 72 30 43 59 38 64 58 44 42 60 32 70 35 67 61 41 circMTO1相对表达量0.89±0.33 0.82±0.24 0.93±0.34 0.83±0.24 0.91±032 0.85±0.27 0.78±0.26 0.99±0.35 1.00±0.34 0.78±0.25 0.84±0.26 0.88±0.30 0.81±0.26 0.90±0.31 0.84±0.27 0.92±0.31 t 1.051 1.172 1.012 3.478**3.767**0.650 1.468 1.382
2.3 circMTO1在乳腺癌细胞系中的相对表达水平circMTO1在乳腺癌细胞系MDA-MB-231、HCC-70、MCF-7和人正常乳腺细胞系MCF-10A中的相对表达水平分别为0.86±0.07、3.27±0.45、2.29±0.42和5.48±0.73(n=3,F=49.327,P<0.01),与正常乳腺细胞系MCF-10A相比,circMTO1在乳腺癌细胞中的表达均降低(P<0.05)。选取MCF-7细胞进行后续实验。
2.4 各组细胞中circMTO1的相对表达水平比较 与NC组相比,oe-circMTO1组细胞中circMTO1相对表达水平增加,穿膜细胞数和Wnt/β-catenin信号通路活性减弱(P<0.05),sh-circMTO1组细胞中circMTO1相对表达水平降低,穿膜细胞数和Wnt/βcatenin信号通路活性增强(P<0.05),见表2,图1。
Tab.2 Comparison of relative expression level,metastasis and Wnt/β-catenin of catenin signaling pathway between the three groups of cells表2各组细胞中circMTO1相对表达水平、转移情况和Wnt/β-catenin信号通路活性的比较 (±s)

Tab.2 Comparison of relative expression level,metastasis and Wnt/β-catenin of catenin signaling pathway between the three groups of cells表2各组细胞中circMTO1相对表达水平、转移情况和Wnt/β-catenin信号通路活性的比较 (±s)
**P<0.01;
a与NC组比较,b与oe-circMTO1组比较,P<0.05。
组别NC组oe-circMTO1组sh-circMTO1组F n 333 circMTO1相对表达水平1.01±0.02 3.57±0.55a 0.41±0.11ab 80.472**穿膜细胞数(个/视野)69.33±6.81 32.67±4.25a 98.33±5.34ab 104.829**TOP/FOP荧光素酶活性0.97±0.03 0.49±0.03a 1.69±0.12ab 202.667**

Fig.1 Effect of circMTO1 on breast cancer cell metastasis detected by Transwell experiment(Hematoxylin staining,×200)图1 circMTO1对乳腺癌细胞转移能力的Transwell实验检测结果(苏木素染色,×200)
2.5 各组细胞增殖能力比较 与NC组相比,在48 h、72 h时,oe-circMTO1组MCF-7细胞增殖能力降低,sh-circMTO1组MCF-7细胞增殖能力增加(P<0.05),见图2。
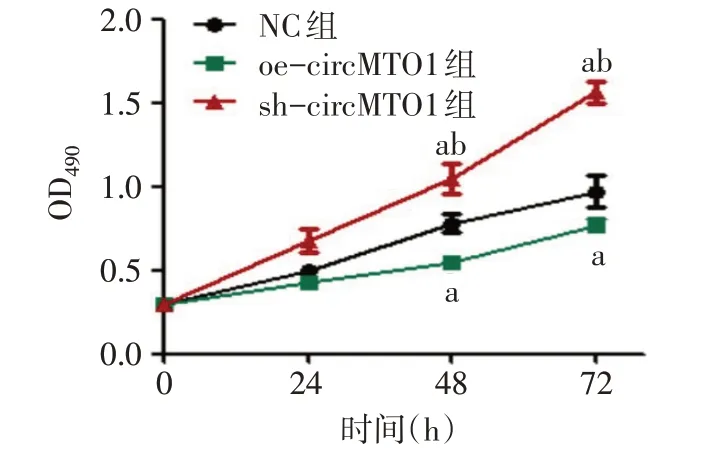
Fig.2 MTS detection of the effect of circMTO1 on the proliferation of breast cancer cells in each group图2 MTS检测circMTO1对各组乳腺癌细胞增殖能力的影响
2.6 各组Wnt/β-catenin信号通路相关蛋白表达水平比较 与NC组相比,oe-circMTO1组Wnt3a、βcatenin、cMyc、Cyclin D1和MMP7蛋白相对表达水平降低,而sh-circMTO1组各蛋白相对表达水平增加(均P<0.05),见图3、表3。

Fig.3 Effects of circMTO1 on proteins related to Wnt/β-catenin signaling pathway in breast cancer cells图3 circMTO1对乳腺癌细胞Wnt/β-catenin信号通路相关蛋白的影响
Tab.3 Comparison of Wnt/β-catenin signaling pathwayrelated protein expressions between the three groups of cells表3各组细胞中Wnt/β-catenin信号通路相关蛋白相对表达水平的比较 (n=3,±s)

Tab.3 Comparison of Wnt/β-catenin signaling pathwayrelated protein expressions between the three groups of cells表3各组细胞中Wnt/β-catenin信号通路相关蛋白相对表达水平的比较 (n=3,±s)
**P<0.01;
a与NC组比较,b与oe-circMTO1组比较,P<0.05。
组别NC组oe-circMTO1组sh-circMTO1组F cMyc 0.52±0.02 0.17±0.02a 1.47±0.20ab 99.816**Cyclin D1 0.64±0.05 0.28±0.02a 1.89±0.11ab 428.420**MMP7 0.45±0.06 0.33±0.03a 1.97±0.18ab 203.837**组别NC组oe-circMTO1组sh-circMTO1组F Wnt3a 0.42±0.04 0.15±0.02a 1.02±0.09ab 176.703**β-catenin 0.48±0.05 0.19±0.03a 1.56±0.18ab 131.036**
乳腺癌的发生、发展是一个复杂的过程,涉及多种调节因子和信号途径。circRNA是新近发现的非编码RNA,为一个连续的共价闭环结构。circRNA在细胞功能调节、神经退行性疾病的发展和心脏病的发病机制中发挥着关键作用[10]。越来越多的证据表明,circRNA可作为肿瘤抑制基因或致癌基因,并参与调节各种肿瘤的恶性生物学行为,包括细胞的分化、增殖、转移和化学敏感性等[11]。乳腺癌中异常表达的circRNA也被逐渐发现,有望作为乳腺癌诊断、治疗及预后判断的分子标志物[12]。
circMTO1最 初 由Han等[13]在 肝 细 胞 癌 环 状RNA的表达谱中发现,circMTO1在肝细胞癌组织中呈异常低表达,且circMTO1低表达患者的预后较差。本研究结果显示,circMTO1在乳腺癌组织中表达较癌旁组织显著下调,且circMTO1低表达与乳腺癌患者淋巴结转移和TNM分期为Ⅲ期有关,表明circMTO1可能抑制乳腺癌的恶性进展,提示circMTO1在乳腺癌中发挥着抑癌因子的作用,这与其在肝癌中发挥的作用一致[13]。与正常乳腺细胞系相比,circMTO1在乳腺癌细胞中的表达降低,这与在组织中的检测水平一致。circMTO1在卵巢癌和肾细胞癌中也发挥着抑癌因子的作用[4-5]。另外,本研究发现,过表达circMTO1具有抑制乳腺癌细胞增殖和转移能力,敲减circMTO1后则可促进乳腺癌细胞的增殖和转移,提示circMTO1可抑制乳腺癌细胞的恶性进展。
目前,circMTO1在乳腺癌中的作用机制尚不完全清楚。相关研究显示,在结直肠癌中,circMTO1通过抑制Wnt/β-catenin信号通路活性,从而降低癌细胞的增殖和侵袭能力[7]。Wnt/β-catenin信号通路可调控肿瘤增殖、侵袭、转移、凋亡和化疗耐药等多种生物学过程[14]。本研究结果显示,过表达circMTO1显著抑制乳腺癌细胞中Wnt/β-catenin信号通路的活性,敲减circMTO1后乳腺癌细胞中Wnt/β-catenin信号通路的活性增加,提示circMTO1可抑制乳腺癌细胞中Wnt/β-catenin信号通路的活性。在正常生理状态下,β-catenin破坏复合体抑制βcatenin蛋白的积累,Wnt/β-catenin信号通路处于失活状态,在肿瘤细胞中,Wnt配体存在时,β-catenin破坏复合体被降解,β-catenin蛋白积累并异位至核内,促使Wnt/β-catenin信号通路下游靶基因激活,发挥相应的生物学功能[15-16]。本研究结果显示,过表达circMTO1显著抑制乳腺癌细胞中Wnt/βcatenin信号通路下游增殖蛋白cMyc、Cyclin D1和下游转移蛋白MMP7的表达,敲减circMTO1则反之,表明circMTO1通过抑制Wnt/β-catenin信号通路活性,从而抑制乳腺癌细胞增殖和转移能力。
综上所述,circMTO1在乳腺癌组织和细胞中表达降低,且circMTO1具有抑制乳腺癌细胞增殖和转移能力,抑制Wnt/β-catenin信号通路活性可能是其重要的作用机制之一。circMTO1具有作为乳腺癌治疗分子靶标的潜力。
猜你喜欢 细胞系试剂盒培养基 6种非洲猪瘟荧光PCR试剂盒对比试验湖南畜牧兽医(2021年6期)2022-01-24动物细胞培养技术研究现状与思考科学与生活(2021年16期)2021-11-25农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-304种非洲猪瘟核酸检测试剂盒性能比较分析猪业科学(2021年5期)2021-06-02两种小反刍兽疫病毒检测试剂盒的比较分析中国畜禽种业(2021年4期)2021-05-21食品微生物检验中培养基的质量控制探讨食品安全导刊(2020年21期)2020-12-03食品微生物检验中培养基的质量控制食品安全导刊(2020年18期)2020-12-03双牌虎爪姜快速繁殖的培养基筛选湖南农业科学(2020年1期)2020-04-18叶酸受体-α、Legumain在视网膜母细胞瘤细胞系的表达实验研究医学研究杂志(2015年9期)2015-07-01多细胞系胞质分裂阻滞微核细胞组学试验法的建立与应用癌变·畸变·突变(2015年4期)2015-02-27推荐访问:增殖 癌细胞 乳腺推荐文章
- 【想移民荷兰的朋友看过来,告诉你定居荷兰是一种怎样的生活体验】荷兰移民需要什么条件
- [关于训练口才的经典句子]训练口才的经典句子
- 【加拿大留学金融系专业排名】 加拿大留学专业排名
- 2018年四川省人民医院神经外科临床医师编外人员招聘公告 2018年神经外科年会
- 2018安徽高考志愿填报及征集志愿时间安排:2018高考志愿填报征集志愿时间
- 行政前台工作计划表_行政前台工作计划怎么写
- 和女朋友表白感人的话_和女朋友表白的句子
- 【英语语法:the,fact,that的语法功能】 in fact等于什么
- [2018入党培训心得体会范文2000字【三篇】]入党积极分子思想汇报
- 2018年中级审计师考试试题每日一练(6.14)|审计师报名时间2018