组蛋白去乙酰化酶抑制剂LBH589,抑制基底样乳腺癌生长和转移
来源:优秀文章 发布时间:2023-01-23 点击:
庄慧萍
(天津医科大学肿瘤医院肿瘤研究所生物化学与分子生物学研究室;
国家肿瘤临床医学研究中心;
天津市“肿瘤防治”重点实验室;
天津市恶性肿瘤临床医学研究中心;
乳腺癌防治教育部重点实验室,天津 300060)
基底样乳腺癌(basal-like breast cancer,BLBC)是恶性程度较高的乳腺癌亚型,易发生远处转移,死亡率较高[1]。BLBC 由于雌激素受体、孕激素受体及表皮生长因子受体2 表达缺失,在临床中缺乏有效的靶向治疗和内分泌治疗方法,因此寻找新的治疗靶点是迫切需要解决的问题[2]。BLBC 通过上皮-间质转化(epithelial-mesenchymal transition,EMT)的发生获得较强的迁移、侵袭能力。肿瘤的发生、发展是复杂的生物学过程,受多重因素的影响,其中表观遗传调控起着重要作用[3]。组蛋白乙酰化水平是由组蛋白乙酰化酶和组蛋白去乙酰化酶(histone deacetylases,HDACs)共同调节,其中HDACs 的过度表达会导致去乙酰化作用增强,使松弛的核小体变得紧密,影响基因转录,抑制多种肿瘤抑制基因的表达,促进肿瘤的发展[4-5]。研究发现多种HDACs 如HDAC4、HDAC6、HDAC8 等在BLBC 中表达上调[6-7]。
HDAC 抑制剂(histone deacetylaseinhibitors,HDACIs)通过抑制肿瘤细胞中的HDACs,提高细胞的乙酰化水平,激活肿瘤抑制基因的表达[8],在多种癌症中发挥抗肿瘤作用[9-12]。HDACs 属于去乙酰化酶超家族,根据结构同源性分析,共有Ⅰ、Ⅱ、Ⅲ、Ⅳ4 型[13]。根据HDACs 的化学结构和作用靶点,HDACIs 主要包括羟肟酸类、环四肽类、短链脂肪酸和苯酰胺类,其中前三类化合物为广谱性抑制剂,抑制Ⅰ、Ⅱ型家族所有HDACs 亚型,苯酰胺类主要抑制Ⅰ型HDACs 中HDAC1、HDAC2、HDAC3 和部分Ⅱ型HDACs,属于选择性抑制剂[14]。广谱性抑制剂LBH589 属于羟肟酸类,研究显示它在急性髓系白血病[15]、胶质瘤[16]、肺癌[17]和乳腺癌[18]中都有良好的抗肿瘤活性,2015 年经FDA 批准临床应用于治疗多发性骨髓瘤[19]。目前,LBH589 在BLBC 治疗中的研究较少,本研究通过体内外实验探讨LBH589 对BLBC 生长和转移的作用,以期为BLBC 的临床治疗提供依据。
1.1 材料 人乳腺癌细胞系MDA-MB-231 购于美国模式培养物集存库(American type culture collection,ATCC),小鼠乳腺癌细胞系4T1 购于中国科学院上海细胞库;
RPMI-1640 培养基、胎牛血清和青霉素/链霉素购于美国Gibco 公司;
LBH589 购于美国Selleckchem 公司;
Transwell 小室和Matrigel 基质胶购于Corning 公司;
吉姆萨染液购于上海生工生物工程股份有限公司;
β-Actin 抗体购于英国Abcam公司;
CDH1 抗体、VIM 抗体购于美国CST 公司;
FN1 抗体购于美国BD 公司;
山羊抗鼠二抗购于美国CST 公司;
无特定病原体(specific pathogen free,SPF)级雌性Balb/c 小鼠,购于江苏集萃药康生物科技公司。
1.2 方法
1.2.1 细胞培养及处理 MDA-MB-231 和4T1 细胞培养于含有10%胎牛血清和100 μg/mL 青霉素/链霉素的RPMI-1640 培养基。细胞置于37℃、5%CO2的环境下培养。实验所用细胞均为对数生长期细胞。LBH589 溶于二甲亚砜(dimethyl sulfoxide,DMSO),以0.1 μmol/L 的终浓度处理细胞24 h。
1.2.2 增殖实验 MDA-MB-231 和4T1 细胞分别设置对照组(DMSO)和LBH589 给药组(0.1 μmol/L),以5×103个细胞/孔的密度接种于96 孔板,每组6 个复孔,用3-(4,5 二甲基噻唑溴唑-2-基)-2,5-二苯四化铵[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]法测定并比较细胞的增殖能力。在第0、1、2、3 和4 天,分别在每孔加入10 μL MTT(0.5 mg/mL)溶液后在37℃孵育4 h。去除培养基后,每孔加入100 μL DMSO,酶标仪检测波长490 nm处的吸光值,绘制细胞生长曲线。
1.2.3 平板克隆实验 实验分组同1.2.2。分别取对数生长期的MDA-MB-231 和4T1 细胞,用胰酶消化并配制单细胞悬液备用,将细胞悬液作梯度倍数稀释,每组细胞分别以每孔50、100、200 个细胞的梯度密度分别接种6 孔板中,使细胞分散均匀,置于细胞培养箱中培养2~3 周。培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS 小心浸洗2 次,使用4%多聚甲醛固定细胞15 min。然后去固定液,加适量吉姆萨染液染10~30 min,然后用流水缓慢洗去染色液,空气干燥,拍照并计算克隆形成数。
1.2.4 迁移和侵袭实验 实验分组同1.2.2。迁移实验:Transwell 小室放入24 孔板中,下室中加入750 μL含20%血清的RPMI-1640 培养基。用胰酶消化细胞,1 000 r/min 离心5 min,用无血清培养基配制细胞浓度为5×104个/mL 的单细胞悬液,取500 μL 细胞悬液缓慢加入上室并混匀,培养12 h 后观察细胞的迁移情况。侵袭实验:Transwell 小室预先铺Matrigel基质胶,余下步骤同迁移实验。培养24 h 后观察细胞的侵袭情况。迁移和侵袭实验中Transwell 小室分别用棉签擦拭去小室上层的细胞,室温下用4%多聚甲醛固定细胞30 min,用Giemsa 染液对细胞进行染色30 min,室温风干,中性树胶固定封片。显微镜下观察穿过孔的细胞,随机选取5 个视野拍照并计数。
1.2.5 实时荧光定量PCR 实验 实验分组同1.2.2。MDA-MB-231 和4T1 细胞分别接种于6 孔板,使用LBH589 处理24 h 后,收取细胞。提取总RNA 后逆转录合成cDNA,以此为模板进行RT-qPCR。引物序列如表1。
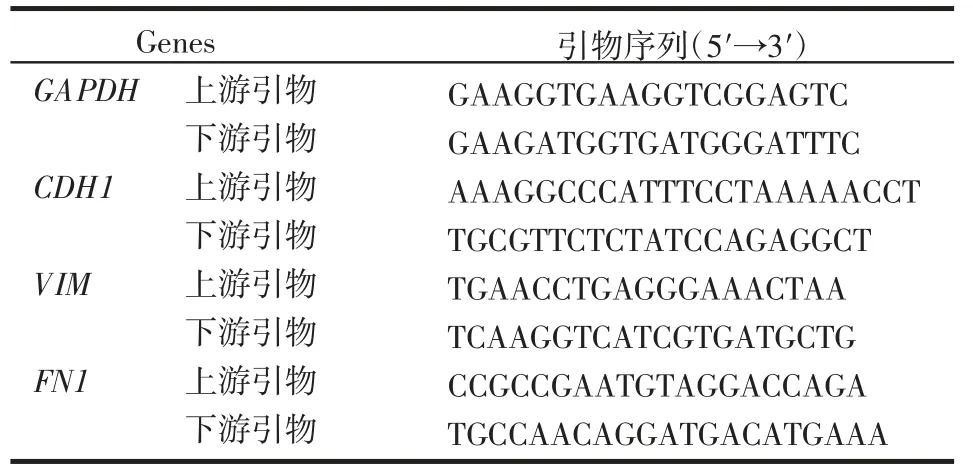
表1 引物序列Tab 1 Primer Sequences
1.2.6 免疫印迹实验 实验分组同1.2.2。MDAMB-231 和4T1 细胞分别接种于6 孔板,使用LBH589处理24 h 后,收取细胞并提取蛋白,检测蛋白浓度。配制SDS-PAGE 凝胶(10%浓缩胶、5%分离胶)、电泳、转膜,使用5%脱脂牛奶封闭1 h 后,分别加入一抗CDH1(1∶1 000)、VIM(1∶1 000)、FIN1(1∶1 000)和内参β-Actin(1∶8 000),4℃孵育过夜,TBST 洗膜后加入对应的二抗(1∶2 000),室温孵育1 h 后TBST 洗膜,加入ECL 反应液进行压片、曝光、显影和定影。
1.2.7 动物实验 4~6 周龄的12 只Balb/c 雌鼠,按照数字表法随机分为两组,每组6 只,将1 × 105个4T1 细胞接种于小鼠乳腺脂肪垫。当小鼠原位瘤体积生长至50~100 mm3时,实验组小鼠腹腔注射LBH589(10 mg/kg),对照组给予同等体积的溶剂(2% DMSO+48% PEG 300+2% Tween 80+ddH2O),每周3 次。每3 天测量原位瘤最长直径(a)和最短直径(b),计算移植瘤的体积(V,mm3)=(1/2)×a×b2。给药4 周后处死并解剖小鼠,取原位瘤组织和肺组织并用甲醛固定,统计原位瘤体积,通过肺组织HE染色观察其病理学变化。
1.3 统计学处理 采用GraphPad Prism 7.0 软件进行数据分析和作图。统计软件进行数据分析。数据符合正态分布,采用单因素方差分析和t 检验进行差异分析,P<0.05 表示差异有统计学意义。
2.1 LBH589 抑制乳腺癌细胞的增殖能力 通过MTT 实验和平板克隆实验检测LBH589 对MDAMB-231 和4T1 细胞增殖作用的影响。实验结果显示,与对照组相比,LBH589 能够显著抑制MDA-MB-231 和4T1 细胞的增殖能力(t=11.37,P<0.05;
t=18.18,P<0.05)和细胞集落形成能力(t=7.76,P<0.05;
t=15.22,P<0.05)(图1)。
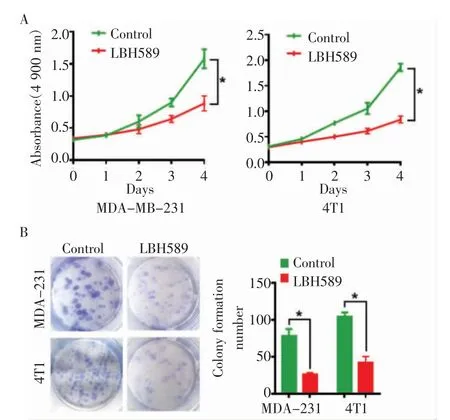
图1 LBH589 抑制乳腺癌细胞的增殖能力Fig 1 The proliferation of breast cancer cells inhibited by LBH589
2.2 LBH589 抑制乳腺癌细胞的迁移和侵袭能力 Transwell 方法检测细胞的迁移和侵袭能力。结果显示,与对照组相比,经LBH589 处理的MDAMB-231 和4T1 细胞迁移(t=8.8,P<0.05;
t=18.0,P<0.05)和侵袭(t=8.24,P<0.05;
t=15.99,P<0.05)能力降低(图2)。

图2 LBH589 抑制乳腺癌细胞的迁移和侵袭能力Fig 2 The migration and invasion of breast cancer cells inhibited by LBH589
2.3 LBH589 抑制乳腺癌细胞的EMT 为了进一步研究LBH589 对乳腺癌细胞转移能力的作用,通过RT-qPCR 和Western 印迹实验检测LBH589 对乳腺癌细胞EMT 标志物CDH1、VIM 和FN1 的影响。结果显示,与对照组相比,LBH589 显著上调CDH1 的mRNA 表达(t=7.33,P<0.05),显著抑制VIM 和FN1的mRNA(t=5.57,P<0.05;
t=6.3,P<0.05)和蛋白(t=8.37,P<0.05;
t=11.3,P<0.05)表达水平(图3)。

图3 LBH589 抑制乳腺癌细胞的EMTFig 3 The EMT in breast cancer cells inhibited by LBH589
2.4 LBH589 抑制小鼠乳腺肿瘤生长及肺转移 通过测量肿瘤体积,绘制肿瘤生长曲线(图4A),结果显示,与对照组相比,LBH589 显著抑制肿瘤生长(P<0.05);
在接种39 d 时通过解剖获得小鼠原位瘤组织(图4B),结果显示,与对照组相比,LBH589 给药组肿瘤体积显著减小(t=6.3,P<0.05);
对解剖获得的肺组织进行HE 染色(图4C),结果显示,LBH589显著抑制小鼠肺转移(P<0.05)。

图4 LBH589 抑制小鼠乳腺肿瘤生长及肺转移Fig 4 The growth and lung metastasis of breast tumor in mice inhibited by LBH589
临床中多采用化疗方法抑制BLBC 患者病情发展,但其耐药率较高,不良反应较多,治疗效果较差[1]。因此,寻找更好的靶向治疗药物是BLBC 治疗的重点。HDAC 等表观遗传修饰异常存在于肿瘤的发展进程中,由于表观遗传修饰具有可逆性,因此可以通过表观遗传抑制剂控制修饰过程,使某些关键抑癌基因恢复功能,从而起到抗肿瘤作用[20]。目前认为HDACIs 主要通过抑制肿瘤细胞增殖、促进细胞凋亡和抑制血管生成等途径发挥抗肿瘤作用[21]。
研究显示LBH589 可以有效抑制与癌症进展有关的HDACs,抑制肿瘤细胞的增殖和转移[22]。Singh等[23]发现LBH589 促进结直肠癌细胞凋亡;
Schmitz等[24]发现LBH589 呈剂量依赖性地促进人和鼠神经内分泌肿瘤细胞周期阻滞和凋亡;
Qin 等[25]发现LBH589 抑制乳腺癌细胞的增殖、迁移和侵袭,促进细胞凋亡,通过构建MDA-MB-231 乳腺癌细胞裸鼠皮下成瘤模型发现LBH589 抑制乳腺癌的生长和转移。Lee 等[26]研究发现LBH589 和DNA 甲基转移酶抑制剂联合使用可以作为乳腺癌的潜在治疗方法。EMT 是指上皮细胞转化为具有间质表型细胞的生物学过程,有助于胚胎发育和组织纤维化,在肿瘤细胞的起始、干细胞的分化以及肿瘤细胞对治疗的抵抗中起着重要的作用[27]。EMT 程序的异常激活与肿瘤进展、转移和治疗性耐药的获得有关[28]。Kai 等[29]研究证实LBH589 联合乳腺癌干细胞(breast cancer stem cells,BCSCs)靶向药物通过诱导细胞凋亡、阻滞细胞周期和调节EMT 发挥抗肿瘤作用。本研究利用4T1 乳腺癌细胞Balb/c 小鼠模型,进一步证实了LBH589 抑制BLBC 的生长和转移,同时体外实验证实了LBH589 抑制BLBC 细胞的增殖,通过抑制细胞的EMT 抑制细胞迁移和侵袭,为BLBC 的临床靶向治疗进一步提供了理论基础。在肿瘤治疗策略中,LBH589 目前已成功应用于多种联合治疗,包括与DNA 甲基转移酶抑制剂[26]和免疫检查点抑制剂[30]等药物联合的应用。随着对LBH589 在BLBC治疗中的作用和机制有更深层次的了解,未来会发现更有效的联合治疗策略,为改进BLBC 治疗带来新的机会。
推荐文章
- [高考励志:倒计时冲刺语录] 高考倒计时励志语录
- 2018江苏高考成绩查询入口,点击进入:江苏高考2018成绩查询
- [英语阅读:细数英语中那些出口的汉语]带汉语的英语阅读视频
- 双语阅读:英文吐槽“变凉”的天气_喜剧中心吐槽大会2018
- 2018年福建高考成绩查询网址:http://www.eeafj.cn/:2018福建二建成绩查询
- 小学五年级下册语文阅读理解练习题五道_5年级下册语文书人教版
- 河北教育考试院2018高考查分_福建教育考试院网2018年高考查分系统
- 2018年山西省拟录用公务员公示 [2018年浙江瑞安市各级机关公务员拟录用人员公示(五)]
- 好舌头绕口令 [英语绕口令:挑战你的舌头]
- [2018福建高考成绩什么时候可以查询] 2018中级会计成绩查询