柠檬皮多酚成分分析及其对胰岛素抵抗HepG2,细胞糖代谢的影响
来源:优秀文章 发布时间:2023-01-21 点击:
王瑞雪,张 筠,崔艳伟,付红岩,房一明,张彦军,初 众,*
(1.中国热带农业科学院香料饮料研究所,海南 万宁 571533;
2.黑龙江东方学院食品工程学院,黑龙江 哈尔滨 150066)
糖尿病(Diabetes Mellitus,DM)是目前临床上面临的主要治疗难题之一,其本质是由于胰岛β细胞损伤或胰岛素抵抗,导致血液中葡萄糖含量较高,通过服用降糖类药物虽能够达到良好的降血糖效果,但通常伴有一些毒副作用,因此寻找天然无毒副作用的的降糖成分成为研究的热点[1]。植物多酚是一大类以羟基苯酚为特征的异质化合物,主要的多酚亚类包括黄酮类、芪类、酚酸类和木质素类,具有抗氧化、抑菌消炎、抗病毒抗肿瘤和降血糖降血脂等功效[2-7]。
柠檬(Citrus limon(L.) Burm. f.)为芸香科柑橘属常绿小乔木,源产于东南亚,截至2020 年全球柠檬产量约为2135 万吨[8]。目前柠檬主要用于鲜食或制作成果汁、果酱等产品,产生经济效益的主要是柠檬果肉,柠檬皮通常作为废料被掩埋处理,由于柠檬果皮中含有丰富的营养成分和水分,掩埋后会滋生大量细菌污染周边水源及土壤,破坏环境的同时其营养成分也未得到充分利用,造成了经济损失和资源浪费[9-10]。目前对于柠檬皮的研究主要停留在对芳香油和果胶的提取上,对其功能性研究不够深入,因此本文探究柠檬皮多酚的成分及其调节糖代谢的功能,为今后开发相关产品提高柠檬整体经济效益提供了理论依据,同时也为柠檬加工废物处理提供了新的方案。
1.1 材料与仪器
香水柠檬 海南省万宁市兴隆热带植物园4 月采摘;
大孔树脂AB-8 天津市光复科技发展有限公司;
甲酸、甲醇、乙腈 色谱纯,德国默克公司;
人肝癌细胞(HepG2)、DMEM 高糖培养基、PBS、0.25%胰蛋白酶-EDTA、青霉素-链霉素(P/S) 苏州美仑生物科技有限公司;
胎牛血清(FBS) 哈尔滨市立峰生物工程有限公司;
二甲基亚砜(DMSO)、MTT、盐酸二甲双胍 北京博奥拓达科技有限公司;
重组人胰岛素(40 IU/mL) 上海碧云天生物技术有限公司;
BCA 蛋白定量/浓度测定试剂盒 大连美仑生物科技有限公司;
葡萄糖测定试剂盒 上海荣盛生物药业有限公司;
糖原试剂盒、丙酮酸激酶(PK)试剂盒、己糖激酶(HK)试剂盒 南京建成生物工程研究所;
G6Pase Elisa 试剂盒、PEPCK Elisa 试剂盒 北京诚林生物科技有限公司。1290 HPLC-G7117B DAD-G6546A QTOF 美国Agilent 公司;
SW-CJ-2FD 净化工作台 上海博迅医疗生物仪器股份有限公司;
HERAcell 150i 二氧化碳培养箱 美国Thermo 公司;
Ts2-FL 倒置显微镜 日本Nikon 公司;
UV-1200 紫外-可见分光光度计 上海美谱达仪器有限公司;
RT-6000 酶标仪深圳雷社生命科学股份有限公司。
1.2 实验方法
1.2.1 柠檬皮多酚的提取和成分分析
1.2.1.1 样品处理及提取 依据黄修晴[11]的方法提取和测定柠檬皮多酚,柠檬去皮,冷冻干燥后粉碎过60 目筛,用70%乙醇按料液比1:60,50 ℃超声提取45 min,5000 r/min 离心10 min,重复提取3 次,合并提取液,50 ℃旋转蒸发至无醇味,将提取物冷冻干燥后配制成500 mL 浓度为3 mg/mL 的上样液,选用AB-8 大孔树脂湿法灌柱,以2 mL/min 的流速吸附,用160 mL 蒸馏水洗去可溶性糖和杂质,使用70%乙醇溶液以1 mL/min 的流速进行洗脱,洗脱液50 ℃旋转蒸发至无醇味,冷冻干燥,得纯度为81.67%的LPP 冻干粉,于-20 ℃密封冷冻保存,取少量柠檬皮多酚溶于甲醇,浓度为1 mg/mL,过0.22 μm 尼龙滤膜用于后续仪器分析。
1.2.1.2 液相条件 色谱柱Agilent EC-C18(2.7 μm,2.1 mm×150 mm),柱温:45 ℃,流速:0.4 mL/min,进样量:1 μL,DAD 检测波长:254 nm、280 nm,波长范围:190~400 nm,流动相A:0.1%甲酸水溶液,流动相B:0.1%甲酸乙腈溶液,以5%流动相A 和95%流动相B 洗脱60 min。
1.2.1.3 质谱条件 选择Agilent Dual AJS ESI 源,进行正离子模式扫描,干燥气温度及流速:300 ℃、5 L/min,雾化器电压:45 psi,鞘气温度及流速:350 ℃、11 L/min,Vcap 电压:3500 V,毛细管出口电压:135 V,MS 扫描范围:100~1700 m/z,MS 扫描速率:4 s。
1.2.2 细胞培养及IR-HepG2 细胞模型建立
1.2.2.1 细胞培养 HepG2 细胞培养基以89%DMEM 培养基+10% FBS+1% P/S 配制,37 ℃、5%CO2培养箱中培养,2~3 d 按1:3 传代[12]。
1.2.2.2 细胞模型建立 取对数生长期细胞,以每孔2×104个细胞接种于98 孔板,待贴壁后,用10-6mol/L的胰岛素作用于HepG2 细胞24 h,建立胰岛素抵抗模型[13-14]。
1.2.3 LPP 对IR-HepG2 细胞葡萄糖消耗量及存活率的影响 参考王梦丽[15]的方法,设空白组(不含细胞)、空白对照组(正常HepG2 细胞)、模型组(IRHepG2 细胞)、阳性对照组(0.05 mg/mL 二甲双胍)以及LPP 样品组(LPP 浓度分别为0.1、0.5、1、1.5、2、2.5 mg/mL 的完全培养基),分别培养24、48、72 h,采用MTT 法[16]测定LPP 干预后IR-HepG2 细胞存活率,用葡萄糖检测试剂盒测定培养液中葡萄糖的含量,根据公式(1)、(2)计算不同浓度的柠檬皮多酚对IR-HepG2 细胞存活率和葡萄糖消耗量的影响。

式中:ΔM 表示葡萄糖消耗量(mmol/L);
m 表示空白组葡萄糖含量(mmol/L);
n 表示样品组葡萄糖含量(mmol/L)。
1.2.4 LPP 对IR-HepG2 细胞糖代谢途径的影响细胞在T25 瓶中培养,设立空白组、空白对照组、模型组、阳性对照组(同1.2.3)和LPP 组(LPP 浓度分别为0.1、0.5、1 mg/mL 的完全培养基),经过建模和给药处理后,弃上清,PBS 清洗2 次,加入1 mL 胰酶消化,培养基终止消化后收集细胞。1000 r/min 离心5 min 弃上清,用PBS 清洗。再离心,弃上清,用1 mL PBS 重悬,冰水浴条件下200 W 超声破碎细胞5 s 一次,重复30 次,之后-4 ℃冷冻离心取上清,-20 ℃保存备用。采用试剂盒测定LPP 对IR-HepG2细胞糖代谢中糖原含量、HK、PK、PEPCCK 和G6Pase 活性的影响。蒽酮法测定糖原含量;
比色法检测HK、PK 活性;
酶联免疫吸附试验(ELISA)检测PEPCCK、G6Pase 活性,具体操作按照试剂盒说明书进行,其含量以蛋白量作为计量单位(参照BCA 试剂盒说明书的方法进行测定),评价LPP 对IR-HepG2 细胞糖代谢的影响。
1.3 数据处理
液质数据用Agilent Mass Hunter Workstation的Qualitative Analysis 10.0 软件进行分析;
细胞试验每组重复5 次,采用Excel 2010、Origin 2019b、SPSS17.0 进行绘图及数据分析,采用Duncans’法进行组间差异显著性分析。
2.1 柠檬皮多酚HPLC-QTOF-MS 结果分析
根据质谱扫描结果对液相色谱的11 个峰进行定性分析,依据样品先经过DAD 检测器再进入质谱检测器的原理,与液相色谱图的保留时间相比总离子流色谱图的保留时间会相对延后,图1 和图2 为正离子扫描模式下的总离子流色谱图与液相色谱图出峰情况,依据液相色谱出峰位置找到相应总离子流色谱图(Total Ion Chromatogram,TIC)出峰位置提取色谱图(Extracted Ion Chromatogram,EIC),获得化合物的分子离子峰(如[M+H]+、[M+Na]+和[M+K]+)信息,根据分子离子峰响应、峰形以及软件自动生成分子式的偏差得到该峰的分子式和母离子,再依据保留时间到MS/MS 上寻找相应的母离子被撞击后形成的子离子,根据丢失的碎片数结合相关文献最终推测出物质的结构。

图1 柠檬皮多酚总离子流色谱图Fig.1 TIC chromatography of lemon peel polyphenols

图2 柠檬皮多酚高效液相色谱图Fig.2 HPLC chromatography of lemon peel polyphenols
具体的多酚化合物分析以峰9(b)为例,图3(A)为峰9(b)的EIC 图,(B)为一级质谱图,(C)为二级质谱图。
从图3(A)和(B)中可以看出该组分在存在[M+H]+、[M+Na]+和[M+K]+峰,响应和峰形良好,其母离子为m/z 611.1974,软件自动生成分子式C28H34O15,计算出[M+H]+理论值为m/z 611.1970,实际值与理论值偏差为0.39,图3(C)为母离子m/z 611.1960 打碎后得到的碎片离子,子离子峰m/z 303 是[M+H-146-162]+得到的,m/z 465 是[M+H-146]+得到的,其中m/z 146 为鼠李糖基(C6H10O4)、m/z 162 为葡萄糖基(C6H10O5),结合软件分析和于国华等[17]的鉴定结果最终推测峰9(b)组分为橙皮苷,通过文献检索比对和软件分析共鉴别出12 种物质,结果见表1。本文仅对LPP 的成分做了初步推测,为了验证推测成分的准确性,后续需进一步做傅里叶红外光谱分析、核磁共振氢谱分析或者购买标准品进行验证试验。

表1 LPP 成分分析结果Table 1 The results of LPP component analysis

图3 峰9(b)的EIC 图(A)、一级质谱图(B)和二级质谱图(C)Fig.3 EIC spectra (A)、MS spectra (B) and MS/MS spectra (C) of peak 9(b)
2.2 LPP 对IR-HepG2 细胞葡萄糖消耗量及存活率的影响
用0.1~2.5 mg/mL 的LPP 分别作用于IR-HepG2细胞24、48、72 h,测定葡萄糖含量,如图4。
由图4 可知,各组葡萄糖消耗量随时间的增加逐渐降低,出现这个趋势的原因极可能是与细胞活性有关,随着培养时间增加,细胞存活率逐渐下降,利用葡萄糖的能力有所下降[25]。模型组的葡萄糖消耗量在各时间段均显著低于空白对照组,说明细胞出现了葡萄糖代谢异常。与模型组相比,阳性对照组和LPP 浓度为0.1~1 mg/mL 时的葡萄糖消耗量在各时间段均显著(P<0.05)高于模型组,且在LPP 浓度为0.5 mg/mL 时葡萄糖消耗量整体达到了峰值,在24 h 时最高(4.78±0.13 mmol/L),比模型组的葡萄糖消耗率提高15.1%。与阳性对照相比在LPP 浓度为0.1~1 mg/mL 时各时段的葡萄糖消耗量与阳性对照差异不显著(P>0.05),说明LPP 在这个浓度范围内与0.05 mg/mL 的二甲双胍改善胰岛素抵抗的能力相近,因此后续试验的浓度设置在0.1~1 mg/mL。
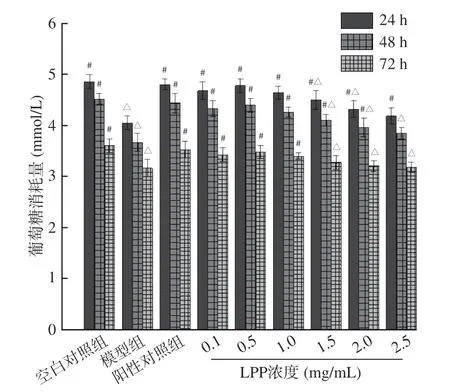
图4 LPP 对IR-HepG2 细胞葡萄糖消耗量的影响Fig.4 Effect of LPP on the glucose consumption of IR-HepG2 cells
用0.1~2.5 mg/mL 的LPP 分别作用于IR-HepG2细胞24、48、72 h,测定细胞存活率,评价LPP 在缓解胰岛素抵抗时对IR-HepG2 细胞活性的影响,探究LPP 的细胞毒性作用,结果见图5。

图5 LPP 对IR-HepG2 细胞存活率的影响Fig.5 Effect of LPP on survival rate of IR-HepG2 cells
从图5 中可以看出,各组细胞存活率均在80%以上,且样品组随LPP 浓度的降低细胞存活率上升,呈现剂量依赖性,说明高浓度的LPP 对IR-HepG2细胞有一定的抑制作用。整体趋势表明24 h 时细胞存活率高于其他时间组,72 h 时细胞存活率最低。24 h 可作为LPP 改善胰岛素抵抗干预的最佳时间,因此后续试验设置培养时间为24 h[26]。
2.3 LPP 对IR-HepG2 细胞糖代谢途径的影响
2.3.1 LPP 对IR-HepG2 细胞糖原含量的影响 人体内糖原主要分为肝糖原和肌糖原,肝脏通过分解、合成肝糖原来调节血糖,维持机体血糖平衡[27]。根据上述试验结果,LPP 组设置浓度为0.1、0.5、1 mg/mL,培养24 h 后,测定LPP 对IR-HepG2 细胞中糖原含量的影响,以此来探究LPP 缓解胰岛素抵抗调节血糖平衡的能力,结果见图6。

图6 LPP 对IR-HepG2 细胞中糖原含量的影响Fig.6 Effect of LPP on the glycogen content in IR-HepG2 cells
由图6 可知,在培养24 h 后,空白对照组的糖原含量最高,模型组糖原含量最低,比空白对照组降低15.2%(P<0.001);
阳性对照组的糖原含量比模型组提高了14.7%(P<0.001),LPP 组的糖原含量均显著(P<0.001)高于模型组,且从0.1 mg/mL 到1 mg/mL分别高了11.6%、14.1%和10.5%;
当LPP 浓度为0.5 mg/mL 时,糖原含量与阳性对照组差异不显著(P>0.05)。该结果表明LPP 在一定浓度范围内能够通过促进IR-HepG2 细胞糖原合成,从而发挥调节血糖的作用。KIM 等[28]和MALGORZATA 等[29]研究发现,绿茶多酚和木瓜多酚通过促进HepG2 细胞糖原合成,调节PEPCK 的表达,从而发挥调节糖代谢的作用,与LPP 调节糖代谢的作用方式一致。
2.3.2 LPP 对IR-HepG2 细胞HK、PK 活性的影响糖酵解是糖在无氧条件下发生的氧化反应,是体内葡萄糖分解代谢的关键途径,催化糖酵解反应的一系列酶都存在于细胞质内,因此催化反应也在细胞质内进行,HK 和PK 是糖酵解中的两个关键限速酶,如果能提高这两个酶的活性就可以降低血糖浓度[30]。图7、图8 为LPP 对IR-HepG2 细胞中HK、PK 活性影响的测定结果。

图7 LPP 对IR-HepG2 细胞中HK 活性的影响Fig.7 Effect of LPP on the activity of HK in IR-HepG2 cells
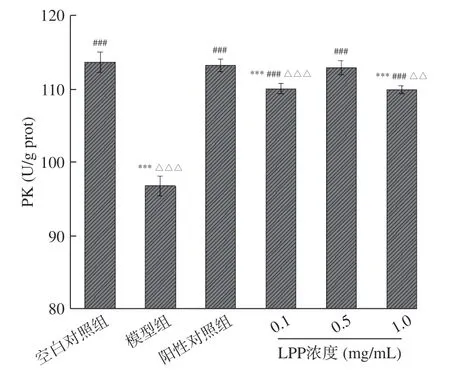
图8 LPP 对IR-HepG2 细胞中PK 活性的影响Fig.8 Effect of LPP on the activity of PK in IR-HepG2 cells
由图7、图8 可知,模型组HK 和PK 的酶活力分 别 为 27.61±0.18 nmol/min/mg prot 和 96.77±1.34 U/g prot,均显著低于空白对照组(P<0.001);
阳性对照组与模型组相比,HK 和PK 的酶活性分别提高了46.8%和16.9%;
与模型组相比,LPP 样品组从0.1 mg/mL 到1 mg/mL HK 的活性分别提高了38.1%、44.8%和36.6%,PK 的活性分别提高13.7%、16.6%和13.5%,由此可以看出0.1~1 mg/mL 的LPP 能够显著提高IR-HepG2 细胞HK 和PK 活性(P<0.001),且在浓度LPP 为0.5 mg/mL 时效果最好。该结果表明在一定浓度范围内LPP 能够提高提高糖酵解关键酶活性,加速葡萄糖的利用,从而达到调节糖代谢的作用。符群等[31]的研究发现鸡树条荚蒾果多酚可提高IR-HepG2 细胞的HK、PK 活性,加快糖酵解,从而减少细胞内源性葡萄糖的产生,虽然鸡树条荚蒾果多酚与柠檬皮多酚组成不尽相同,但是其调节糖代谢的作用途径相同。
2.3.3 LPP 对IR-HepG2 细胞PEPCK、G6Pase 活性的影响 糖异生是体内的生糖反应,能将乳酸、丙酮酸、氨基酸和甘油等非糖物质转化为糖,糖异生主要是在肝脏进行,小部分在肾脏进行,因此通过抑制PEPCK 和G6Pase 这两种酶的活性可以抑制非糖物质转化为葡萄糖,从而降低血糖浓度,调节血糖平衡[32]。图9、图10 为LPP 对IR-HepG2 细胞中PEPCK、G6Pase 活性影响的测定结果。
由图9、图10 可知,模型组PEPCK 和G6Pase的酶活力分别为13.94±0.30 和43.87±0.78 IU/g prot,均显著高于空白对照组(P<0.001),说明此时IRHepG2 细胞的糖异生反应高于正常细胞,表现出了糖代谢紊乱现象;
阳性对照组与模型组相比,PEPCK和G6Pase 的活性分别降低了42.5%和24.3%;
与模型组相比,LPP 样品组从0.1~1 mg/mL PEPCK 的活性分别降低了33.1%、41.2%和18.6%,G6Pase 的活性分别降低了20.2%、22.8%和13.3%;
0.5 mg/mL的LPP 组与阳性对照组相比PEPCK 和G6Pase 的活性差异均不显著(P>0.05)。该结果表明在一定浓度范围内LPP 能够通过抑制糖异生关键酶的活性,减少生糖反应,从而发挥调节糖代谢的作用,且当浓度为0.5 mg/mL 时与0.05 mg/mL 的二甲双胍具有相似效果。ELUMALAI[33]和JU 等[34]研究发现橙皮苷可以增加糖尿病大鼠和小鼠的HK 活性,降低G6Pase 活性,并能改善其肝组织中的糖原含量,这一结果与本文结论相符,据此可以推测LPP能够发挥调节糖代谢作用可能与其中的橙皮苷成分密切相关。

图9 LPP 对IR-HepG2 细胞中PEPCK 活性的影响Fig.9 Effect of LPP on the activity of PEPCK in IR-HepG2 cells
本试验利用HPLC-QTOF-MS 对柠檬皮多酚进行初步成分分析,共分析出12 种物质,分别为香草酸、新绿原酸、荭草素、山奈黄苷、圣草枸橼苷、野漆树苷、Chrysoeriol-7-O-(2"-O-mannopyranosyl)allopyranoside、金雀花素、地奥司明、橙皮苷、4-甲基-7-乙酰氧基香豆素-β-D-葡萄糖醛酸苷和诺米林;
进一步通过测定柠檬皮多酚对IR-HepG2 细胞葡萄糖消耗量的影响,发现在前48 h 内浓度为0.1~2 mg/mL的LPP 组与模型组比较可以显著提高(P<0.05)IRHepG2 细胞的葡萄糖消耗量,缓解胰岛素抵抗状态,通过测定LPP 作用后IR-HepG2 细胞的糖原含量、HK、PK、PEPCK 和G6Pase 的活性来研究LPP 调节糖代谢的途径,结果表明,柠檬皮多酚能够显著提高IR-HepG2 细胞的糖原含量和糖酵解关键限速酶HK 和PK 的酶活力(P<0.001),显著降低糖异生关键酶PEPCK 和G6Pase 的活性(P<0.001),从而达到调节血糖的作用,且当LPP 浓度为0.5 mg/mL 时,其提高细胞糖原含量、促进糖酵解、抑制糖异生的效果最好。本试验为后续进行体内试验提供了数据支持,为今后开发成功能性产品或添加剂提供了可靠依据。