纳米金属有机框架作为生物成像剂的研究进展
来源:优秀文章 发布时间:2023-01-20 点击:
祁赵蕊,李旭蕊,韩莎莎,刘 宇,2,刘冰弥,2,李 丽,2
(1.辽宁大学药学院,辽宁 沈阳 110036) (2.辽宁大学司法鉴定中心,辽宁 沈阳 110036)
金属有机框架材料(metal-organic frameworks, MOFs)是一类结构独特的多孔晶体材料,是以金属离子或簇合物为节点,有机配体为连接物,通过配位键构建的一维、二维或三维多孔配位聚合物(porous coordination polymers, PCPs)[1]。MOFs由于同时具有无机材料和有机材料的优势,如比表面积大、孔隙率高、内部孔道尺寸可调和表面可功能化等,因此已成为气体储存[2]、催化[3]、发光[4]、传感[5]、药物输送[6]等应用领域的研究热点。MOFs在纳米材料发展中备受关注,与其他纳米材料不同,纳米级金属有机框架材料(nano-MOFs, NMOFs)具有可调节的孔径和易修饰的表面,因此,通过直接合成或合成后修饰等方法,使多功能NMOFs已被广泛应用于生物相关领域[7-9],成为生物医学应用的热点[10, 11],特别是在药物输送、生物医学成像和生物传感等领域的应用越来越受到人们的关注。
在临床上,癌症的早期诊断在早期治疗中起着至关重要的作用,它有助于提高患者的生存率[12, 13]。磁共振成像(magnetic resonance imaging, MRI)、X射线计算机断层扫描(X-ray computed tomography, X-CT)、光学成像(optical imaging, OI)、光声成像(photoacoustic imaging, PAI)和正电子发射断层扫描(positron emission tomography, PET)都是将病变组织与周围组织区分开的诊断技术。诊断成像中通常需要造影剂在病变区域提供更好的对比度,不同于受非特异性分布和快速清除率限制的小分子造影剂,NMOFs作为成像剂具有以下优点:协同传递多种生物分子(如造影剂、抗癌药物、siRNA)的强大能力[14-16],易于功能化[17],多模态成像或图像引导治疗的多功能性[18],由于肿瘤的渗透性和滞留作用增强而促进NMOFs在肿瘤聚集[19]。本文将从单模态、双模态和多模态成像技术3个方面对近15年来NMOFs在生物医学成像方面的研究进展进行综述。
2.1 磁共振成像(MRI)
MRI是一种基于检测磁场中核自旋重定向的非侵入性成像技术[20],具有优异的空间分辨率、高软组织对比度和大穿透深度等特点。MRI造影剂的有效性由弛豫效率r表示,其中r1代表正增强,r2代表负增强,具有较大弛豫效率的造影剂能够提供更有效的对比度。目前,最常用的T1造影剂是钆(Gd)类小分子造影剂,但其敏感性较低,偶尔会导致肾功能损害患者的肾源性系统性纤维化[21]。
Rieter等[22]首次将含有Gd的NMOFs 作为磁共振造影剂进行研究。他们用反相微乳液法制备了含对苯二甲酸根(BDC)的晶态Gd(BDC)1.5(H2O)2纳米棒,该NMOFs的表面和周围包含大量Gd3+,因此在每个粒子上会产生非常大的弛豫速率。他们认为,当其结合到靶向部位时,由于金属负载量很大,因此可能成为有效的靶向特异性磁共振造影剂。在含0.1%黄原胶(质量分数)的水溶液中所得弛豫数据表明,Gd(BDC)1.5(H2O)2具有非常高的r1弛豫效率:长度约100 nm、直径约40 nm的Gd-(BDC)1.5(H2O)2r1弛豫效率为35.8 mmol-1·s-1;
长度约1 μm、直径约100 nm的Gd(BDC)1.5(H2O)2r1为45.7 mmol-1·s-1;
在含0.1%黄胶原的水溶液中,临床使用的小分子造影剂OmniScan的r1为4.1 mmol-1·s-1,表明该NMOF比OmniScan具有更高的r1弛豫效率,与OmniScan相比,该纳米棒能够更有效地增强T1加权图像中的水信号。
然而游离的Gd3+毒性较强,会造成肾损害患者的肾源性系统性纤维化,研究表明含有Mn2+的MRI造影剂比Gd3+毒性更低、更有效[23, 24],并且Mn2+通过与细胞内蛋白结合,在体内表现出非常高的r1弛豫效率[25]。Lin等[26]研发了用于增强T1加权对比度的锰基NMOFs,他们在反相微乳液中合成了含BDC和对苯三甲酸根(BTC)桥联配体的Mn(BDC)(H2O)2纳米棒和Mn3(BTC)2-(H2O)6纳米颗粒,在3 T的磁场强度下测定了2种NMOFs的弛豫效率,结果显示,Mn(BDC)(H2O)2和Mn3(BTC)2(H2O)6的r1值分别为5.5和7.8 mmol-1·s-1,只具有中等的r1弛豫效率,本不能成为有效的T1加权造影剂,但因其能够释放大量的Mn2+,从而可使其T1加权信号明显增强。
An等[27]将传统造影剂与MOF相结合,制备了pH响应型和谷胱甘肽(GSH)响应型T2-T1切换造影剂Fe3O4-ZIF-8。他们采用常规热分解法制备了Fe3O4纳米粒子,平均粒径约为6 nm,对其表面进行修饰后再通过简单的一步自组装法,将Fe3O4纳米颗粒T1造影剂组装成T2造影剂Fe3O4-ZIF-8。在肿瘤部位的微酸环境或过度表达的GSH环境下, Fe3O4-ZIF-8被分解并释放出Fe3O4纳米粒子,导致从T2到T1的对比度增强,从而恢复其作为T1造影剂的性能。
磁性氧化铁纳米粒子由于其固有的磁性和良好的生物相容性,已被开发成为一种很有前途的生物医用材料,应用于药物传递、基因传递、磁共振成像和磁靶向热疗[28, 29]等领域。Chowdhuri等[30]研制了一种新的核壳结构磁性多孔材料,由MOFs包裹Fe3O4纳米粒子,进一步与叶酸(folic acid, FA)结合得到叶酸靶向磁性纳米颗粒Fe3O4@IRMOF-3/FA,并研究了其作为MRI成像剂的效果。他们采用体外实验评估了Fe3O4@IRMOF-3/FA作为高表达叶酸受体的癌细胞MRI造影剂的有效性,与Fe3O4@IRMOF-3孵育的细胞相比,Fe3O4@IRMOF-3/FA孵育的细胞模型MRI图像显示出更好的负对比度增强,且随着NMOF浓度的增加,T2加权图像的信号强度发生显著变化。
2.2 X射线计算机断层扫描(X-CT)
X-CT成像基于X射线衰减为物体内部结构的三维可视化提供了强有力的诊断工具。具有高X射线衰减的造影剂,如碘化芳香族分子和硫酸钡,通常用于靶组织和邻近组织之间的对比。然而,由于它们的非特异性分布、体内快速清除和从血管和淋巴管外渗,目前临床上应用时需要大剂量,这导致了一些患者产生不良反应[31]。与小分子X-CT造影剂相比,纳米X-CT造影剂具有循环时间长、副作用小、剂量小等优点,可获得良好的对比效果[32]。
Dekrafft等[33]开发了具有高Hf(57%,质量分数)负载量的UiO-66 NMOFs,研究了它们作为X-CT造影剂的潜力。用SiO2包裹Hf-UiO-66,再用聚乙二醇(PEG)功能化以赋予其生物相容性,得到Hf-UiO@SiO2@PEG。将其经尾静脉注射于小鼠后,活体X-CT成像结果表明,大约6%的成像剂累积在脾脏,而大约50%的成像剂累积在肝脏,说明Hf-UiO@SiO2@PEG可作为脾脏或肝脏的造影剂。
Zhang等[34]通过将光活性碘-BODIPY染料的配体交换到UiO-MOFs骨架中,成功制备了高结晶、单分散的UiO-PDT纳米晶。为了证明所合成的UiO-PDT纳米晶对X射线的衰减能力,他们在X射线管电压80 kVp下用Micro-CT扫描了不同浓度(2.5~40 mg·mL-1)的样品水溶液,随着UiO-PDT浓度的增加,X-CT信号的强度逐渐增强,图像更亮。其次,对有原位肝癌的大鼠进行了活体X-CT成像, UiO-PDT在肿瘤部位的蓄积比在周围结缔组织和器官中的蓄积要高,可以作为实体瘤(如肝脏肿瘤)的X-CT造影剂。
2.3 光学成像(OI)
OI是利用分子的物理属性来突出特定的生物过程。OI对病患具有微创、高度敏感的特点,但光的浅穿透性限制了其在临床上的应用。Chelora等[14]将阳离子配合物Ru(bpy)32+掺入多孔UiO-67纳米颗粒中,可实现增强双光子荧光(two-photon fluorescence, TPF)成像。如图1所示,细胞实验中(nUiO-67)-Ru(bpy)32+纳米粒子能够成功地内化到肿瘤细胞中,并提供强大的TPF成像能力。
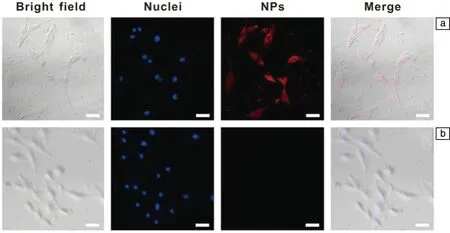
图1 用(nUiO-67)-Ru(bpy)32+纳米粒子(NPs)(a)和无NPs(b)孵育12 h的A549细胞用hoechst 33342染色后的激光扫描共聚焦显微镜 (confocal laser scanning microscope, CLSM)照片[14]Fig.1 CLSM images of A549 cells incubated with (nUiO-67)-Ru(bpy)32+ NPs (200 μg·mL-1) (a) and without NPs (b) for 12 h followed by staining with hoechst 33342[14]
2.4 光声成像(PAI)
PAI是一种基于光声效应超声探测吸收光子的独特检测技术,是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法。具有较强光吸收系数的纳米材料,例如金纳米棒(Au NR)、多巴胺纳米颗粒是很有前途的PAI造影剂。
Wang等[35]成功地制备了一种新型核壳纳米结构的Au NR@ZIF-8,并研究了其用于PAI的潜力。在此核壳结构复合材料中,Au NR核作为PAI的造影剂,ZIF-8壳层作为Au NR表面的涂层,进一步提高了稳定性和载药量。如图2所示,Au NR@ZIF-8纳米粒子溶液的PAI信号随着纳米材料浓度的增加而增强,表明Au NR@ZIF-8核壳纳米结构可以有效地将光能转化为热能,因此可以作为一种新型的PAI造影剂。

图2 Au-NR@ZIF-8核壳纳米结构的光声成像(photoacoustic imaging,PAI)照片和信号强度[35]Fig.2 Au-NR@ZIF-8 core-shell nanostructures PAI images and signal intensity[35]
2.5 正电子发射断层扫描(PET)
PET是一种核功能成像技术,它依赖γ射线,通过追踪核素(如18F、64Cu、68Ga、89Zr)标记的造影剂的γ射线发射,重建三维PET图像,将人体内的代谢过程可视化。PET成像具有信号穿透力强、定量能力强、灵敏度高等优点,是指导各种恶性肿瘤治疗的良好诊断工具。
Dougherty等[36]设计合成了掺入正电子发射同位素89Zr的本征放射性UiO-66 纳米材料(89Zr-UIO-66),进一步用芘衍生的聚乙二醇(Py-PGA-PEG)功能化,并与肿瘤靶向多肽配体(F3)偶联,得到89Zr-UiO-66/Py-PGA-PEG-F3。随后,他们将其注射到荷瘤小鼠(MDA-MB-231原位肿瘤)体内后,在不同的时间点进行连续PET扫描,并对MDA-MB-231肿瘤中心进行冠状切片,如图3所示,通过PET扫描追踪到该纳米粒子在肿瘤中快速积聚,在注射后0.5 h明显可见,在注射后2 h时保持稳定。该研究显示出本征放射性UiO-66结合物用于未来的图像引导治疗和靶向癌症治疗的巨大潜力。
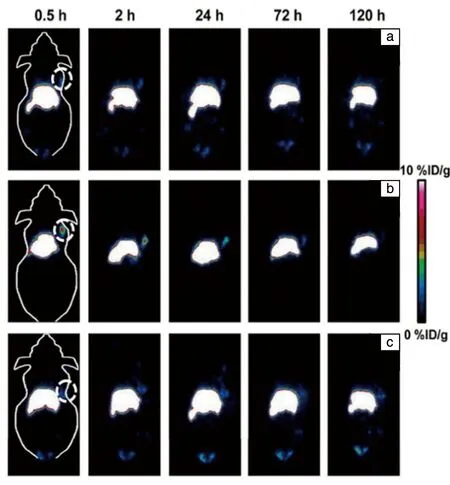
图3 注射89Zr-UiO-66/Py-PGA-PEG-F3 (a)、 89Zr-UiO-66/Py-PGA-PEG (b)和过量F3肽阻断的89Zr-UiO-66/Py-PGA-PEG-F3 (c)后不同时间点MDA-MB-231肿瘤小鼠的典型冠状面正电子发射断层扫描(positron emission tomography, PET)照片[36]Fig.3 Representative coronal PET images of MDA-MB-231 tumor bearing mice at different time points after post-injection of 89Zr-UiO-66/Py-PGA-PEG-F3(a), 89Zr-UiO-66/Py-PGA-PEG (b), and 89Zr-UiO-66/Py-PGA-PEG-F3 with excessive amount of F3 peptide blocking (c)[36]
3.1 OI/MRI
虽然影像引导的癌症治疗已得到广泛应用,但目前仍很难选择合适的影像方式进行临床诊断。目标灵敏度高的医学成像方法通常分辨率较低,而提供高分辨率的医学成像方法往往受到低灵敏度的限制。如在OI中,近红外荧光探针具有高灵敏度,但分辨率较低,相比之下,MRI具有较高的空间分辨率,但灵敏度相对较低,将OI/MRI联合的双模态成像,既弥补了MRI灵敏度的不足,又改善了OI的低分辨率。
稀土(rare earth, RE)掺杂的上转换纳米粒子(upconversion nanoparticles, UCNPs)由于其优良的近红外(near infrared, NIR)激发上转换发光(upconversion luminescence, UCL)特性,在UCNPs的双模态生物成像系统中,将UCL和MRI集成在一个系统中,可以将近红外成像的光稳定性高、光学背景低和MRI的良好空间分辨率等优点更好地结合起来。Li等[37]合成了八面体核壳纳米结构UCNP@Fe-MIL-101NH2,发现该复合材料可以同时表现出UCNP核的近红外光学性质和MOF壳的T2-MRI性质。为了提高生物相容性和稳定性以及增加靶向性功能,该团队利用聚乙二醇-2-氨基乙醚乙酸(NH2—PEG—COOH)和叶酸对核壳结构纳米粒子表面的氨基进行修饰,得到了聚乙二醇基化的核壳纳米结构UCNP@Fe-MIL-101NH2@PEG-FA(简称UMP-FA)。纳米复合材料用于过表达叶酸受体的KB细胞和KB荷瘤小鼠的UCL/T2-MRI双模成像,表现出较高的灵敏度和较低的毒性。具有良好的体内外生物相容性和肿瘤靶向性的UMP-FA,作为UCL/MRI双模显像剂具有巨大的发展潜力。
3.2 MRI/PAI
Chen等[38]制备了一种以聚吡咯(PPy)为核、MIL-100(Fe)为壳的纳米复合材料PPy@MIL-100(Fe)。进一步对不同浓度的PPy@MIL-100(Fe)进行体外MRI和体外PAI信号测量,如图4a所示,随着PPy@MIL-100(Fe)浓度增加,该材料的T2图像变暗,表明浓度增加使得MRI信号衰减效果更好;
如图4b所示,PPy@MIL-100(Fe)的PAI信号图像随着浓度的增加而变亮,表明PPy@MIL-100(Fe) 是一种有效的MRI/PAI造影剂。
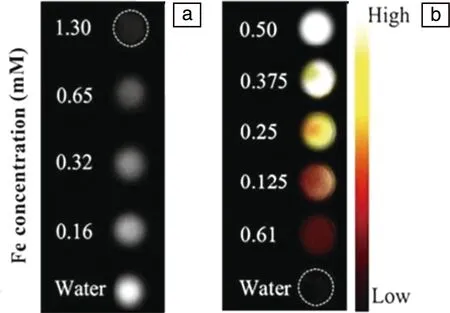
图4 不同浓度的PPy@MIL-100(Fe)水溶液的T2加权图像(a)和PAI体模图像(b)[38]Fig.4 T2-weighted images (a) and PAI phantom images (b) of PPy@MIL-100(Fe) aqueous solution with different concentrations[38]
4.1 FL/MRI/CT
MRI可以提供非常清晰的3D软组织细节,但其平面分辨率有限,不适合细胞水平成像。X-CT成像是一种非侵入性的临床诊断技术,它可以根据生物组织对X射线的不同吸收情况,提供高分辨率的三维结构细节,但由于X射线对软组织的低灵敏度,其在疾病检测中的应用受到了极大的限制。荧光(fluorescence, FL)成像可以解决上述问题,但其组织穿透性较低。因此,将FL、X-CT和MRI 3种造影剂在单一系统中协同使用,既结合了各自的优点,又可以克服各自的缺点。为了提高活体生物成像的质量和诊断效率,发展了FL/MRI/CT三模成像技术。
Du等[39]利用癌细胞中特定的微环境,如异常的活性氧(reactive oxygen species, ROS)、活性氮(reactive nitrogen species, RNS)和GSH水平,设计了吸附Fe2+的ZIF-8纳米复合材料,并探索了其在体内多模式肿瘤细胞成像中的应用。在ZIF-8中加入Fe2+不仅可以中和碱性,降低毒性,而且在癌细胞中,ZIF-8上的Fe2+会被ROS(如H2O2)部分氧化成Fe3+,在ROS、GSH和酸协同作用下转化为超顺磁性Fe3O4,Fe3O4具有高T2弛豫效率以及良好的X射线衰减特性;
同时癌细胞中高浓度的GSH促使ZIF-8降解,使Zn2+脱离骨架,最终形成荧光ZnO纳米团簇。这一研究利用了癌细胞与正常细胞内的环境差异,使实现有效、靶向、快速的体内肿瘤FL/MRI/CT多模态成像成为可能。
4.2 FL/MRI/PAI
Cai等[40]制备了一种对肿瘤细胞表面具有高选择性和亲和力的MIL-100(Fe)纳米粒子,首先将MOF纳米粒子与透明质酸(hualuronic acid, HA)偶联,然后负载吲哚青绿(indocyanin green, ICG)分子合成MOF@HA@ICG。此纳米粒子具有高负载量 (40%)ICG和耐光性,近红外吸收强,可用于FL/MRI/PAI引导光热疗法(photothermal therapy, PTT)。ICG具有荧光性质和良好的近红外吸收能力,因此具有FL和PAI成像潜力;
Fe3+可以用于T2加权MRI;
HA可介导CD44蛋白高表达癌细胞的靶向识别能力。如图5所示,体内成像展示了MOF@HA@ICG NPs 良好的FL成像、PAI、T2加权MRI成像效果。与MOF@ICG纳米粒子和游离ICG相比,MOF@HA@ICG NPs在CD44阳性的MCF-7细胞中具有更高的细胞摄取能力,并由于其靶向性而增加了纳米粒子在异种移植瘤中的积聚。这些结果显示了MOF@HA@ICG NPs结合FL、PAI和T2加权MRI,用于多模态成像的潜在价值。

图5 MCF-7荷瘤小鼠注射游离ICG、MOF@ICG或MOF@HA@ICG溶液的荧光(fluorescence, FL)图像(a);
体外FL图像(b);
经MOF@HA@ICG处理的活体PAI图像(c)和T2加权MRI图像(d)[40]Fig.5 FL images of MCF-7 tumor-bearing mice injected with free ICG, MOF@ICG, or MOF@HA@ICG solutions(a); ex vivo FL images (b); in vivo PAI images (c) and T2-weighted MRI images (d) with MOF@HA@ICG treatment[40]
4.3 CT/MRI/PAI
传统的成像方法(如CT、MRI、PAI)具有一定的局限性,很多病变单凭一种成像方式难以确诊,此外,它们还存在成像灵敏度低、成像穿透深度低和空间分辨率差等固有缺陷,而CT/MRI/PAI的联合应用能提高诊断能力,使成像灵敏度、穿透深度和空间分辨率得到显著提高。含有金属核的NMOFs表现出良好的光学性能和磁性以及很强的X射线衰减性能,因此是组装多功能显像剂的理想候选材料。Shang等[41]开发了一种核壳纳米结构的Au@MIL-88(Fe),其核心是完好的Au纳米晶体,外壳是基于Fe的单晶NMOF,该材料同时具有Au纳米棒芯的CT增强和PAI光学特性以及NMOF壳层的T2加权MRI特性,为了提高Au@MIL-88(Fe)纳米粒子的生物相容性和稳定性,进一步用PEG—COOH对Au@MIL-88(Fe)改性,用于胶质瘤的多模态成像研究。体外实验表明,改性纳米颗粒Au@MIL-88(Fe)显示出高增强CT、MRI和PAI成像效果。进一步进行体内实验,对U87 MG-原位荷瘤小鼠进行静脉注射12 h后进行体内三模态成像,与注射前相比,注射纳米粒子后的CT和MRI图像均显示清晰结构且出现明显的PAI信号(图6)。该研究表明,将Au@MIL-88(Fe)纳米颗粒用于胶质瘤成像不仅成像清晰,还能提高检测结果的空间分辨率、对比度和穿透深度,因此,未来该NMOF有望用于原位深部胶质瘤的多模态成像。

图6 静脉注射Au@MIL-88(Fe)前和注射12 h后U87 MG-原位荷瘤小鼠体内的CT图像(a, b)、T2加权图像(c, d)、PAI图像(e, f)[41]Fig.6 In vivo CT images (a, b), T2-weighted MRI images (c, d) and PAI images (e, f) of U87 MG-orthotopic tumor-bearing mice before and after intravenous (i.v.) injection with Au@MIL-88(Fe)[41]
金属有机框架材料(metal-organic frameworks, MOFs)因具有独特的结构和化学特性,使其能够用于环境、化学和生物医学等相关领域,同时含金属离子或金属团簇的MOFs是多种成像方式的造影剂。在过去的十余年中,用于生物医学成像的MOFs越来越受关注。与其他造影剂相比,由于具有高孔隙率、大比表面积、易功能化和良好生物相容性等优点,许多纳米MOFs(NMOFs)已被证明具有良好的生物医学成像潜力。尽管近年来基于NMOFs的生物成像研究取得了重要进展,但其在成像领域的应用仍然面临着许多挑战。
首先,与NMOFs框架配位的金属离子在生物环境中可能会过度渗出,而一些金属离子如果过量释放可能会对人体产生严重的毒性,从而会对身体造成伤害。因此,如果能够找到合适的聚合物和生物配体或细胞靶向配体对NMOFs进行功能化修饰,就可以改善NMOFs结构中金属离子的浸出,同时也有助于提高NMOFs的稳定性,防止NMOFs聚集。其次,NMOFs在生理条件下较差的稳定性大大限制了其在生物医学领域的应用,但为了使降解产物被人体代谢掉,防止在体内积累,一定程度的化学不稳定性又是必须的。随着科技的快速发展,人们对数据采集时间更短但空间分辨率更高的成像仪器的需求更加迫切,因此,NMOFs造影剂在体内的稳定性和降解时间更加关键。稳定性过低,其在体内的分解速度过快,导致成像效果不好;
稳定性过高,其在体内的分解过程复杂,导致降解时间过长,引起内源性蓄积。因此,找到合适的修饰方法使NMOFs具有恰当的稳定性至关重要。第三,尽管目前已对很多MOFs进行了体内外的短期研究,但长期的系统研究几乎没有。对NMOFs的性能优化,以及对NMOFs及其复合材料在体内外的长期安全性考察,包括生物分布、代谢、药代动力学和药效学等等,都有待于进一步深入研究。
虽然存在一些困难和挑战,但MOFs在生物医学成像领域的应用前景依然是非常广阔的。未来如果将负载药物与生物成像集于NMOFs一身,或根据肿瘤微环境的特点设计可激活的成像与治疗一体化NMOFs,有望进一步拓宽NMOFs在生物医学领域的应用。
猜你喜欢 造影剂X射线靶向 实验室X射线管安全改造机电安全(2022年5期)2022-12-13新型抗肿瘤药物:靶向药物中老年保健(2022年1期)2022-08-17如何判断靶向治疗耐药保健医苑(2022年5期)2022-06-10循证护理在增强CT检查中减少造影剂外漏发生的作用现代仪器与医疗(2021年4期)2021-11-05携IL-6单克隆抗体靶向微泡破坏技术在兔MI/RI损伤中的应用昆明医科大学学报(2021年2期)2021-03-29造影剂肾病的研究进展中华养生保健(2020年4期)2020-11-16天鹅座X-1——最容易看到的黑洞迹象百科探秘·航空航天(2019年8期)2019-08-01浅析X射线计算机断层成像的基本原理山东工业技术(2016年15期)2016-12-01“造影剂肾病”你了解吗现代养生·上半月(2016年8期)2016-05-14靶向超声造影剂在冠心病中的应用医学研究杂志(2015年7期)2015-06-22推荐访问:研究进展 成像 纳米