我国草地贪夜蛾种群杀虫剂靶标基因突变分析
来源:优秀文章 发布时间:2023-01-18 点击:
王帅宇,张子腾,,谢爱婷,董杰, 杨建国,张爱环
我国草地贪夜蛾种群杀虫剂靶标基因突变分析
王帅宇1,张子腾1,2,谢爱婷1,董杰1, 杨建国1,张爱环2
1北京市植物保护站,北京 100029;
2北京农学院生物与资源环境学院/农业农村部华北都市农业重点实验室,北京 102206
【背景】草地贪夜蛾()原产于美洲热带和亚热带地区,是重大迁飞性农业害虫。2016年以来迅速扩散至全球100多个国家,目前已入侵我国27省(自治区、直辖市),对粮食安全构成极大威胁。化学防治是草地贪夜蛾的重要应急防控措施,经过几年的药剂防治,草地贪夜蛾的抗药性可能会发生变化,进而影响防治策略的有效性。其发生范围持续北扩,而目前2020—2021年国内不同种群及长城防线种群抗药性现状以及年度间变化性研究较少。【目的】明确我国不同区域种群(包括长城防线)的抗药性现状与差异,为草地贪夜蛾防控的科学用药提供指导。【方法】采集13省(自治区、直辖市)的草地贪夜蛾田间种群样本,通过对单头样本杀虫剂靶标基因的PCR扩增产物直接测序,分析2020—2021年采自13省(自治区、直辖市)47市(区)草地贪夜蛾种群的362头个体氨基甲酸酯类、拟除虫菊酯类和双酰胺类杀虫剂靶标基因的突变情况。【结果】草地贪夜蛾部分个体在氨基甲酸酯类药剂靶标乙酰胆碱酯酶(acetylcholine esterase)基因-1上存在突变,种群有6种-1基因型。-1基因检测到A201S和F290V位点突变;
其中A201S均为抗性杂合突变,突变频率为8.4%;
F290V为14.9%的抗性纯合突变和25.7%的杂合突变,未检测到G227A位点突变。重点防范区F290V位点突变频率高于迁飞过渡区和周年繁殖区,而在A201S位点突变频率均低于两区。长城防线、黄淮海阻截攻坚带、长江流域以及西南华南监测防控带-1基因突变频率均较高。A201S和F290V突变频率在2021年均较2020年种群略有下降,但无显著性差异。拟除虫菊酯类药剂靶标电压门控钠通道(voltage-gated sodium channel)基因和双酰胺类药剂靶标鱼尼丁受体(ryanodine receptor)基因均未检测到靶标基因突变。【结论】草地贪夜蛾种群氨基甲酸酯类靶标基因已发生较高频率的突变,说明对氨基甲酸酯类杀虫剂已产生较高水平的抗药性,在草地贪夜蛾的防控中应尽量减少使用。本研究显示草地贪夜蛾拟除虫菊酯类和双酰胺类杀虫剂靶标基因尚未检测到突变,这两类杀虫剂可与其他作用机制药剂科学轮换用于草地贪夜蛾的防控,鉴于目前已检测到这两类药剂的靶标基因突变个体,以及其国内近缘种甜菜夜蛾对这两类药剂存在较为普遍的杀虫剂靶标基因突变等情况,今后应开展草地贪夜蛾在室内外药剂高选择压力下以及寄主变化对主要防控药剂的靶标基因突变的影响,并加快抗药性快速检测技术和产品研究。
草地贪夜蛾;
抗药性;
氨基甲酸酯;
拟除虫菊酯;
双酰胺;
靶标基因;
突变频率
【研究意义】草地贪夜蛾()是重要的农业害虫,原产于美洲,近年迅速扩展到其他国家,并于2018年12月首次入侵我国,目前已在我国27省(自治区、直辖市)1 338县(市、区)发生危害[1-3]。草地贪夜蛾寄主范围广、迁飞和繁殖能力强、危害重,在我国主要危害玉米,但也发现其在水稻、小麦、花生、高粱等粮食作物上进行危害,对我国粮食生产安全构成极大威胁[4-5]。20世纪90年代前,使用化学杀虫剂是防控草地贪夜蛾的重要手段,常用药剂主要是传统的有机磷类、氨基甲酸酯类和拟除虫菊酯类杀虫剂,而长期的药剂选择压力及不合理的使用使草地贪夜蛾田间种群对多种药剂产生了不同程度的抗药性[6-7]。草地贪夜蛾入侵我国后,化学防治是主要的应急防控措施,开展草地贪夜蛾种群抗性基因突变检测,对明确草地贪夜蛾对常用药剂敏感性现状及科学防控具有重要指导意义。【前人研究进展】目前室内毒力及靶标基因检测结果均表明不同国家(包括原发地和入侵地)草地贪夜蛾已对41种杀虫剂产生了不同程度的抗性。产生抗性的杀虫剂既包括有机磷、氨基甲酸酯类、拟除虫菊酯等传统杀虫剂,也包括双酰胺、多杀菌素等新型杀虫剂[8-12],部分种群对新型药剂已产生极高水平抗性[8,13-14],且双酰胺类部分药剂间交互抗性高于40 000倍[15-16]。草地贪夜蛾对杀虫剂的抗药性机制较为复杂且不断变化。目前普遍认为,草地贪夜蛾对杀虫剂的抗性机制主要包括表皮穿透性降低、解毒作用增强和靶标敏感型下降。关于草地贪夜蛾抗性机理的研究以靶标抗性为主[11]。乙酰胆碱酯酶(acetylcholine esterase)基因-1、电压门控钠通道(voltage-gated sodium channel)基因和鱼尼丁受体(ryanodine receptor)基因分别是氨基甲酸酯类、拟除虫菊酯类和双酰胺类药剂的作用靶标[9,17-18],而靶标基因上的点突变引起靶标敏感性降低导致抗药性的产生,不同地域种群的突变位点在数量和频率上有较大的差异。田间种群氨基甲酸酯类药剂靶标基因突变频率较高,突变类型主要为A201S、G227A和F290V,但经过多年抗性治理以及Bt转基因作物的种植,抗性水平有所下降[18-20]。拟除虫菊酯类靶标基因位点突变在各类害虫中也有广泛报道,突变类型主要为T929I、L932F和L1014F,田间种群抗性基因突变频率相对较低[19,21]。鳞翅目害虫的双酰胺类药剂靶标突变较为普遍,主要为I4734M和G4891E[21-24],草地贪夜蛾田间种群抗性基因突变频率也较低。目前国内部分种群对3类药剂抗性基因突变情况与前人研究结果相近,田间种群以氨基甲酸酯类药剂靶标基因1的突变为主,主要为A201S和F290V突变;
目前报道的数千头个体仅有几头检测到拟除虫菊酯类药剂靶标基因的T929I、L932F和L1014F突变和双酰胺类药剂靶标基因的I4734M和G4891E突变,且不同位点突变分别出现在不同个体中[20,25-30]。【本研究切入点】草地贪夜蛾的高繁殖力和强迁飞能力等生物学特性非常有利于抗性基因的扩散[11],入侵种群对杀虫剂抗性主要取决于原发地种群的抗性等位基因频率和入侵地用药的选择压力以及扩散情况[31]。目前国内不同地区采取的防控策略有差异,入侵种群的抗性等位基因和对药剂敏感性可能会产生变化[6,32-33]。京津冀是草地贪夜蛾长城防线省份和重点区域,该地区鳞翅目害虫常用防控药剂是拟除虫菊酯类和双酰胺类药剂,经过几年药剂防治的累积效应,草地贪夜蛾的抗药性可能发生变化[34],但目前关于京津冀地区和2020年以来国内不同种群抗药性研究报道较少,长城防线种群与其他区域种群抗药性现状如何,以及是否有差别并不清楚。【拟解决的关键问题】基于此,开展2020—2021年草地贪夜蛾防控带种群及其他区域的草地贪夜蛾种群3类杀虫剂靶标基因的突变检测和分析,旨在明晰草地贪夜蛾种群抗药性现状及各区域抗药性的差别,为草地贪夜蛾及其他鳞翅目害虫的防控提供参考。
1.1 试验材料
供试草地贪夜蛾样品为2020年8月至2021年10月采自我国13省(自治区、直辖市)47市(区)的362个样本,幼虫为田间随机采集,成虫为田间随机采集和诱捕器诱集,经室内形态检查确定为草地贪夜蛾后,于-80℃保存,具体采集信息见表1。3个生态区为周年繁殖区、迁飞过渡区和重点防范区,其中周年繁殖区主要为热带和南亚热带气候分布区;
迁飞过渡区包括中亚热带和北亚热带气候分布区;
重点防范区主要为温带气候区[32]。4个防控带主要包括西南华南监测防控带、长江流域监测防控带、黄淮海阻截攻坚带和长城防线[33-34]。
1.2 靶标片段扩增
DNA提取:采集的样本分别采用组织/细胞基因组DNA快速提取试剂盒(北京博迈德基因技术有限公司)进行DNA提取。将单头虫体置于培养皿,用灭菌后的剪刀剪取头部、腹部或足,剪切细碎后置于离心管,加入30 μL裂解液,用研磨棒充分研磨后,按说明书操作。纯化后的DNA经过0.8%琼脂糖凝胶电泳检测,选取合适浓度的DNA用于PCR扩增。
PCR扩增:分别对草地贪夜蛾1、和基因片段进行PCR扩增,引物序列部分参考Carvalho和Boaventura等[9,17],和部分引物为本试验设计,具体信息见表2。采用2×PCR Mix(北京博迈德基因技术有限公司)进行PCR扩增,PCR反应体系总体积20 μL:DNA模板1 μL,正反向引物各0.5 μL,2×PCR Mix 10 μL,ddH2O 8 μL。PCR反应程序:95℃预变性3 min;
每个循环95℃变性30 s,50℃退火30 s,72℃延伸1 min,共34个循环;
72℃延伸10 min。
PCR扩增结束后,使用2%琼脂糖凝胶电泳检测扩增结果,选取与目标长度一致的单一片段PCR产物送北京博迈德基因技术有限公司测序。
1.3 数据分析
利用Chromas软件对获得的基因序列进行峰图分析,确定1、和编码蛋白在上述位置对应核苷酸是否发生点突变。用Excel记录统计每个样本的基因型以及每个种群的突变频率。靶标基因突变频率(%)= [(抗性纯合子个体数/检测总数)+(抗性杂合子个体数/检测总数/2)]×100。采用SPSS26.0(IBM,Armonk,NY,USA),通过Kolmogorov-Smirnov检验得出本研究中的频率数据非正态分布,因此采用Kruskal-Wallis非参数检验分析突变间抗性等位基因频率的差异。
2.1 草地贪夜蛾种群ace-1基因型和突变频率
2.1.11基因型、突变类型与突变频率 通过1的特异性引物对草地贪夜蛾样本DNA进行PCR扩增,经过琼脂糖凝胶电泳检测,所有扩增样品均得到和预期片段大小一致的基因片段,长度为760 bp。通过序列比对和峰图分析发现,1检测到A201S和F290V位点突变,未检测到G227A位点突变。所有种群A201S突变频率为8.4%,均为杂合突变;
F290V突变频率为40.6%,发生杂合突变和纯合突变,突变频率分别为25.7%和14.9%。F290V突变频率明显高于A201S,且与地域无明显相关性。

表1 2020—2021年草地贪夜蛾采集信息

表2 PCR扩增ace-1、vgsc和ryr所用引物
对种群的基因型分析发现,本研究测定的草地贪夜蛾种群的所有个体共有6种1基因型:(1)1未发生突变的野生型,占比29.8%;
(2)位点杂合突变独立发生,占比38.7%;
(3)位点纯合突变独立发生,占比14.6%;
(4)位点杂合突变独立发生,占比3.9%;
(5)位点杂合突变和F290V位点杂合突变同时发生,占比12.7%;
(6)位点杂合突变和F290V位点纯合突变同时发生占比极少,仅占0.2%。所有种群1发生突变的个体占比(存在A201S或F290V突变)为70.2%,其中2020年和2021年占比分别为72%和68.2%,同时发生A201S和F290V位点突变的个体占比为12.9%(表3)。
2.1.2 不同区域草地贪夜蛾种群1基因突变分析 不同地理区域的1基因突变情况显示,所有地区种群位点的突变频率均低于F290V位点的突变频率。山东种群F290V位点的突变频率最高,为66.7%,广西种群F290V位点的突变频率最低,为16.7%;
海南种群A201S位点的突变频率最高,为25%,广西种群A201S位点突变频率最低,未发生突变(图1)。

图1 草地贪夜蛾不同省区种群ace-1 A201S和F290V突变频率
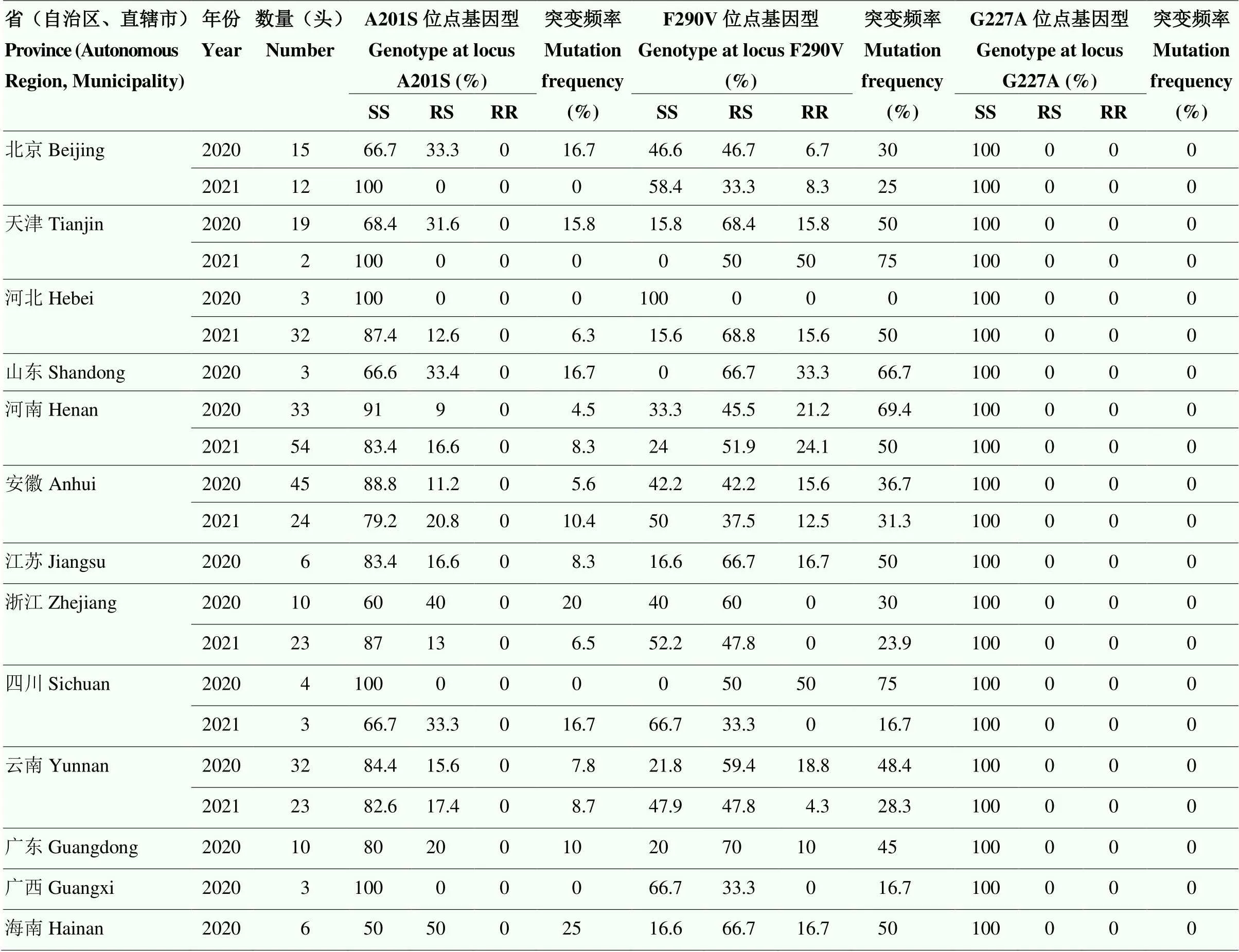
表3 2020—2021年草地贪夜蛾不同种群ace-1基因型及突变频率
SS:敏感型纯合子Susceptible homozygote;
RS:抗性杂合子Resistant heterozygote;
RR:抗性纯合子Resistant homozygote
3个生态区的1基因突变结果表明,重点防范区草地贪夜蛾种群A201S位点和F290V位点的突变频率分别为7.9%、44.6%;
迁飞过渡区突变频率分别为8.4%、34.2%;
周年繁殖区突变频率分别为9.7%、39.6%。重点防范区位点突变频率高于迁飞过渡区和周年繁殖区,而在A201S位点突变频率均低于两区(图2)。
4个防控带的1基因突变结果表明,长城防线种群A201S位点和F290V位点的突变频率分别为9%、41.6%;
黄淮海阻截攻坚带突变频率分别为6.9%、47%;
长江流域监测防控带突变频率分别为8.9%、34.7%;
西南华南监测防控带突变频率分别为9.1%、39%。长城防线、长江流域以及西南华南监测防控带A201S位点突变频率相近且较高,黄淮海阻截攻坚带突变频率较低。长城防线、黄淮海阻截攻坚带F290V位点突变频率高于长江流域和西南华南监测防控带(图2)。
2.1.3 不同年份草地贪夜蛾种群-1基因突变分析 2020年和2021年草地贪夜蛾A201S平均突变频率分别为9.3%和7.5%;
F290V平均突变频率分别为42.1%和39%(表3)。在2020年草地贪夜蛾种群中,四川种群F290V位点的突变频率最高,为75%,河北种群F290V位点的突变频率最低,未发生突变;
海南种群A201S位点的突变频率最高,为25%,河北、四川、广西种群A201S位点的突变频率最低,未发生突变。在2021年草地贪夜蛾种群中,天津种群F290V位点的突变频率最高,为75%,四川种群F290V位点的突变频率最低,为16.7%;
四川种群A201S位点的突变频率最高,为16.7%,北京、天津种群A201S位点的突变频率最低,未发生突变。

图2 3个生态区和4个防控带的草地贪夜蛾种群ace-1 A201S和F290V突变频率
2020年长城防线、黄淮海阻截攻坚带、长江流域监测防控带、西南华南监测防控带草地贪夜蛾种群在A201S位点的平均突变频率分别为14.9%、5.3%、8.3%、9.8%;
F290V位点的平均突变频率分别为37.8%、43.6%、39.8%、46.1%。2021年A201S位点在“四带”的平均突变频率分别为4.3%、8.3%、9%、8.7%;
F290V位点的平均突变频率分别为44.6%、50%、27%、28.3%(图3)。在长城防线A201S位点突变频率2021年较2020年下降,而F290V位点突变频率2021年较2020年上升;
黄淮海阻截攻坚带A201S和F290V位点突变频率2021年较2020年上升;
长江流域监测防控带和西南华南监测防控带A201S位点两年间突变频率无明显变化,F290V位点突变频率2021年较2020年有所下降。
2020年重点防范区、迁飞过渡区、周年繁殖区草地贪夜蛾种群在A201S位点的平均突变频率分别为9.5%、8.3%、9.8%;
F290V位点的平均突变频率分别为41.1%、39.8%、46.1%。2021年A201S位点在3个区域的平均突变频率分别为6.5%、8.5%、9.6%,F290V位点的平均突变频率分别为47.5%、27.7%、26.9%。重点防范区A201S位点突变频率2021年明显低于2020年,F290V位点突变频率2021年明显高于2020年;
迁飞过渡区和周年繁殖区A201S位点突变频率2021与2020年较为接近,F290V位点突变频率2021年的低于2020年。
国内不同种群已有测定结果表明A201S位点突变频率大多低于10%,最高为18%[35],F290V位点突变频率为25%—70%,最高达91.7%[26]。本研究中,A201S和F290V位点突变频率与国内及其他入侵非洲和亚洲国家的结果较接近,略高于原发地巴西等国[27,29,31]。2021年种群-1 A201S和F290V位点突变频率较2020年略有下降,但无显著性差异(图3)。

图3 2020—2021年3个生态区和4个防控带草地贪夜蛾种群ace-1 A201S和F290V突变频率差异
2.2 草地贪夜蛾种群vgsc和ryr基因型和突变频率分析
采用和的特异性引物对草地贪夜蛾样本DNA进行PCR扩增,经过琼脂糖凝胶电泳检测,362个样本和基因扩增情况:所有扩增样品均得到和预期片段大小一致的基因片段,其中基因片段长度为253、360 bp,未检测到T929I、L932F、L1014F及其他类型突变。基因片段长度764 bp,未发现I4734M、G4891E和其他类型突变。
3.1 草地贪夜蛾氨基甲酸酯类药剂靶标ace-1基因突变情况
本研究对2020—2021年13省(自治区、直辖市)的草地贪夜蛾田间种群氨基甲酸酯类药剂靶标基因1进行突变检测,发现A201S和F290V位点突变,未检测到G227A位点突变。其中F290V位点突变频率较高,A201S位点突变频率较低,所有地区种群位点的突变频率均低于F290V位点的突变频率,与国内2018—2019年18省种群抗药性结果相似[20,26-27,29]。本研究明确了长城防线种群3种杀虫剂靶基因的突变情况及与其他防控带种群的差异,长城防线A201S和F290V位点突变频率均较高,在制定防控策略时应予以重视。
本研究草地贪夜蛾种群与亚洲入侵种群(印度尼西亚、印度)和非洲入侵种群(肯尼亚、乌干达、马拉维、贝宁)在A201S和F290V位点的突变频率接近[31],推测国内草地贪夜蛾种群1基因突变可能是从非洲携带而来,且未来非洲当地的选择压力可能会迅速增加这些抗性突变的频率[26]。毒力测定结果也表明国外及入侵中国的草地贪夜蛾对氨基甲酸酯类杀虫剂抗性较高[35-39],国内目前较少使用该类药剂防控草地贪夜蛾,该靶标基因的检出和频率主要与虫源地的抗性频率相关。有研究表明巴西的草地贪夜蛾种群抗性突变频率较早期变低,这可能与经过连年抗性治理且该药使用频次减少有关[9,31]。此外在G227A位点除巴西种群外,国内外其他种群极少发生突变[20,26]。
3.2 草地贪夜蛾拟除虫菊酯类靶标vgsc基因突变情况
本研究草地贪夜蛾种群均未检测到T929I、L932F和L1014F靶标位点和其他位点的突变。自草地贪夜蛾入侵我国以来,国内已报道的不同省份数千头样品均未发现L932位点突变,T929和L1014位点抗性基因突变频率极低,T929位点仅检测到云南2头和广东1头有抗性杂合子,抗性基因突变频率为0.2%(3/727头);
在L1014位点,仅云南2头和广东2头检测到抗性纯合子,抗性基因突变频率为0.4%(4/929)[27-28]。国外对原产地美洲(美国、巴西、墨西哥)和入侵地区非洲、亚洲等不同国家的多个种群的分析发现基因突变频率很低,仅印尼种群和巴西室内种群的2头个体(2/396头)在T929和L1014位点有突变[31],这可能与田间杀虫剂剂量选择压力不足以引起群体普遍突变,而优先选择个体携带突变有关[40]。
3.3 草地贪夜蛾双酰胺类靶标ryr基因突变情况
本研究中草地贪夜蛾种群均未检测到基因突变,目前田间种群G4891E和I4734M(鳞翅目部分种类位置为G4946E和I4790M,本文均用G4891E和I4734M表示)突变检出频率低,国内仅2019年在周年繁殖区广西和迁飞过渡区贵州检测到I4734位点极低频率的突变(各1个个体),突变频率分别为1.7%和1.4%,且该突变种群对双酰胺类药剂的敏感性显著降低[14]。来自美洲、非洲、亚洲等多个国家不同种群并未检测到草地贪夜蛾G4891E和I4734M突变[17,26,29-31],田间种群基因突变频率低。整体而言,仅室内药剂筛选抗性种群检测到低频的I4743M突变,可能与抗性发生的频率过低有关[17]。
通过实验室引入突变,发现I4734M突变型与5种双酰胺类杀虫剂的亲和力与自然种群无明显差别,但G4891E突变型亲和力下降,进一步表明G4891E突变会导致草地贪夜蛾对双酰胺类药剂产生抗性[21]。巴西和中国部分田间种群对该类药剂已产生一定水平抗性,但未导致G4891E和I4734M位点突变[13]。但鳞翅目其他害虫包括草地贪夜蛾近缘种甜菜夜蛾()这两个位点的靶标突变较为常见[22],草地贪夜蛾与国内近缘种甜菜夜蛾生态位重叠,有基因渗入的潜在生态安全威胁[41]。
3.4 草地贪夜蛾对3类杀虫剂的抗性机理
目前草地贪夜蛾对氨基甲酸酯类、拟除虫菊酯类和双酰胺类药剂的抗性机理研究结果表明,其主要均以靶标抗性为主[8,11,17,31],田间种群对氨基甲酸酯类药剂的抗性主要表现为靶标基因1的A201S和F290V突变。本研究结果与前人研究一致[35-39]。草地贪夜蛾对拟除虫菊酯类药剂靶标抗性机理以的T929、L932和L1014突变为主;
对双酰胺类药剂以G4946E和I4790M的突变频率最高。本研究草地贪夜蛾各种群中未检测到和相关位点突变,但在其近缘种甜菜夜蛾中拟除虫菊酯类和双酰胺类药剂的部分靶标突变较为普遍(数据未发表),推测草地贪夜蛾对3类药剂靶标抗性突变的差异可能与氨基甲酸酯类药剂长时间大范围使用,而拟除虫菊酯和双酰胺类药剂防控草地贪夜蛾使用频次较低用药策略较为科学有关[6-8,17,42];
另外可能与草地贪夜蛾对3类杀虫剂抗性均为常染色体不完全隐性遗传,其抗性形成速度比显性遗传要慢一些,且抗性种群衰退速度较慢有关[7]。
国内外部分种群生物测定结果表明草地贪夜蛾对氨基甲酸酯类和拟除虫菊酯药剂已产生中至高水平抗性[38],其对氨基甲酸酯类药剂解毒作用增强和乙酰胆碱酯酶敏感性下降,说明其代谢抗性也起到了重要作用[7,16,38-40,43]。拟除虫菊酯类药剂抗性种群表达量降低[25,44],双酰胺类抗性种群的mRNA表达量发生了变化[13,25],说明草地贪夜蛾对3类药剂可能存在靶标突变和由靶标基因表达水平及mRNA表达量的变化导致的药剂敏感性降低等多种抗性机理。为实现草地贪夜蛾的可持续控制,应长期开展生物测定和基于基因组学的分子诊断,为草地贪夜蛾抗性治理提供依据[20,25-29,45-50]。
对2020—2021年采自我国13省(自治区、直辖市)的362头草地贪夜蛾田间种群进行了3类杀虫剂靶标基因的突变检测,发现氨基甲酸酯类靶标基因1上存在突变,种群有6种1基因型。位点发生杂合突变,F290V位点发生杂合和纯和突变,未检测到G227A位点突变。突变频率与国内种群迁飞路径和地域分布无明显关联,长城防线种群A201S和F290V突变频率在“四带”中均处于较高水平。2021年种群和F290V位点突变频率较2020年种群略有下降,但无显著性差异。本研究未检测到和的突变。综上,氨基甲酸酯类杀虫剂应尽可能减少使用,拟除虫菊酯类和双酰胺类杀虫剂可与其他作用机理药剂科学轮换用于草地贪夜蛾的防控,同时应持续开展抗药性监测。
致谢:相关省(市)的植保部门同仁不辞辛苦,帮助采集样品,在此表示感谢!
[1] 郭井菲, 赵建周, 何康来, 张峰, 王振营. 警惕危险性害虫草地贪夜蛾入侵中国. 植物保护, 2018, 44(6): 1-10.
GUO J F, ZHAO J Z, HE K L, ZHANG F, WANG Z Y. Potential invasion of the crop-devastating insect pest fall armywormto China. Plant Protection, 2018, 44(6): 1-10. (in Chinese)
[2] 陈辉, 杨学礼, 谌爱东, 李永川, 王德海, 刘杰, 胡高. 我国最早发现为害地草地贪夜蛾的入侵时间及其虫源分布. 应用昆虫学报, 2020, 57(6): 1270-1278.
CHEN H, YANG X L, CHEN A D, LI Y C, WANG D H, LIU J, HU G. Immigration timing and origin of the first fall armyworms () detected in China. Chinese Journal of Applied Entomology, 2020, 57(6): 1270-1278. (in Chinese)
[3] 吴秋琳, 姜玉英, 刘媛, 刘杰, 马景, 胡高, 杨明进, 吴孔明. 草地贪夜蛾在中国西北地区的迁飞路径. 中国农业科学, 2022, 55(10): 1949-1960.
WU Q L, JIANG Y Y, , LIU Y, LIU J, MA J, HU G, YANG M J, WU K M. Migration pathway ofin Northwestern China. Scientia Agricultura Sinica, 2022, 55(10): 1949-1960. (in Chinese)
[4] 秦誉嘉, 蓝帅, 赵紫华, 孙宏禹, 朱晓明, 杨普云, 李志红. 迁飞性害虫草地贪夜蛾在我国的潜在地理分布. 植物保护, 2019, 45(4): 43-47, 60.
QIN Y J, LAN S, ZHAO Z H, SUN H Y, ZHU X M, YANG P Y, LI Z H. Potential geographical distribution of the fall armyworm () in China. Plant Protection, 2019, 45(4): 43-47, 60. (in Chinese)
[5] 王亚如, 蔡香云, 王锦达, 汤宝珍, 侯有明. 重大入侵害虫草地贪夜蛾的研究进展. 环境昆虫学报, 2020, 42(4): 806-816.
WANG Y R, CAI X Y, WANG J D, TANG B Z, HOU Y M. Current opinions on the important alien invasive insect,. Journal of Environmental Entomology, 2020, 42(4): 806-816. (in Chinese)
[6] OKUMA D M, BERNARDI D, HORIKOSHI R J, BERNARDI O, SILVA A P, OMOTO C. Inheritance and fitness costs of(Lepidoptera: Noctuidae) resistance to spinosad in Brazil. Pest Management Science, 2018, 74(6): 1441-1448.
[7] 李永平, 张帅, 王晓军, 解晓平, 梁沛, 张雷, 谷少华, 高希武. 草地贪夜蛾抗药性现状及化学防治策略. 植物保护, 2019, 45(4): 14-19.
LI Y P, ZHANG S, WANG X J, XIE X P, LIANG P, ZHANG L, GU S H, GAO X W. Current status of insecticide resistance inand strategies for its chemical control. Plant Protection, 2019, 45(4): 14-19. (in Chinese)
[8] BURTET L M, BERNARDI O, MELO A A, PES M P, STRAHL T T, GUEDES J V. Managing fall armyworm,(Lepidoptera: Noctuidae), with Bt maize and insecticides in southern Brazil. Pest Management Science, 2017, 73(12): 2569-2577.
[9] CARVALHO R A, OMOTO C, FIELD L M, WILLIAMSON M S, BASS C. Investigating the molecular mechanisms of organophosphate and pyrethroid resistance in the fall armyworm. Plos One, 2013, 8(4): e62268.
[10] DIEZ-RODRGUEZ G I, OMOTO C. Inheritance of lambda-cyhalothrin resistance in(J. E. Smith) (Lepidoptera: Noctuidae). Neotropical Entomology, 2001, 30(2): 311-316.
[11] DO NASCIENCEMENTO A R, FARIAS J R, BERNARDI D, HORIKOSHI R J, OMOTO C. Genetic basis of(Lepidoptera: Noctuidae) resistance to the chitin synthesis inhibitor lufenuron. Pest Management Science, 2016, 72(4): 810-815.
[12] 吴益东, 沈慧雯, 张正, 王兴亮, 施雨, 武淑文, 杨亦桦. 草地贪夜蛾抗药性概况及其治理对策. 应用昆虫学报, 2019, 56(4): 599-604.
WU Y D, SHEN H W, ZHANG Z, WANG X L, SHI Y, WU S W, YANG Y H. Current status of insecticide resistance inand counter measures to prevent its development. Chinese Journal of Applied Entomology, 2019, 56(4): 599-604. (in Chinese)
[13] LIRA E C, BOLZAN A, NASCIMENTO A R, AMARAL F S, KANNO R H, KAISER I S, OMOTO C. Resistance of(Lepidoptera: Noctuidae) to spinetoram: inheritance and cross-resistance to spinosad. Pest Management Science, 2020, 76(8): 2674-2680.
[14] LV S L, SHI Y, ZHANG J C, LIANG P, ZHANG L, GAO X W. Detection of ryanodine receptor target-site mutations in diamide insecticide-resistantin China. Insect Science, 2021, 28(3): 639-648.
[15] BOLZAN A, PADOVEZ F E, NASCIMENTO A R, KAISER I S, LIRA E C, AMARAL F S, KANNO R H, MALAQUIAS J B, OMOTO C. Selection and characterization of the inheritance of resistance of(Lepidoptera: Noctuidae) to chlorantraniliprole and cross-resistance to other diamide insecticides. Pest Management Science, 2019, 75(10): 2682-2689.
[16] GUTIÉRREZ-MORENO R, MOTA-SANCHEZ D, BLANCO C A, WHALON M E, TERÁN-SANTOFIMIO H, RODRIGUEZ-MACIEL J C, DIFONZO C. Field-evolved resistance of the fall armyworm (Lepidoptera: Noctuidae) to synthetic insecticides in Puerto Rico and Mexico. Journal of Economic Entomology, 2019, 112(2): 792-802.
[17] BOAVENTURA D, BOLZAN A, PADOVEZ F E, OKUMA D M, OMOTO C, NAUEN R. Detection of a ryanodine receptor target-site mutation in diamide insecticide resistant fall armyworm,. Pest Management Science, 2020, 76(1): 47-54.
[18] BOAVENTURA D, BUER B, HAMAEKERS N, MAIWALD F, NAUEN R. Toxicological and molecular profiling of insecticide resistance in a Brazilian strain of fall armyworm resistant to Bt Cry1 proteins. Pest Management Science, 2021, 77(8): 3713-3726.
[19] DONG K, DU Y, RINKEVICH F, NOMURA Y, XU P, WANG L, SILVER K, ZHOROV B S. Molecular biology of insect sodium channels and pyrethroid resistance. Insect Biochemistry and Molecular Biology, 2014, 50: 1-17.
[20] YAINNA S, NÈGRE N, SILVIE P J, BRÉVAULT T, TAY W T, GORDON K, DALENÇON E, WALSH T, NAM K. Geographic monitoring of insecticide resistance mutations in native and invasive populations of the fall armyworm. Insects, 2021, 12(5): 468.
[21] 李康, 王凯博, 陶丽红, 李丽, 李佳俊, 吴文伟, 肖春, 叶敏. 草地贪夜蛾鱼尼丁受体与双酰胺类杀虫剂的结合模式及抗性风险分析. 农药学学报, 2021, 23(5): 856-868.
LI K, WANG K B, TAO L H, LI L, LI J J, WU W W, XIAO C, YE M. Analysis of binding modes and resistance risk between ryanodine receptor ofand diamide insecticides. Chinese Journal of Pesticide Science, 2021, 23(5): 856-868. (in Chinese)
[22] RICHARDSON E B, TROCZKA B J, GUTBROD O, EMYR DAVIES T G, NAUEN R. Diamide resistance: 10 years of lessons from lepidopteran pests. Journal of Pest Science, 2020, 93(3): 911-928.
[23] ZUO Y, WANG H, XU Y, HUANG J, WU S, WU Y, YANG Y. CRISPR/Cas9 mediated G4946E substitution in the ryanodine receptor ofconfers high levels of resistance to diamide insecticides. Insect Biochemistry and Molecular Biology, 2017, 89: 79-85.
[24] GUO L, LIANG P, ZHOU X, GAO X. Novel mutations and mutation combinations of ryanodine receptor in a chlorantraniliprole resistant population of(L.). Science Reports, 2014, 4: 6924.
[25] 李芬, 王力奎, 彭正强, MALHAT F, 吕宝乾, 吴少英. 菊酯类药剂对草地贪夜蛾的毒力及对钠离子通道的诱导特性. 植物保护学报, 2020, 47(4): 884-890.
LI F, WANG L K, PENG Z Q, MALHAT F, LÜ B Q, WU S Y. Toxicity of pyrethroid pesticides to fall armywormand its inducing properties of sodium ion channels. Journal of Plant Protection, 2020, 47(4): 884-890. (in Chinese)
[26] GUAN F, ZHANG J, SHEN H, WANG X, PADOVAN A, WALSH T K, TAY W T, GORDON K H J, JAMES W, CZEPAK C, OTIM M H, KACHIGAMBA D, WU Y. Whole-genome sequencing to detect mutations associated with resistance to insecticides and Bt proteins in. Insect Science, 2021, 28(3): 627-638.
[27] 郭志敏, 邓晓倩, 李静, 袁茂钧, 万虎, 李建洪, 马康生. 湖北四个地区草地贪夜蛾田间种群的杀虫剂敏感性及靶标突变检测. 昆虫学报, 2020, 63(5): 582-589.
GUO Z M, DENG X Q, LI J, YUAN M J, WAN H, LI J H, MA K S. Detection of insecticide sensitivity and target site mutations in field populations of(Lepidoptera: Noctuidae) in four regions of Hubei, central China. Acta Entomologica Sinica, 2020, 63(5): 582-589. (in Chinese)
[28] 李妍. 2019-2020年我国16省份草地贪夜蛾对高效氯氟氰菊酯和茚虫威抗性水平监测[D]. 北京: 中国农业科学院, 2021.
LI Y. Monitoring of resistance level ofto lambda-cyhalothrin and indoxacarb in 16 provinces of China from 2019 to 2020[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021. (in Chinese)
[29] ZHANG L, LIU B, ZHENG W, LIU C, ZHANG D, ZHAO S, LI Z, XU P, WILSON K, WITHERS A,. Genetic structure and insecticide resistance characteristics of fall armyworm populations invading China. Molecular Ecology Resources, 2020, 20(6): 1682-1696.
[30] 殷畅, 毕莹莹, 韩丽君, 范志金, 宋霜雨, 秦发艺. 双酰胺类杀虫剂作用机制及其先导优化研究进展. 世界农药, 2021, 43(2): 15-33.
YIN C, BI Y Y, HAN L J, FAN Z J, SONG S Y, QIN F Y. Research progress on action mechanism and lead optimization of diamide insecticides. World Pesticides, 2021, 43(2): 15-33. (in Chinese)
[31] BOAVENTURA D, MARTIN M, POZZEBON A, MOTA-SANCHEZ D, NAUEN R. Monitoring of target-site mutations conferring insecticide resistance in. Insects, 2020, 11(8): 545.
[32] 中华人民共和国农业农村部. 农业农村部关于印发《全国草地贪夜蛾防控方案》的通知 (农农发[2019]3号). (2019-06-21) [2022-06-28].
Ministry of Agriculture and Rural Affairs of the People’s Republic of China. Notice of Ministry of Agriculture and Rural Affairs on the national plan for the prevention and control ofin China. (NongNongFa [2019] No. 3). (2019-06-21) [2022-06-28]. (in Chinese)
[33] 中华人民共和国农业农村部种植业管理司. 农业农村部种植业管理司关于落实草地贪夜蛾“三区三带”布防任务的通知 (农农植保[2020]12号). (2020-04-28) [2022-06-28].
Department of Crop Management, Ministry of Agriculture and Rural Affairs of the People’s Republic of China. Notice of Department of Crop Management of Ministry of Agriculture and Rural Affairs on the implementation of the “three regions and three zones” deployment task of(Nongnong Plant Protection [2020] No. 12). (2020-04-28) [2022-06-28]. (in Chinese)
[34] 中华人民共和国农业农村部种植业管理司. 农业农村部种植业管理司关于落实草地贪夜蛾“长城防线”布防任务的通知 (农农植保[2020]18号). (2020-06-02) [2022-06-28].
Department of Crop Management, Ministry of Agriculture and Rural Affairs of the People’s Republic of China. Notice of Department of Crop Management of Ministry of Agriculture and Rural Affairs on the implementation of the “Great Wall defense” deployment task of(Nongnong Plant Protection [2020] No. 18) . (2020-06-02) [2022-06-28]. (in Chinese)
[35] 李妍, 龚丽凤, 王欢欢, 李曦, 孙歌, 谷少华, 梁沛, 高希武. 我国草地贪夜蛾田间种群有机磷和氨基甲酸酯类杀虫剂靶标基因-1的基因型和突变频率. 昆虫学报, 2020, 63(5): 574-581.
LI Y, GONG L F, WANG H H, LI X, SUN G, GU S H, LIANG P, GAO X W. Genotype and mutation frequency of-1, the target gene of organophosphorus and carbamate insecticides, in field populations of(Lepidoptera: Noctuidae) in China. Acta Entomologica Sinica, 2020, 63(5): 574-581. (in Chinese)
[36] WALSH S B, DOLDEN T A, MOORES G D, KRISTENSEN M, LEWIS T, DEVONSHIRE A L, WILLIAMSON M S. Identification and characterization of mutations in housefly () acetylcholinesterase involved in insecticide resistance. The Biochemical Journal, 2001, 359(6): 175-181.
[37] 赵胜园, 孙小旭, 张浩文, 杨现明, 吴孔明. 常用化学杀虫剂对草地贪夜蛾防效的室内测定. 植物保护, 2019, 45(3): 10-14, 20.
ZHAO S Y, SUN X X, ZHANG H W, YANG X M, WU K M. Laboratory test on the control efficacy of common chemical insecticides against. Plant Protection, 2019, 45(3): 10-14, 20. (in Chinese)
[38] ZHANG D D, XIAO Y T, XU P J, YANG X M, WU Q L, WU K M. Insecticide resistance monitoring for the invasive populations of fall armyworm,in China. Journal of Integrative Agriculture, 2021, 20(3): 783-791.
[39] YU S J. Insensitivity of acetylcholinesterase in a field strain of the fall armyworm,(J. E. smith). Pesticide Biochemistry and Physiology, 2006, 84(2): 135-142.
[40] SUPYOON K, SYMINGTON S B, HYEOCK LEE S, SODERLUND D M, MARSHALL CLARK J. Three mutations identified in the voltage-sensitive sodium channel alpha-subunit gene of permethrin- resistant human head lice reduce the permethrin sensitivity of house fly Vssc1 sodium channels expressed in. Insect Biochemistry and Molecular Biology, 2008, 38(6): 296-306.
[41] 魏向敏, 崔勇, 叶国浚, 朱克森, 相辉. 草地贪夜蛾寄主适应性、种群动态特征及防控新思路展望. 环境昆虫学报, 2020, 42(1): 42-51.
WEI X M, CUI Y, YE G J, ZHU K S, XIANG H. On the host adaptability, population dynamics of: Advances and prospect in efficient control. Journal of Environmental Entomology, 2020, 42(1): 42-51. (in Chinese)
[42] 全国农业技术推广服务中心. 草地贪夜蛾应急防治药剂科学使用指导意见. (2020-03-05) [2022-06-28].
National Agricultural Technology Extension Service Center. Guidance on scientific use of emergency control agents of. (2020-03-05) [2022-06-28]. (in Chinese)
[43] YU S J, MCCORD E. Lack of cross-resistance to indoxacarb in insecticide-resistant(Lepidopera: Noctuidae) and(Lepidopera: Yponomeutidae). Pest Management Science, 2007, 63(1): 63-67.
[44] ZHAO Y X, HUANG J M, NI H, GUO D, YANG F X, WANG X, WU S F, GAO C F. Susceptibility of fall armyworm,(J. E. Smith), to eight insecticides in China, with special reference to lambda-cyhalothrin. Pesticide Biochemistry and Physiology, 2020, 168: 104623.
[45] LIANG J G, ZHANG D G, LI D Y, ZHAO S Y, WANG C Y, XIAO Y T, XU D, YANG Y Z, LI G P, WANG L L,. Expression profiles of Cry1Ab protein and its insecticidal efficacy against the invasive fall armyworm for Chinese domestic GM maize DBN9936. Journal of Integrative Agriculture, 2021, 20(3): 792-803.
[46] 王思彤, 陈艳, 罗雨嘉, 杨缘缘, 蒋志洋, 蒋鑫怡, 钟樊, 陈好, 徐红星, 吴俨, 段红霞, 唐斌. 三种新型化合物对草地贪夜蛾海藻糖与几丁质代谢及生长发育的影响. 中国农业科学, 2022, 55(8): 1568-1578.
WANG S T, CHEN Y, LUO Y J, YANG Y Y, JIANG Z Y, JIANG X Y, ZHONG F, CHEN H, XU H X, WU Y, DUAN H X, TANG B. Effect of three novel compounds on trehalose and chitin metabolism and development of. Scientia Agricultura Sinica, 2022, 55(8): 1568-1578. (in Chinese)
[47] QIN C, WANG C H, WANG Y Y, SUN S Q, WANG H H, XUE C B. Resistance to diamide insecticides in(Lepidoptera: Plutellidae): Comparison between lab-selected strains and field- collected populations. Journal of Economic Entomology, 2018, 111(2): 853-859.
[48] KULYE M, MEHLHORN S, BOAVENTURA D, GODLEY N, VENKATESH S K, RUDRAPPA T, CHARAN T, RATHI D, NAUEN R. Baseline susceptibility ofpopulations collected in india towards different chemical classes of insecticides. Insects, 2021, 12(8): 758.
[49] ARIAS O, CORDEIRO E, CORRÊA A S, DOMINGUES F A, GUIDOLIN A S, OMOTO C. Population genetic structure and demographic history of(Lepidoptera: Noctuidae): implications for insect resistance management programs. Pest Management Science, 2019, 75(11): 2948-2957.
[50] 崔丽, 芮昌辉, 李永平, 王芹芹, 杨代斌, 闫晓静, 郭永旺, 袁会珠. 国外草地贪夜蛾化学防治技术的研究与应用. 植物保护, 2019, 45(4): 7-13.
CUI L, RUI C H, LI Y P, WANG Q Q, YANG D B, YAN X J, GUO Y W, YUAN H Z. Research and application of chemical control technology against(Lepidoptera: Noctuidae) in foreign countries. Plant Protection, 2019, 45(4): 7-13. (in Chinese)
Mutation Analysis of Insecticide Target Genes in Populations ofin China
WANG ShuaiYu1, ZHANG ZiTeng1,2, XIE AiTing1, DONG Jie1, YANG JianGuo1, ZHANG AiHuan2
1Beijing Plant Protection Station, Beijing 100029;2College of Bioscience and Resource Environment,Beijing University of Agriculture/Key Laboratory of Urban Agriculture (North China), Ministry of Agriculture and Rural Affairs, Beijing 102206
【Background】The fall armyworm () is a major migratory agricultural pest in the tropical and subtropical areas of America, it has rapidly expanded to more than 100 countries around the world since 2016, and has now invaded 27 provinces (Autonomous Region, Municipality) in China, posing a great threat to food security. Resistance may become an increasingly serious problem in many regions with the heavy reliance on insecticides for several years and lead to low control efficiency.had spread to the north of the Great Wall rapidly. However, there are few studies on insecticide resistance and annual variation in China, especially the Great Wall protection zone in 2020 and 2021.【Objective】The objective of this study is to clarify the susceptibility and differences ofpopulations to insecticides in the Great Wall protection zone and other areas of China, and to provide guidance for scientific insecticide use for the prevention and control of.【Method】Samples ofwere collected from maize fields in 13 provinces (Autonomous Region, Municipality) in China, and the genomic DNA was extracted. The mutations of target genes of carbamate, pyrethroid and diamide insecticides in 362 individuals collected from 47 cities (districts) of 13 provinces (Autonomous Region, Municipality) in 2020 and 2021 were analyzed through direct sequencing of the PCR products individually.【Result】There were 6 genotypes of mutations in-1 to carbamate insecticides in all the samples. A201S and F290V mutations were detected in-1. The frequency of A201S heterozygous mutation was 8.4%, and the frequency of F290V homozygous and heterozygous mutations was 14.9% and 25.7%, respectively. No G227A mutation was detected. The mutation frequency at F290V in the key prevention region was higher than that in the migratory transition region and annual breeding region, while the mutation frequency at A201S was lower than that in the above two regions. The average frequency of-1 mutation was high in the Great Wall protection zone, Huang-Huai-Hai interception zone, Yangtze River Basin and southwest and South China protection zone. There was no significant difference in the frequency of-1 mutation between the populations in 2021 and 2020. No mutations were detected in pyrethroidand diamide.【Conclusion】A201S and F290V mutations with high frequency in-1 is one of the mechanisms conferring carbamate resistance in many populations in China. The use of carbamates should be restricted in the control of. No mutations had been detected in theand, suggesting susceptibility to pyrethroids and diamides for rational rotation, however, the low frequency of mutation inand common mutation in(relatives of) to pyrethroids and diamides have been detected. In the future, the effect of high insecticide selection stress in the lab and field populations fed by different hosts on the target gene mutation should be evaluated, and the research of rapid diagnostics methods and products of insecticide resistance should be accelerated.
; insecticide resistance; carbamate; pyrethroid; diamide; target gene; mutation frequency

10.3864/j.issn.0578-1752.2022.20.007
2022-06-28;
2022-07-20
2021年北京市农药减量监测评价项目(PXM2021_036203_000019)
王帅宇(通信作者),E-mail:shuaiyu3@126.com。通信作者张爱环,E-mail:zhangaihuan@126.com
(责任编辑 岳梅)
猜你喜欢 靶标夜蛾杀虫剂 The great monarch migrations疯狂英语·新读写(2022年1期)2022-11-23纳米载体可缓解农药对靶标作物的负作用今日农业(2022年4期)2022-11-16第七讲 草地贪夜蛾的迁飞及监测预警云南农业(2021年11期)2021-11-12开展草地贪夜蛾监测员培训会">忻府区:开展草地贪夜蛾监测员培训会今日农业(2021年9期)2021-07-28“百灵”一号超音速大机动靶标军民两用技术与产品(2021年10期)2021-03-16侯马市 采取果断措施开展对草地贪夜蛾统防统治今日农业(2020年17期)2020-12-15科学认知草地贪夜蛾 打赢防控攻坚战今日农业(2020年13期)2020-12-15药物靶标作用关系预测结果评价及查询验证计算机研究与发展(2019年9期)2019-09-16靶标评改,让习作评改有序更有效师道·教研(2019年7期)2019-08-13跟踪导练(一)3时代英语·高一(2019年1期)2019-03-13推荐访问:夜蛾 靶标 种群
推荐文章
- 2018年江西赣州市医疗急救中心招聘编外人员公告:赣州市医疗急救中心
- 升学宴策划活动方案|2018升学宴活动方案
- 小学六一游园活动总结 [小学六一游园活动策划]
- 2018年中国工商银行广东分行暑期实习生招聘岗位、报名时间:2018中国工商银行广西分行春招
- 澳洲留学八大名校排名申请条件_澳洲留学奖学金申请条件及时间
- [调工商档案介绍信范文] 工商档案查询介绍信
- 加拿大亲属移民政策最新更新|加拿大亲属移民条件
- 初一下册语文练习册答案人教版2018 2018人教版语文练习册答案
- 贵州贵阳房价2018 2018年贵州贵阳中医学院第二附属医院招聘方案
- 【2018广东省湛江市赤坎区审计局招聘公告】2018湛江市赤坎区教师招聘