藏羊HSP27基因真核表达体系的构建及纯化产物的鉴定
来源:优秀文章 发布时间:2023-01-15 点击:
谢 雯,张春梅,任 昊,张怀霞,张莹莹,陈 倩,贾建磊*
(1.青海大学农牧学院,青海 西宁 810016;
2.青海大学实验管理处,青海 西宁 810016)
热休克蛋白27(Heat Shock Protein 27,HSP27)是小分子热休克蛋白亚家族的重要一员,是高温等应激因素诱导产生的蛋白[1],具有抗细胞凋亡和调节F-肌动蛋白活性等功能[2],其主要通过抗细胞凋亡和调节信号传导来参与机体的多种复杂生理过程。
颗粒细胞为卵母细胞发育提供营养物质和能量[3-4]。HSP27蛋白是卵泡发育过程中产生的第一类蛋白,能在卵泡内的颗粒细胞层中表达[5-6]。HSP27基因在哺乳动物卵泡发育过程中通过介入到细胞凋亡信号通路直接干扰细胞凋亡,通过影响下丘脑促性腺激素释放激素(Gonadotropin-releasing hormone,GnRH)、垂体促性腺激素中的促卵泡激素(Follicle Stimulating Hormone,FSH)和促黄体生成素(Luteinizing Hormone,LH)对卵巢颗粒细胞或膜细胞的调节,进而调控哺乳动物卵泡发育及排卵过程[7]。因此,HSP27蛋白可以通过抑制颗粒细胞的凋亡来促进卵母细胞成熟[8]。
目前,对于HSP27基因的研究主要集中在运用分子遗传学和DNA分子遗传标记技术探索母体繁殖障碍疾病的作用机制,Shochet等[9]、Bahr等[10]研究发现HSP27蛋白的磷酸化会影响胎儿生长受限期间的胎盘发育;
Hromadnikova等[11]研究发现sHSP的mRNA水平能反映母体对妊娠相关并发症的应激反应程度。关于HSP27基因在颗粒细胞凋亡及卵母细胞成熟中的研究较少,因此本文以三大原始绵羊品种之一的藏羊为研究对象,构建HSP27基因真核表达体系,通过生物信息学分析并预测HSP27基因及其相互作用网络在藏羊卵巢卵母细胞成熟过程中的作用通路,从分子生物学角度分析了HSP27基因对藏羊产羔性状作用通路的影响,为提高藏羊产羔率提供理论依据。
1.1 试验材料
试验用成年健康经产高原型藏母羊5只(3~4岁),购自青海省海南藏族自治州共和县哇玉香咔梅哚牧业有限公司,屠宰后采集两侧卵巢,剥离卵巢周围表面韧带及组织脂肪,无菌水冲洗后置于液氮中带回实验室,-80 ℃保存。
1.2 试验方法
1.2.1HSP27基因PCR扩增及克隆 根据GenBank上提交的HSP27全基因mRNA的碱基序列(登录号:NC_037352.1),运用Primer Premier 5.0软件设计HSP27基因编码区PCR引物(表1)。引物由生工生物工程(上海)股份有限公司合成。

表1 目的基因引物序列
将藏羊卵巢总RNA提取后反转录为cDNA,进行PCR扩增,产物用1%的琼脂糖凝胶电泳检测。扩增体系20 μL:模板cDNA(50 mg/μL)1.5 μL,Taq PCR预混酶2.0 μL,上、下游引物(100 μmol/L)各0.5 μL,PCR Loading Buffer 2.5 μL,dNTP(2.5 mmol/L)2.0 μL,ddH2O 11.0 μL(TransGen Biotech PerfectStart Uni RT&qPCR kit)。扩增条件:95 ℃预变性4 min;
95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,30个循环;
72 ℃保持10 min。使用T4 DNA连接酶将纯化的PCR产物连接到pMD19-T中,过夜(4 ℃)构建重组质粒,将重组质粒转化至DH5α感受态细胞中,将得到的菌液通过分区划线法培养在含卡那抗性的LB固体培养基上,过夜(37 ℃)培养。挑取白色斑点转移至具有氨苄抗性的LB液体培养基中培养(37 ℃,过夜),通过PCR筛选阳性克隆,送生工生物工程(上海)股份有限公司测序。
1.2.2HSP27基因真核表达体系的构建与单克隆抗体的制备 将pcDNA3.1a真核表达质粒载体和构建的pMD19-T-HSP27克隆载体进行双酶切(XhoI、KpnI),用连接酶连接目的基因片段和空载体后转化至DH5α感受态细胞中,冰浴30 min;
热激(42 ℃)90 s,冰浴1 min;
加入1 mL液体LB培养基于摇床培养(37 ℃,180 r/min,1.5 h),取菌液涂布于含卡那抗性的LB固体培养基,过夜(37 ℃)培养,挑取白色斑点,通过PCR筛选阳性克隆,送生工生物工程(上海)股份有限公司测序。
在含有10%胎牛血清的Grace′s培养基中培养Sf 9昆虫细胞;
将重组质粒转染于Sf 9昆虫细胞,在28 ℃条件下培养,当细胞“病变”超过80%时分别收集上清液和沉淀,用SDS-PAGE凝胶电泳检测,利用蛋白纯化试剂盒进行重组蛋白的纯化。
以重组HSP27蛋白为抗原免疫Bal b/c 6~8周龄雌性小鼠,末次免疫后取小鼠的血清进行ELISA抗体检测,选择抗体效价最高的小鼠脾细胞与SP 2/0骨髓瘤细胞进行融合,融合后待杂交瘤细胞长至96孔板的1/4时,用已建立的间接ELISA法对所有孔进行检测,选择检测结果呈阳性的孔,用有限稀释法进行2~3次亚克隆,直至抗体阳性率达到100%时扩大培养并冻存。

图1藏羊卵巢总 RNA 提取图Fig.1Extraction of total RNA from sheep ovary图2HSP27基因PCR扩增图Fig.2PCR amplification of HSP27 gene
1.2.3 重组HSP27蛋白相互作用蛋白的鉴定及生物信息学分析 在4 ℃条件下,用500 μL的0.5% NP40裂解缓冲液裂解母羊卵巢30 min;
将沉淀物在PBS中洗涤2次后在4 ℃条件下用500 μL的1% NP40裂解缓冲液裂解,并用水浴超声波仪(2级)处理(4个循环);
将3 mg总蛋白加入50 μg IgA进行免疫沉淀;
将单独表达空载体的Sf 9细胞用作阴性对照。用Expasy和NetPhos 3.1 Server在线软件分析预测目的蛋白的氨基酸含量和磷酸化位点,Bio-rad电泳仪进行双向电泳,Q Exactive质谱仪与Easy nLC系统鉴定目的蛋白,以试验组和对照组蛋白差异倍数的绝对值(≥3)为筛选条件来鉴定差异蛋白。利用Wolf PSORT预测互作蛋白的亚细胞定位,结合NCBI数据库,利用GENEMANIA软件及Uniprot(http://www.uniprot.org/)数据库对目的蛋白进行基本性质分析。
2.1 藏羊HSP27基因的克隆与鉴定
藏羊卵巢总RNA提取图可见清晰的两条带(28S与18S)(图1),提取效果较好,可直接用于反转录。用反转录PCR扩增HSP27基因编码区序列,扩增片段与目的片段大小一致(618 bp)且特异性良好(图2),结合NCBI数据库中的BLAST软件在线对比,扩增所得序列与参考序列的一致性达99.72%,可判定扩增序列为藏羊的HSP27基因序列。将扩增序列与pMD19-T载体进行连接,并将连接产物转化至DH5α感受态细胞中,培养后挑选菌落使用限制性内切酶XhoI、KpnI 做酶切后,获得618 bp的插入片段;
空质粒未被酶切,表明藏羊HSP27基因的克隆成功(图3)。

图3 克隆双酶切鉴定图
2.2 重组pcDNA3.1a-HSP27真核载体的构建
利用限制性内切酶XhoI、KpnI对重组的真核载体pcDNA3.1a-HSP27、pcDNA3.1a分别进行双酶切检测,由图4可见,重组的真核表达载体pcDNA3.1a-HSP27在5 000 bp和618 bp左右有两条清晰的可见条带,测序结果与已知序列完全相同,表明pcDNA3.1a-HSP27真核载体构建成功。

图4 真核载体构建双酶切鉴定图
2.3 藏羊HSP27基因单克隆抗体的制备
由图5可见,重组HSP27蛋白主要在沉淀中,有利于蛋白的纯化。经4次免疫后小鼠的血清抗体效价达到1∶32 000,表明pcDNA3.1a-HSP27经真核表达所得到的融合蛋白可以诱导小鼠产生良好的免疫反应(图6)。用单克隆抗体在藏羊卵巢全蛋白中进行特异性检测,免疫后小鼠血清与藏羊卵巢中HSP27蛋白可获得特异性目的条带,表明制备的抗体具有较好的免疫活性(图7)。
2.4 藏羊HSP27基因编码蛋白的氨基酸含量及磷酸化位点预测
利用Expasy和NetPhos 3.1 Server在线软件分析HSP27基因编码蛋白的氨基酸含量及磷酸化位点,结果表明该蛋白含有20种氨基酸,其中丝氨酸和脯氨酸的含量最高(9.5%),蛋氨酸和半胱氨酸含量最低(0.5%);
图8显示该蛋白有18个丝氨酸磷酸化位点、8个苏氨酸磷酸化位点和3个酪氨酸磷酸化位点,其中18个丝氨酸磷酸化位点包括Ser9、Ser15、Ser44、Ser48、Ser50、Ser70、Ser74、Ser78、Ser79和Ser82等。
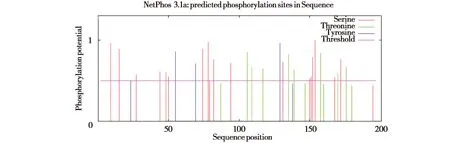
图8 HSP27基因编码蛋白的磷酸化位点分析图
2.5 藏羊卵巢HSP27蛋白相互作用蛋白的鉴定
图9为用双向电泳法分离免疫共沉淀复合物的情况,经鉴定有15种目的蛋白能与HSP27蛋白相互作用,分别为HSP27、热休克蛋白10(HSP10)、细胞外信号调节激酶1(ERK1)、Bcl-2、骨成型蛋白受体1B(BMPR-1B)、亚甲基四氢叶酸还原酶(MTHFR)、Ras同源物基因家族成员D(RhoD)、膜联蛋白A2(Annexin A2,ANXA2)、钙调蛋白(Calmodulin)、转胶蛋白(Transgelin)、生长分化因子5(GDF5)、半乳糖凝集素1(Galectin-1)、磷脂酰乙醇胺结合蛋白(Phosphatidylethanolamine Binding Protein,PEBP)、L-乳酸脱氢酶-1(L-lactate dehydrogenase 1,LDH-1)及铜-锌超氧化物歧化酶(Cu-Zn Superoxide dismutase,SOD[Cu-Zn])。通过免疫印迹法(Western Blot)确认了14种已识别候选蛋白与HSP27蛋白的特异性相互作用(图10)。

图9 藏羊卵巢HSP27蛋白及其相互作用蛋白的双向电泳图

图10 HSP27蛋白相互作用蛋白的Western Blot验证
利用Expasy在线软件分析目的蛋白的基本性质,结果如表2所示。由表2可知15种目的蛋白等电点为4.09~9.80;
除HSP27、HSP10和LDH-1外,亲水性数值都为负(属于疏水蛋白);
Bcl-2在205~226个氨基酸中存在跨膜区域,BMPR-1B在127~148个氨基酸中存在跨膜区域,其他13种蛋白不存在跨膜区域;
所有蛋白都没有信号肽。

表2 目的蛋白基本性质分析表
表3表明HSP27、RhoD和Galectin-1主要分布于细胞外基质,HSP10和ERK1主要分布于线粒体,Bcl-2、MTHFR、ANXA2、Transgelin、GDF5、PEBP、LDH-1和SOD[Cu-Zn]主要分布于细胞质,BMPR-1B主要分布于细胞质膜,Calmodulin主要分布于高尔基体。

表3 目的蛋白亚细胞位置的预测分数

表3(续)
2.6 HSP27基因互作网络分析及通路预测
以前期筛选的15种目的蛋白的调控基因为基础,结合NCBI数据库,利用可视化软件GENEMANIA构建出互作网络,见图11。基于Physical interactions、Shared protein domains、Predicted、Co-expression和Genetic interactions算法共得到34个节点的蛋白互作网络,覆盖了14种目的蛋白,其中MTHFR未与目的蛋白构成互作网络。基于互作结果设计HSP27基因调节藏羊卵母细胞成熟和颗粒细胞凋亡的代谢途径(图12),在该预测途径中发现HSP27基因能激活MAPK、mTOR和TGF-β信号通路,HSP27基因在藏羊卵泡发育中具有重要作用。

图11 HSP27基因互作网络图

图12 HSP27基因通路预测图
综合以上结果,检索KEGG数据库发现,HSP27蛋白与BMPR-1B、GDF5、ERK1、Calmodulin、Bcl-2和SOD[Cu-Zn]具有强烈交互作用。
本研究将HSP27基因目的片段插入pMD19-T载体后,将其与pcDNA3.1a真核表达质粒载体连接,构建出HSP27基因真核表达体系并制备单克隆抗体。HSP27基因的编码区长为618 bp,HSP27蛋白的分子量为22.334 KD,分子式为C999H1539N281O299S2,等电点为6.22。
本研究结果表明藏羊HSP27基因编码蛋白共含有20种氨基酸,其中含量最高的是丝氨酸,占总氨基酸的9.5%,且该蛋白有18个丝氨酸磷酸化位点,包括Ser9、Ser15、Ser44、Ser48、Ser50、Ser70、Ser74、Ser78、Ser79和Ser82等。夏佳音等[12]研究发现HSP27蛋白主要有3个磷酸化位点,分别为Ser15、Ser78和Ser82,这与本文的研究结果有着一定的相似性。磷酸化的HSP27蛋白可与F-actin、β-Arrestin2结合,使其具有稳定细胞骨架和抑制细胞凋亡的功能,从而达到维护细胞稳定和阻止细胞凋亡的作用[13-14]。
本研究发现HSP27蛋白具有结合HSP27、HSP10、ERK1、Bcl-2、BMPR-1B、MTHFR、RhoD、ANXA2、Calmodulin、Transgelin、GDF5、Galectin-1、PEBP、LDH-1和SOD[Cu-Zn]等15种目的蛋白的能力。GDF5、BMPR-1B通过促进孕酮、雌二醇等的合成使卵巢颗粒细胞加快分化,促进卵泡成熟[15-16];
HSP10直接或间接地参与细胞增殖凋亡、生殖等过程[17];
RhoD被激活后参与细胞分化、细胞因子的产生和细胞凋亡等多种细胞生理过程[18];
Calmodulin是细胞内钙离子信号的主要受体,在细胞增殖、凋亡等许多方面起着重要的作用[19];
Transgelin通过抑制GnRH的分泌间接影响动物的繁殖性能[20];
MTHFR基因突变会导致机体细胞的周期调控、DNA复制等生物过程紊乱[21];
SOD[Cu-Zn]可抑制卵母细胞的有丝分裂和减数分裂[22]。HSP27蛋白与14种已识别候选蛋白具有特异性相互作用,可调控细胞的增殖、分化和凋亡。
本研究通过预测HSP27基因在藏羊卵母细胞成熟及颗粒细胞调亡中的作用通路,发现HSP27基因能激活MAPK、mTOR和TGF-β信号通路。通过检索KEGG数据库发现,HSP27蛋白与BMPR-1B、GDF5、ERK1、Calmodulin、Bcl-2和SOD[Cu-Zn]具有强烈交互作用。MAPK信号通路在卵母细胞减数分裂过程起调控作用,参与FSH诱导卵母细胞减数分裂[23]。卵母细胞生发泡破裂期发生的时候,磷酸化的HSP27蛋白能激活p38-MAPK通路导致孕酮等蛋白水平上升从而促进卵母细胞发育成熟[24]。mTOR信号通路是细胞生长的主导信号调节通路,其调节卵母细胞的减数分裂成熟等一系列卵巢功能[25]。TGF-β信号通路对卵泡细胞的分化和类固醇激素的合成具有重要的调节作用。因此,HSP27基因在藏羊卵巢卵泡发育和卵母细胞成熟过程中具有重要作用。
猜你喜欢 真核卵母细胞磷酸化 阿尔茨海默病脑TAU蛋白磷酸化位点综述中风与神经疾病杂志(2022年9期)2022-10-19外源因子调控卵母细胞体外成熟的研究进展中国畜牧杂志(2022年9期)2022-09-14外源褪黑素对猪卵母细胞体外成熟及多精受精的影响中国畜牧杂志(2022年4期)2022-04-15T69E模拟磷酸化修饰对Bcl-2与Nur77相互作用的影响波谱学杂志(2022年1期)2022-03-15GDM孕妇网膜脂肪组织中Chemerin的表达与IRS-1及其酪氨酸磷酸化分析昆明医科大学学报(2022年1期)2022-02-28牛卵母细胞玻璃化冷冻研究进展湖北畜牧兽医(2021年8期)2021-11-28科学家开发出人工基因组高效简化策略科学导报(2021年3期)2021-02-22小鼠转录因子STATl真核表达质粒的构建及生物学功能分析江苏农业学报(2019年1期)2019-09-10磷酸化肽富集新方法研究进展分析化学(2017年12期)2017-12-25人工再造真核生命问世科学24小时(2017年5期)2017-05-19推荐访问:纯化 产物 基因